Neuroplasticidad para la protección de las neuronas: el papel de los endocannabinoides en el circuito de la recompensa
El circuito de la recompensa
Las conductas instintivas relacionadas con la supervivencia de los organismos o las especies, tales como la ingesta de alimento, la conducta maternal y la conducta sexual, activan un circuito neuronal (ver glosario para los términos en cursivas) específico, denominado circuito de la recompensa. Este circuito está formado por neuronas dopaminérgicas que surgen de una región del cerebro denominada área tegmental ventral (ATV) y envían sus proyecciones a otra región cerebral llamada núcleo accumbens (NAcc) (Figura 1).
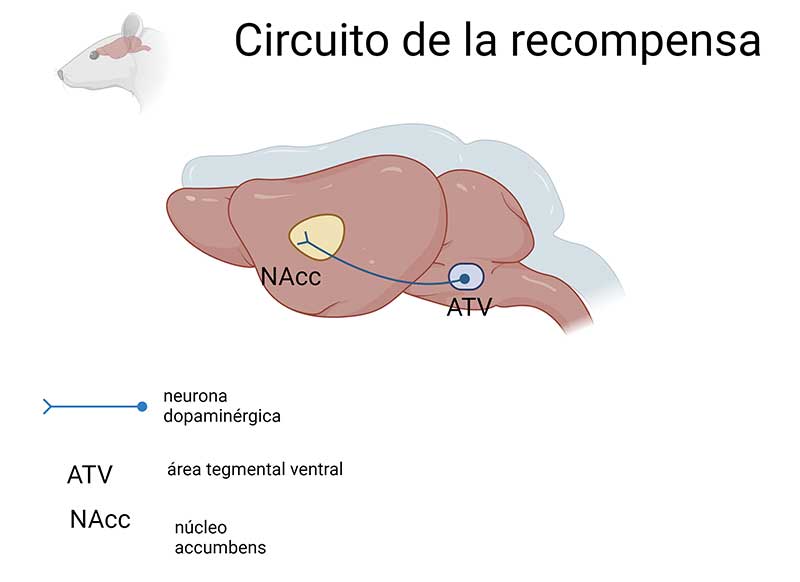
La activación de este circuito aumenta los niveles del neurotransmisor dopamina (DA) en el NAcc, lo que les confiere a dichas conductas un carácter recompensante, es decir placentero, lo que da por resultado que los individuos (humanos y no humanos) busquen repetir la experiencia. Es decir, la experiencia placentera genera una motivación para volver a realizar estas conductas, lo que contribuye a la preservación de las especies.
El circuito de la recompensa, al igual que el resto del cerebro, tiene la capacidad de adaptarse al entorno, cosa que logra reorganizando sus funciones, sus conexiones e incluso su estructura. Esta capacidad se conoce como neuroplasticidad y es una actividad esencial para el buen funcionamiento del cerebro.
Plasticidad cerebral
Tanto las neuronas como los circuitos neuronales presentan cambios plásticos durante el desarrollo cerebral; también se producen cambios neuroplásticos en respuesta a la información sensorial que llega a los circuitos neuronales durante una experiencia, en respuesta a la adquisición de información nueva que se genera durante el aprendizaje y la memoria, y en respuesta a daños en el cerebro.
Durante el desarrollo, los cambios plásticos consisten principalmente en el brote de ramificaciones de las neuronas, que establecen nuevas conexiones con otras neuronas. A las conexiones entre neuronas se les denomina sinapsis. La información sensorial que se produce durante la realización de una actividad (experiencia) es procesada en el cerebro y produce cambios plásticos que consisten en reforzar o debilitar las sinapsis. Así, aquellas conexiones neuronales involucradas en actividades que se realizan frecuentemente, se refuerzan mientras que aquellas que se utilizan poco se debilitan, e incluso pueden eliminarse, lo que se conoce como poda neuronal. Estos cambios plásticos son particularmente intensos durante el proceso de maduración del cerebro, en la niñez y la adolescencia.
Por otro lado, la adquisición de información nueva genera neuroplasticidad asociada al aprendizaje y a la memoria, lo que permite almacenarla a través del establecimiento de nuevas conexiones y de ajustes en la fuerza de las sinapsis (reforzamiento o debilitamiento de las conexiones entre neuronas). Asimismo, después de un daño físico al cerebro (traumatismo), como el que se produce durante un accidente cerebrovascular que ocasiona la pérdida de ciertas funciones, los mecanismos de neuroplasticidad ayudan al cerebro a tratar de compensar las funciones que se perdieron, a través de la generación de nuevas conexiones.
Finalmente, la estimulación intensa de una neurona por un neurotransmisor excitatorio como el glutamato puede tener como consecuencia que ésta sufra daños o incluso que muera, debido a un fenómeno llamado excitotoxicidad. Por ello, cuando las neuronas son estimuladas de forma extrema se activan mecanismos para contrarrestar esa sobreestimulación. Estos mecanismos pueden inducir cambios neuroplásticos que modifican su funcionamiento. Entre estos mecanismos está la producción de un grupo de compuestos denominados endocannabinoides (eCBs).
Endocannabinoides
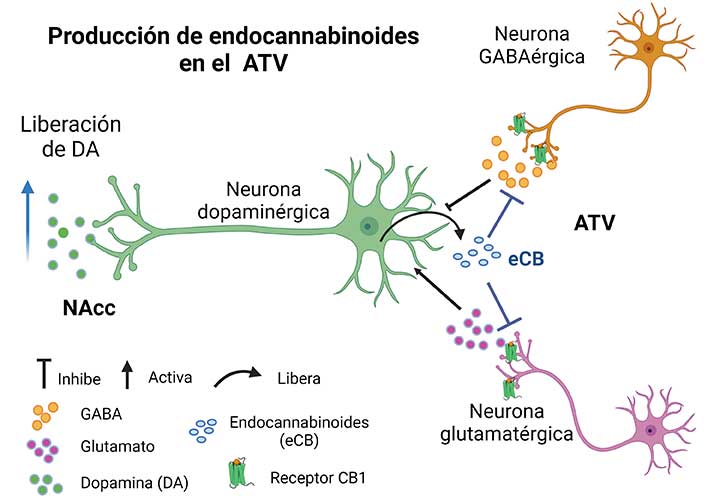
Los eCBs son mensajeros químicos con una estructura química similar a la del compuesto activo de la Cannabis (marihuana), que son producidos por el organismo. En el cerebro actúan como neurotransmisores, pero a diferencia de éstos, no están almacenados en las neuronas para ser liberados cuando éstas son activadas, sino que se producen (se sintetizan) en respuesta a ciertos estímulos, como la activación intensa de una neurona, es decir, se producen “a demanda” para modular el funcionamiento de los circuitos neuronales, por lo que se consideran neuromoduladores. Otra particularidad de los eCBs es que son mensajeros retrógrados, es decir, se producen en el cuerpo de la neurona que recibe la estimulación y actúan sobre la neurona que está liberando el neurotransmisor responsable de esa estimulación para frenar esa liberación, y así interrumpir sus efectos (Figura 2). De esta forma, los eCBs pueden regular la comunicación en las sinapsis y por ello tienen la capacidad de afectar una gran cantidad de funciones.
Neuroplasticidad en el circuito de la recompensa inducida por conductas instintivas
Investigaciones en nuestro laboratorio han demostrado en ratas macho que la estimulación intensa del circuito de la recompensa, producida por una conducta instintiva, en este caso la conducta sexual, promueve cambios neuroplásticos (Rodríguez-Manzo et al., 2011).
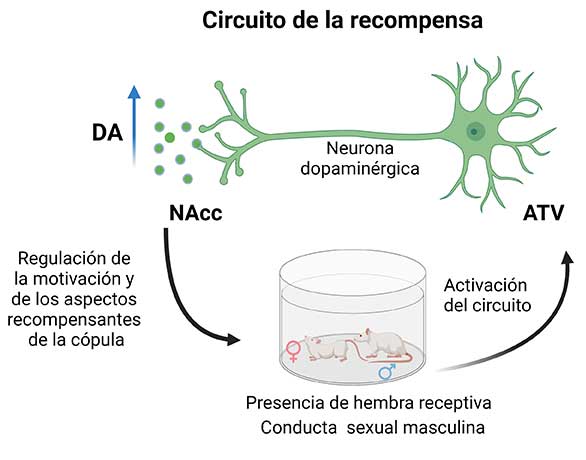
El circuito de la recompensa es activado tanto por la presencia de una hembra receptiva, que es el estímulo que desencadena la conducta sexual, así como por la actividad sexual misma. A su vez, este circuito regula los aspectos recompensantes de la actividad sexual y la motivación para ejecutarla. Es decir, se trata de una relación bidireccional entre este circuito y la actividad sexual (Figura 3).
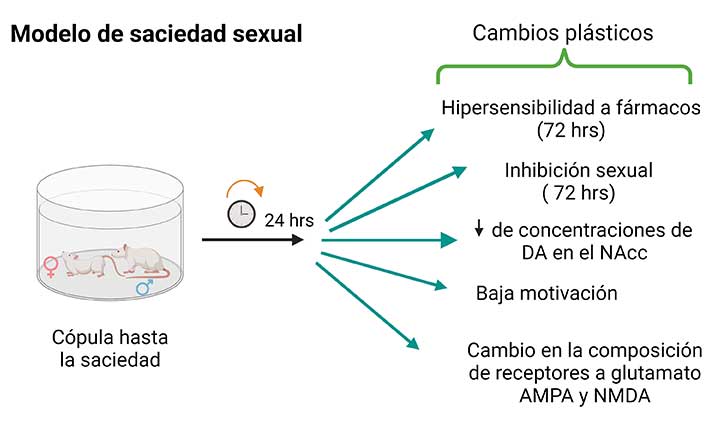
Si se permite a ratas macho desplegar actividad sexual hasta la saciedad, los animales presentarán un promedio de 7 eyaculaciones sucesivas. Como resultado de esta actividad sexual intensa se producen cambios neuroplásticos que se reflejan 24 hrs después, tanto en el funcionamiento del circuito como en la expresión de la conducta sexual masculina. Así, los machos sexualmente saciados presentan una inhibición sexual de larga duración (alrededor de 72 hrs), que indica que hubo cambios en el funcionamiento del circuito que regula la motivación para copular. Esta inhibición sexual es muy interesante, pues dado que la cópula es una conducta instintiva, resulta muy difícil explicar que las ratas macho no presenten actividad sexual en presencia de una hembra receptiva. Por otro lado, los animales sexualmente saciados muestran una hipersensibilidad a los efectos de los fármacos durante esas mismas 72 hrs. Este cambio en la sensibilidad es otro indicador de que el funcionamiento del circuito se ha modificado (Figura 4) (Rodríguez-Manzo et al., 2011).
Hemos logrado generar así un modelo de estimulación intensa del circuito de la recompensa por una conducta natural, que produce cambios neuroplásticos en animales que no han recibido ningún tratamiento o manipulación experimental, es decir, en condiciones fisiológicas. Con este modelo se pueden evaluar los cambios neuroplásticos del circuito a través de la conducta.
Utilizando este modelo, hemos detectado que en los machos sexualmente saciados hay una disminución en las concentraciones de DA en el NAcc, que coincide con una disminución en la motivación para copular y con la inhibición sexual de larga duración (Figura 4). Resulta por demás interesante que la administración de ciertos fármacos revierte esa inhibición sexual y provoca un aumento en las concentraciones de DA en el NAcc que coincide con el despliegue de actividad sexual en los machos sexualmente saciados (Canseco-Alba et al., 2022).
Papel de los endocannabinoides en la neuroplasticidad del circuito de la recompensa inducida por la actividad sexual intensa
Dado el papel que juegan los eCBs en la regulación de la actividad de los circuitos neuronales, en nuestro laboratorio decidimos determinar si estos neuromoduladores participaban en la neuroplasticidad generada en el circuito mesolímbico por la actividad sexual extrema. Como resultado de nuestras investigaciones pudimos identificar que durante la actividad sexual hasta la saciedad, como resultado de la activación intensa del circuito de la recompensa, hay liberación de eCBs que contribuyen a establecer tanto la inhibición sexual de larga duración como el fenómeno de hipersensibilidad a fármacos. Asimismo, determinamos que estos eCBs se producen en el ATV donde activan receptores a cannabinoides tipo 1 (CB1R) (Rodríguez-Manzo et al., 2023). Es decir, las neuronas dopaminérgicas del ATV producen eCBs en respuesta a la sobreestimulación que, al ser liberados, se unen a los CB1R localizados en las neuronas que liberan el neurotransmisor glutamato (excitador) y las neuronas que liberan el neurotransmisor GABA (inhibidor). Estos dos tipos de neuronas regulan la actividad de las neuronas dopaminérgicas del circuito de la recompensa (Figura 2).
Como se mencionó, la estimulación intensa de una neurona por glutamato puede producir excitotoxicidad. Por ello decidimos investigar la posibilidad de que en ratas macho que copulan hasta la saciedad y que, por lo tanto, activan de forma intensa al circuito de la recompensa, se presentaran cambios neuroplásticos asociados a la transmisión glutamatérgica en el ATV, así como determinar si los eCBs que se liberan durante el proceso de cópula participaban en esos cambios. Los resultados de nuestros experimentos nos permitieron establecer que los receptores a glutamato (del tipo AMPA y NMDA) de machos sexualmente saciados, presentan cambios en su composición (Figura 4), que dan por resultado una reducción en la estimulación producida por el glutamato sobre las neuronas dopaminérgicas y que algunos de esos cambios dependen de las acciones de los eCBs (Rodríguez-Manzo et al., 2023).
Conclusiones
Nuestras investigaciones muestran que la ejecución extrema de una conducta natural, la conducta sexual, puede generar una condición de sobreestimulación del circuito de la recompensa, que produce cambios neuroplásticos que se reflejan en alteraciones en la conducta. Por ello el fenómeno de saciedad sexual sirve como modelo para estudiar los mecanismos de regulación de la actividad de este circuito, en condiciones fisiológicas y en animales intactos. Este modelo nos permitió detectar que la producción de eCBs es uno de los mecanismos que operan en este circuito para controlar la sobreestimulación, y determinar también que la producción de cambios neuroplásticos en la transmisión glutamatérgica es otro de ellos. Los cambios en el funcionamiento del circuito se manifiestan tanto como alteraciones conductuales (reducción de la motivación e inhibición sexual) como modificaciones en la actividad de sus neuronas (reducción de los niveles de DA en el NAcc e hipersensibilidad a fármacos). El circuito de la recompensa juega un papel central en la regulación de la motivación, y su disfunción se asocia a múltiples enfermedades neuropsiquiátricas y a la adicción a drogas. Nuestros hallazgos contribuyen a una mejor comprensión de la relación entre la actividad de este circuito y la motivación, así como de los mecanismos que regulan dicha actividad, lo que favorecerá el desarrollo de nuevas terapias farmacológicas para el tratamiento de estos padecimientos.
Glosario
Circuito neuronal: conjunto de neuronas interconectadas que al ser activadas funcionan en conjunto para regular una función específica.
Excitotoxicidad: es el proceso patológico por el cual las neuronas son dañadas severamente o mueren a consecuencia de la acumulación tóxica de calcio que es resultado de su estimulación excesiva por la acción de neurotransmisores excitatorios como el glutamato.
Neuroplasticidad: es la capacidad que tiene el sistema nervioso para modificar su actividad en respuesta a estímulos externos o internos, es decir para adaptarse, a través de reorganizar su estructura, sus funciones o sus conexiones.
Información sensorial: La información del medio exterior que llega al sistema nervioso a través de los sentidos.
Poda neuronal: proceso natural por el que se eliminan conexiones sinápticas entre neuronas. Es parte del proceso de maduración cerebral.
Endocannabinoides: mensajeros químicos producidos por el organismo, que tienen una estructura química similar al Delta-9-THC, que es el componente psicoactivo de la marihuana. El nombre científico de la planta de la marihuana es Cannabis sativa y sus derivados reciben el nombre de cannabinoides. Así, el término endocannabinoide hace referencia a los cannabinoides de origen endógeno.
Referencias
Canseco-Alba, A., Coffeen, U., Jaimes, O., Pellicer, F., Rodríguez-Manzo, G. (2022). The nucleus accumbens dopamine increase, typically triggered by sexual stimuli in male rats, is no longer produced when animals are sexually inhibited due to sexual satiety. Psychopharmacology 239: 3679-3695
Rodríguez-Manzo, G., Guadarrama-Bazante, L., Morales-Calderón, A. (2011). Recovery from sexual exhaustion-induced copulatory inhibition and drug hypersensitivity follow a same time course: two expressions of a same process? Behavioural Brain Research 217: 253-270
Rodríguez-Manzo, G., González-Morales, E., Garduño-Gutiérrez, R. (2021) Endocannabinoids released in the ventral tegmental area during copulation to satiety modulate changes in glutamate receptors associated to synaptic plasticity processes. Frontiers in Synaptic Neuroscience 13: 701290
Rodríguez-Manzo, G., Canseco-Alba, A. (2023). The endogenous cannabinoid system modulates male sexual behavior expression. Frontiers in Behavioral Neuroscience 17: 1198077
*Foto de portada creada con la ayuda de DALL·E





 Food Biotechnology & Engineering Series
Food Biotechnology & Engineering Series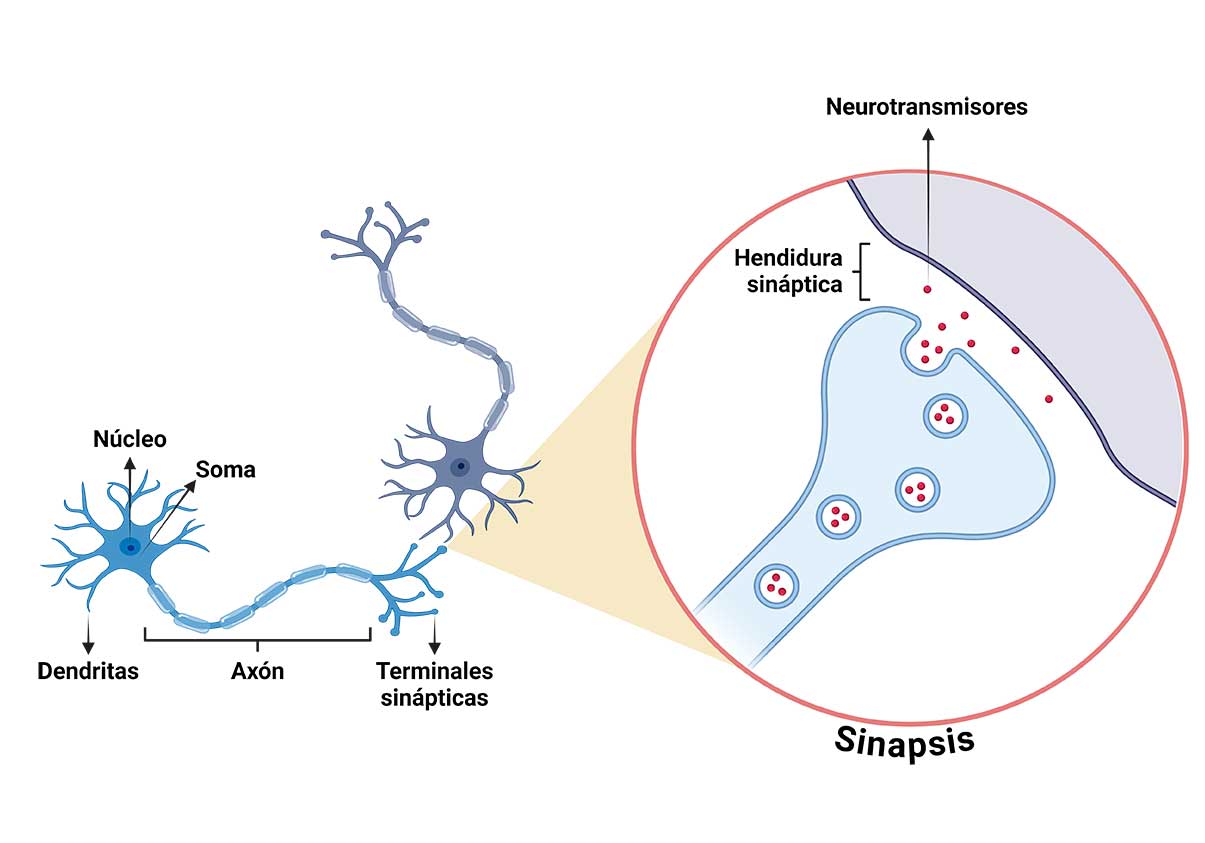
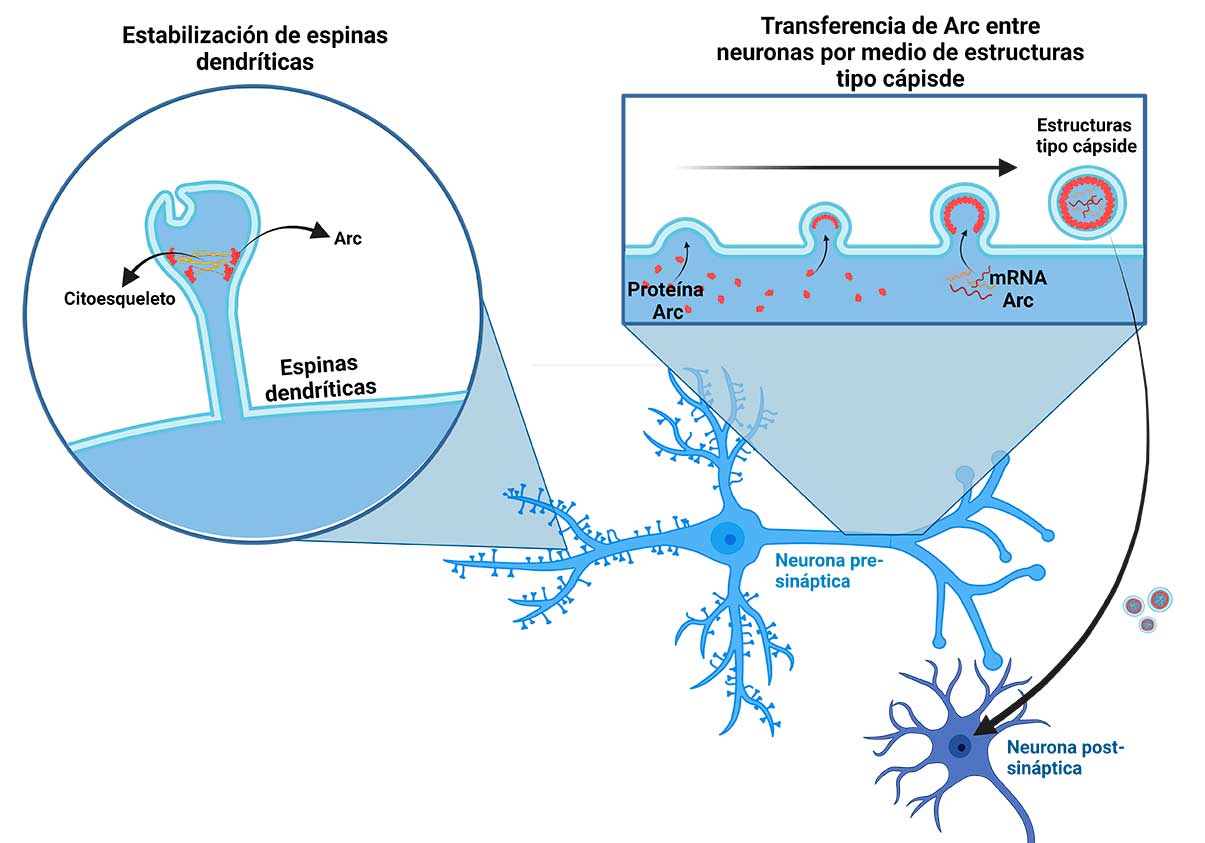
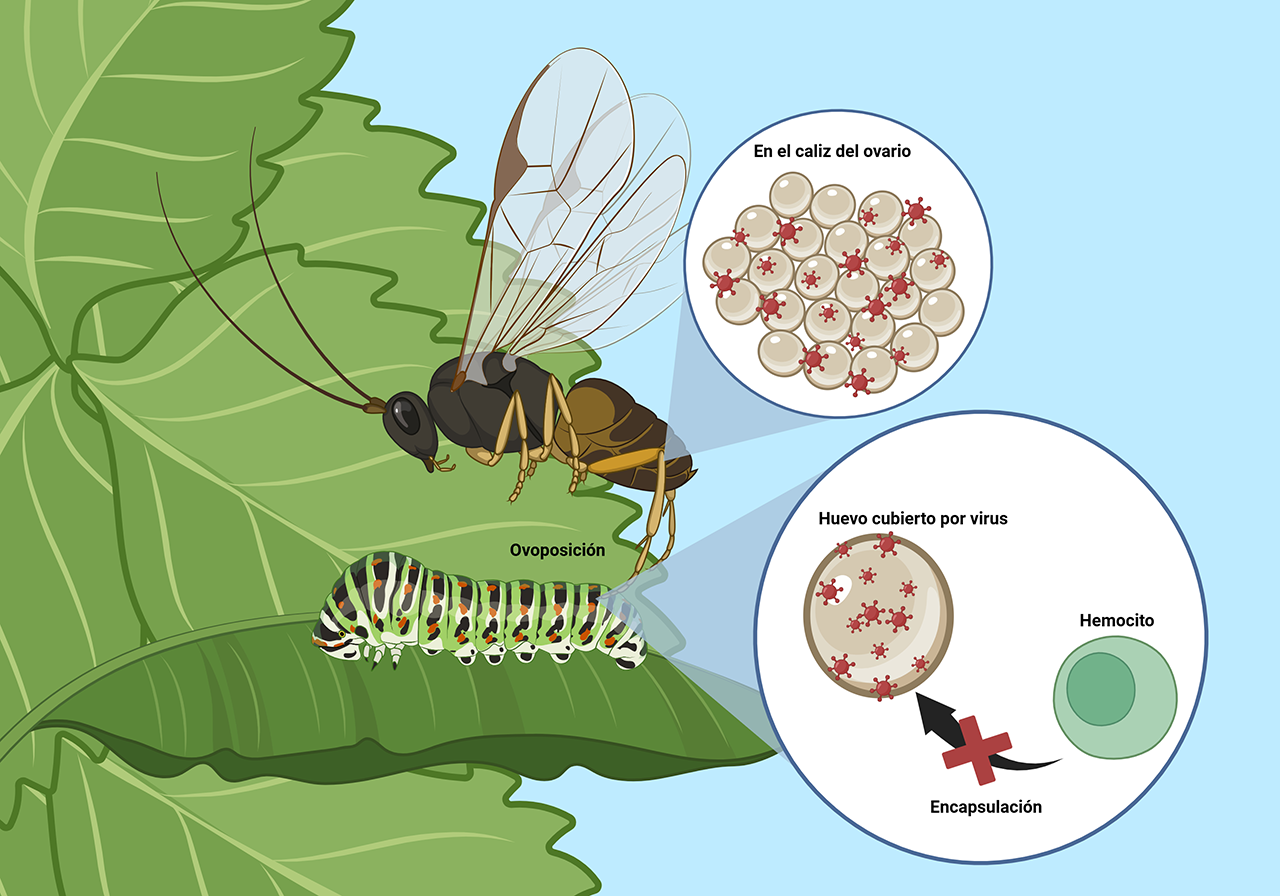
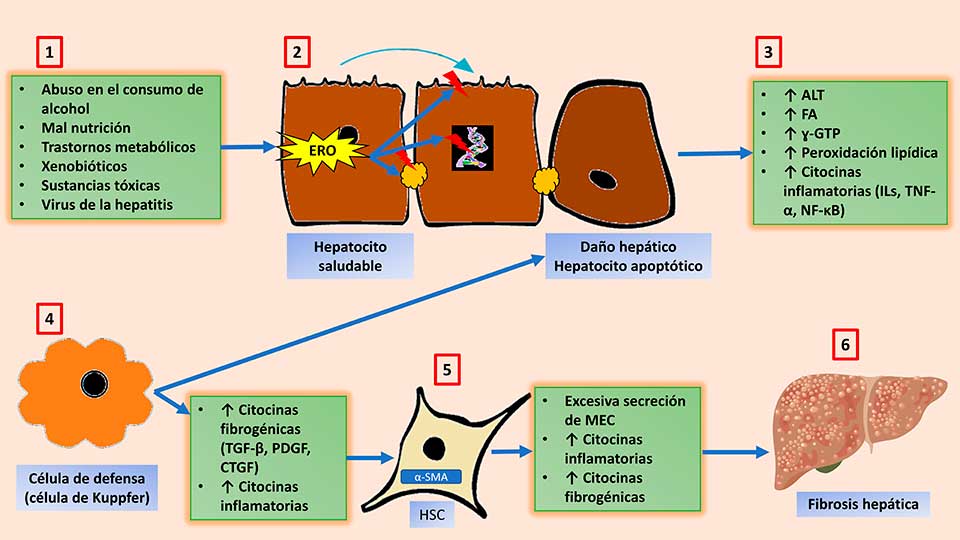
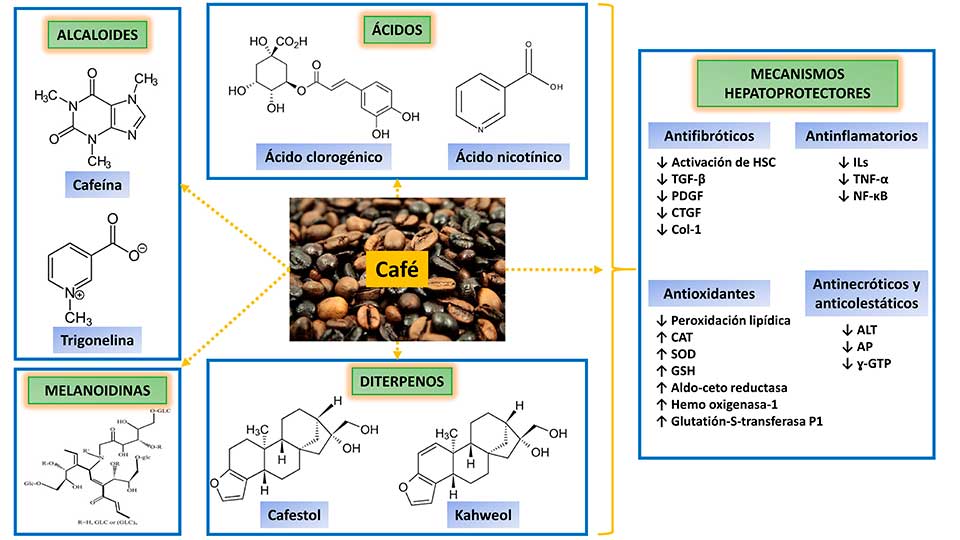
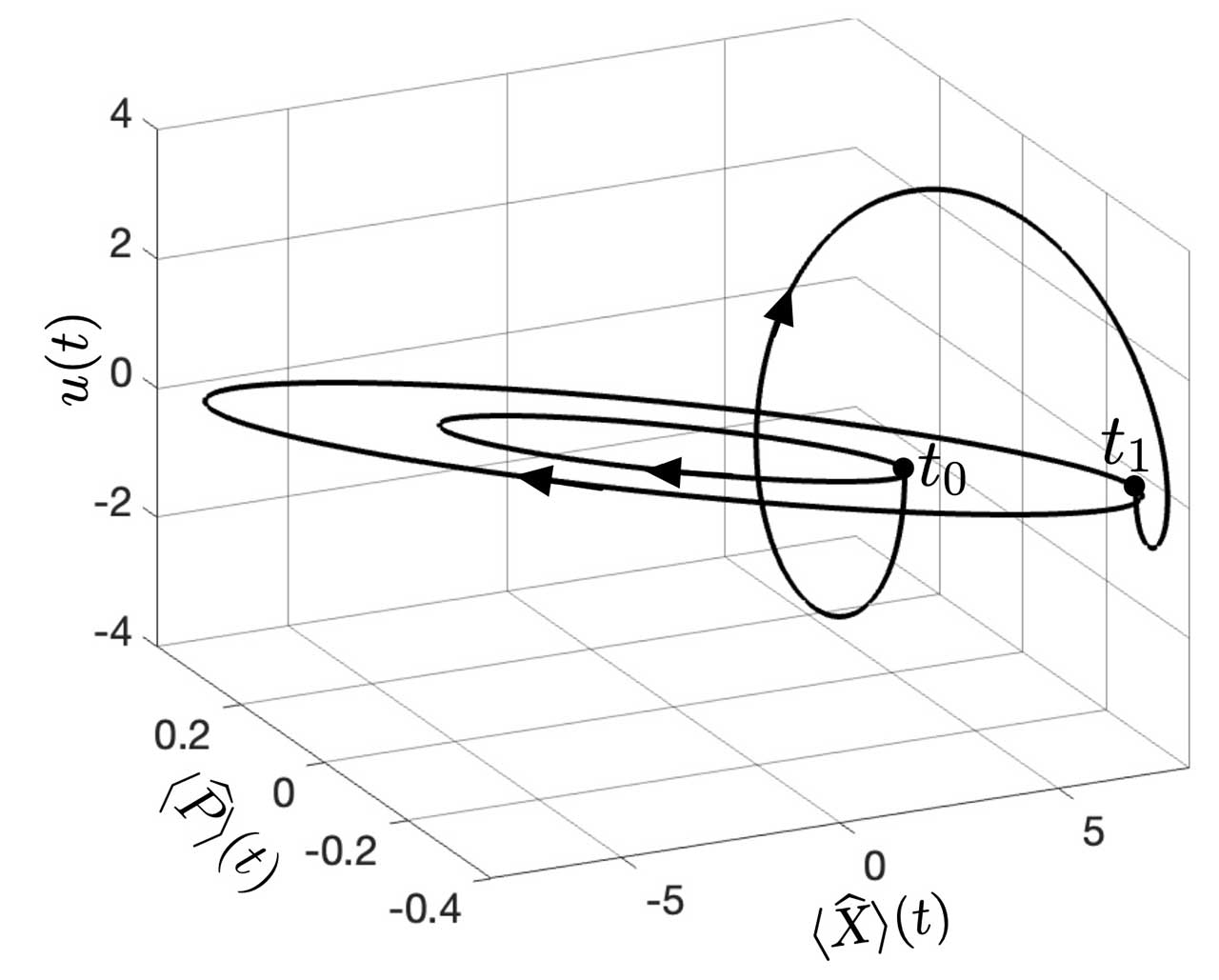 Figura 1. Representación gráfica de dos estados oscilatorios elípticos, caracterizados por el momento(t) y la distancia (t) intermoleculares promedios, con la respectiva ley de control u(t).
Figura 1. Representación gráfica de dos estados oscilatorios elípticos, caracterizados por el momento(t) y la distancia (t) intermoleculares promedios, con la respectiva ley de control u(t).