Arqueas, microorganismos antiguos de nuestro intestino
“Ni siquiera creo que sean bacterias, Wolfe.” Es una traducción de lo que le dijo Carl Woese a su colega microbiólogo Ralph Wolfe al observar la secuencia del gen 16S ribosomal de un organismo metanógeno. Este descubrimiento se volvería un parteaguas en la biología. Sería en 1977 cuando Carl Woese y George E. Fox propondrían un tercer dominio de la vida; en ese entonces las llamarían “arqueobacterias”. Ahora simplemente son “arqueas” (Edward F. De Long et al., 2014).
Las arqueas son organismos procariontes que datan de aproximadamente 2500 millones de años; de hecho, son considerados de los primeros seres vivos en el planeta Tierra (Gribaldo & Brochier-Armanet, 2006). Se considera que la vida se originó en condiciones hostiles con una atmósfera escasa de oxígeno en un periodo temprano conocido como “Eón Arcaico”, donde abundaba una mezcla de gases compuesta por carbono, nitrógeno e hidrógeno (Martin & Pinti, 2011). Estas condiciones fueron ideales para que las arqueas proliferaran y produjeran metano. Este proceso es conocido como metanogénesis y hasta ahora solamente se ha observado en algunos grupos de arqueas, siendo ésta una de las características únicas del dominio Arquea (Lyu et al., 2018).
Las arqueas tienen una morfología muy similar a las bacterias. Tan es así, que por mucho tiempo se consideraron bacterias productoras de metano (DeLong & Pace, 2001). Contrario a lo que la intuición nos haría pensar, las arqueas están más cercanamente relacionadas con el dominio Eucaria (que incluyen a las plantas, hongos y animales), que con el dominio Bacteria (Eme et al., 2017). De hecho, la composición de la membrana y pared celular de las arqueas es muy diferente a la de las bacterias; las primeras poseen una capa externa resistente que les confiere tolerancia a ambientes extremos (Fig. 1) (Albers & Meyer, 2011). Por esto se asumió que eran extremófilas, ya que principalmente se les aislaba de fuentes hipertermales, lagunas hipersalinas o de extrema acidez (DeLong, 1998). Sin embargo, estos microorganismos que parecen tan lejanos habitan también dentro de nuestro cuerpo.
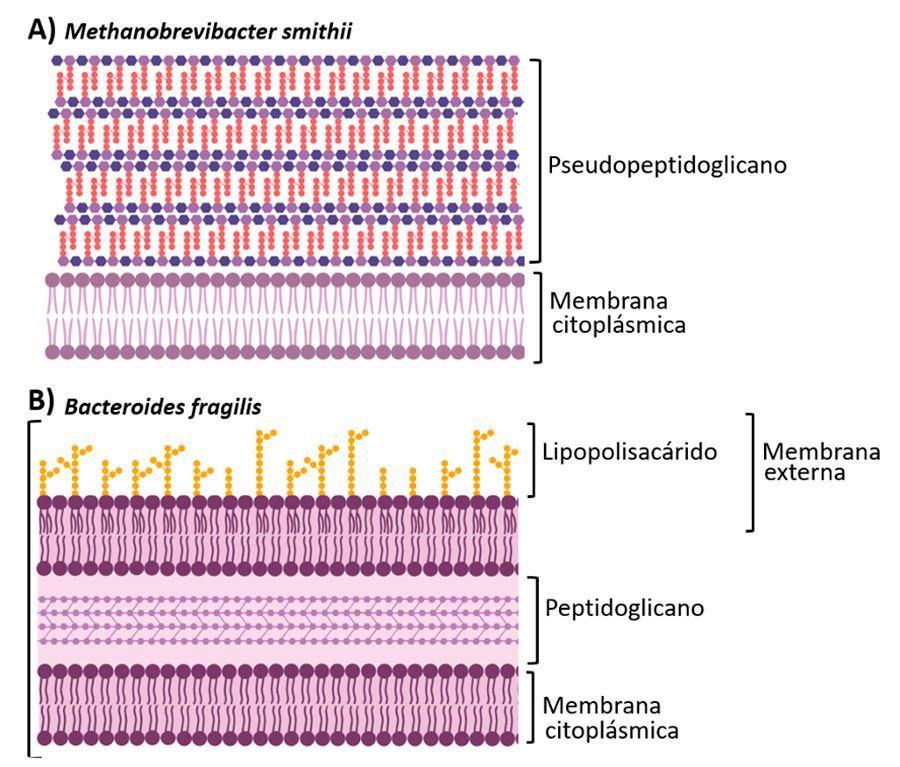
Arqueas en el cuerpo humano
Al hablar de microbiota humana, se piensa en bacterias y usualmente, las relacionamos con patogénesis. No obstante, la microbiota humana comprende mucho más que eso: hongos, virus y por supuesto, arqueas (Jandhyala et al., 2015). Este conjunto de microorganismos se encuentra en diversos sitios de nuestro cuerpo, como piel, boca, pulmones, tracto gastrointestinal y son fundamentales para la salud desde el nacimiento (Dekaboruah et al., 2020). Particularmente, la microbiota intestinal nos ayuda a aprovechar los nutrientes de los alimentos, por lo que está influenciada por la dieta y estilo de vida. El sedentarismo, el consumo de antibióticos y la predisposición genética son factores que alteran a la microbiota. Estas alteraciones en la diversidad de la microbiota o disbiosis, se asocian con padecimientos psiquiátricos, como Alzheimer, esquizofrenia (Rodrigues-Amorim et al., 2018; Zhang et al., 2020), autismo y depresión; y enfermedades metabólicas, como el síndrome del intestino irritable, diabetes y obesidad (Carding et al., 2015; Thursby & Juge, 2017).
En el intestino humano, habitan diversas arqueas con distintas capacidades metabólicas. No obstante, la mayoría de las descritas son metanógenas. Entre ellas, la más común es Methanobrevibacter smithii, seguida por Methanosphaera stadmanae y Methanomassiliicoccus luminyensis (Dridi et al., 2012). Sin embargo, aún no se entiende cuáles son sus efectos para la salud, probablemente por la escasez de reportes de estudios científicos enfocados a sus interacciones con el resto de la microbiota. La asociación más reportada es entre M. smithii y la obesidad en humanos. De hecho, en un grupo de niños mexicanos nuestro grupo de investigación encontró que la abundancia de una especie de Methanobrevibacter no clasificada, está incrementada en aquellos que padecen obesidad (Maya-Lucas et al., 2019). A pesar de esto, no se ha encontrado que este género u otro grupo de arqueas, sean la causa del padecimiento.
Las arqueas tienen una función inigualable en el intestino: la metanogénesis; además, tienen una relación simbiótica con las bacterias fermentadoras del tracto gastrointestinal, que a partir de los alimentos, producen ácidos grasos de cadena corta, que son benéficos para los seres humanos. Las bacterias fermentadoras producen hidrógeno, dióxido de carbono, metanol, entre otros compuestos, que las arqueas transforman en metano (Fig. 2). Con esto, evitan que se concentren altas cantidades de hidrógeno que resultarían tóxicas para las bacterias (Bang & Schmitz, 2015).
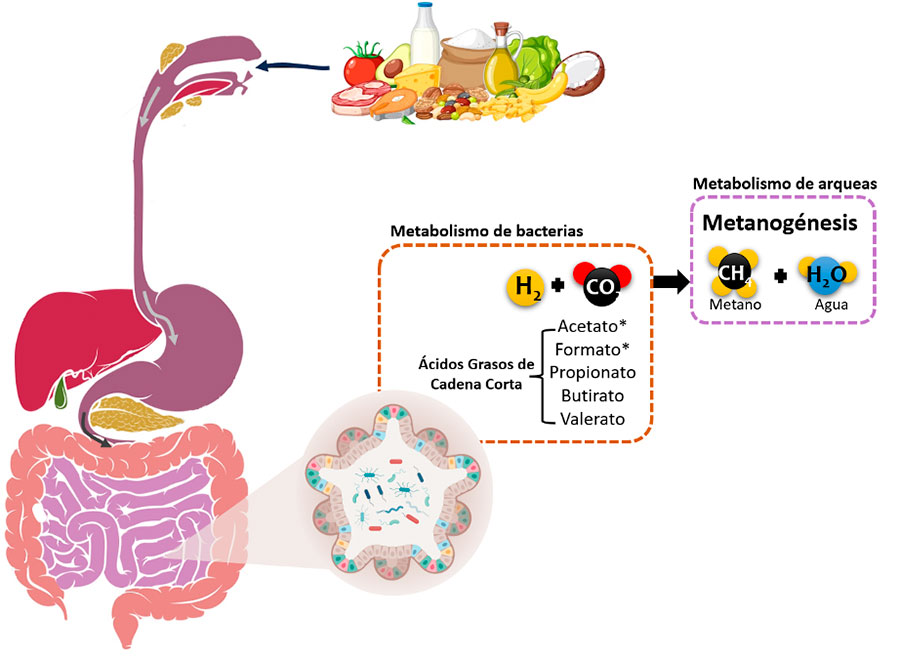
Así como las arqueas fueron de las primeras colonizadoras de la Tierra, también son de las primeras en colonizar el tracto intestinal. Al igual que ocurrió en el Eón Arcaico, las arqueas prosperan en un ambiente con escasez de oxígeno, como es el caso del colon. Con su llegada, facilitan el establecimiento de otros organismos, particularmente las bacterias.
Transmisión de arqueas por leche materna
La leche materna es el alimento ideal para el recién nacido, tanto así, que su composición varía con el tiempo para satisfacer las necesidades energéticas y nutricionales del bebé. A pesar de que por mucho tiempo se pensó que la leche materna era estéril, ahora se sabe que contiene microbiota y prebióticos que favorecen el establecimiento de los colonizadores pioneros. Todo esto la vuelve esencial para el desarrollo del neonato (Selma-Royo et al., 2022).
Se considera que la microbiota de la leche materna proviene principalmente del intestino. En el caso de las bacterias, se ha propuesto que son translocadas desde el intestino a las glándulas mamarias mediante células dendríticas, y que a partir de ahí son transmitidas verticalmente al infante durante la lactancia (la vía enteromammaria). En otras palabras, el intestino del recién nacido es inoculado con bacterias por la leche materna (Moossavi & Azad, 2020). Debido a que también se han detectado arqueas vivas en la leche, se piensa que ocurre lo mismo con ellas (Togo et al., 2019).
El establecimiento de los microorganismos en el intestino del neonato, posiblemente está mediado por inmunoglobulinas presentes en la leche materna. Éstas, también llamadas anticuerpos, son glicoproteínas que se clasifican en inmunoglobulina A (IgA), inmunoglobulina G (IgG), inmunoglobulina M (IgM), inmunoglobulina E (IgE) e inmunoglobulina D (IgD). Sin embargo, solo las primeras tres se han encontrado en la leche. Estos anticuerpos se unen a componentes de la superficie de los microorganismos y regulan las poblaciones mediante mecanismos de inclusión o de exclusión. La inclusión inmunitaria hace referencia a un proceso en el que los anticuerpos se unen a los microorganismos y funcionan como anclas que retienen a poblaciones específicas. Estas poblaciones interactúan continuamente con el sistema inmunológico para generar respuestas anti-inflamatorias a su presencia, por lo que se considera que inducen mecanismos de tolerancia. Por el contrario, la unión de los anticuerpos en la superficie de los microorganismos también puede limitar su motilidad y favorecer su aglutinamiento en el lumen intestinal, de modo que éstos son eliminados por contracciones musculares (peristalsis) (Fig. 3.). A esto se le conoce como exclusión inmunitaria. Estos mecanismos de selección sugieren que las inmunoglobulinas modelan la microbiota intestinal (Chen et al., 2020).
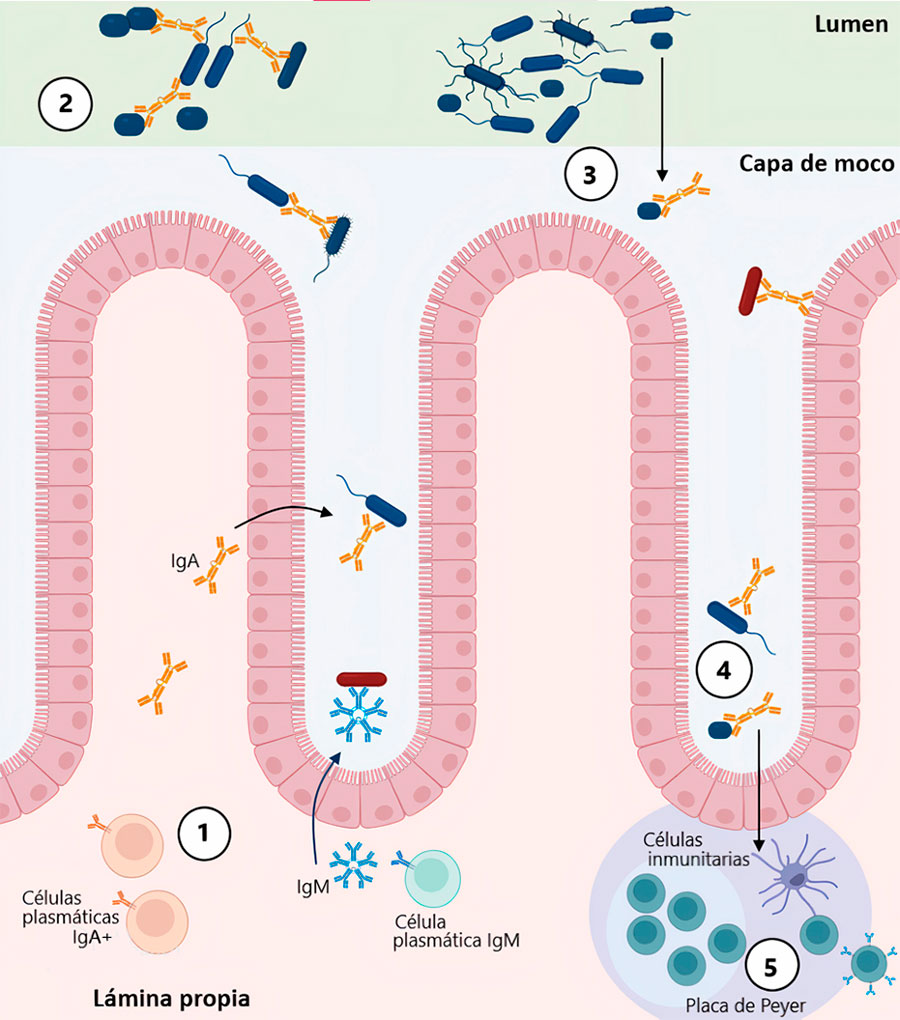
Conclusión
En efecto, lo que Carl Woese observaba no eran bacterias. Este descubrimiento revolucionaría la comprensión de la diversidad microbiana y también de la evolución de los organismos multicelulares. Aunque inicialmente se pensó que las arqueas eran exclusivas de entornos extremos, como el fondo del océano y las fuentes termales volcánicas, ahora se sabe que también son parte de nuestra microbiota. En el intestino, las arqueas son relevantes para el mantenimiento del microambiente que permite el funcionamiento de la comunidad de bacterias fermentadoras. Así mismo, su presencia en la leche materna sugiere que se transmiten de madre a hijo durante el amamantamiento, por lo que es posible que sean colonizadores tempranos durante la infancia. Sin embargo, el impacto de su presencia en el intestino en desarrollo, así como en el intestino adulto, aún no está bien estudiado. No obstante, los hallazgos recientes sirven como invitación para profundizar en la investigación sobre el papel de las arqueas en la salud humana y subrayan la importancia de comprender y preservar la diversidad microbiana en nuestro cuerpo.
Agradecimientos
Este trabajo ha sido escrito con apoyo CONAHCyT FORDECYT-PRONACES/6669/2020 “Estudio de la vía Tracto-Digestivo-Materno►Leche-Materna►Tracto-digestivo-neonato. Una aproximación Ómica”.
Bibliografía
Albers, S. V., & Meyer, B. H. (2011). The archaeal cell envelope. In Nature Reviews Microbiology (Vol. 9, Issue 6, pp. 414–426). https://doi.org/10.1038/nrmicro2576
Bang, C., & Schmitz, R. A. (2015). Archaea associated with human surfaces: Not to be underestimated. FEMS Microbiology Reviews, 39(5), 631-648. https://doi.org/10.1093/femsre/fuv010
Carding, S., Verbeke, K., Vipond, D. T., Corfe, B. M., & Owen, L. J. (2015). Dysbiosis of the gut microbiota in disease. Microbial Ecology in Health and Disease, 26(s2), 26191. https://doi.org/10.3402/mehd.v26.26191
Chen, K., Magri, G., Grasset, E. K., & Cerutti, A. (2020). Rethinking mucosal antibody responses: IgM, IgG and IgD join IgA. In Nature Reviews Immunology (Vol. 20, Issue 7, pp. 427–441). Nature Research. https://doi.org/10.1038/s41577-019-0261-1
Dekaboruah, E., Suryavanshi, M. V., Chettri, D., & Verma, A. K. (2020). Human microbiome: An academic update on human body site specific surveillance and its possible role. Archives of Microbiology, 202(8), 2147-2167. https://doi.org/10.1007/s00203-020-01931-x
DeLong, E. F. (1998). Everything in moderation: Archaea as ‘non-extremophiles’. Current Opinion in Genetics & Development, 8(6), 649-654. https://doi.org/10.1016/S0959-437X(98)80032-4
DeLong, E. F., & Pace, N. R. (2001). Environmental Diversity of Bacteria and Archaea. Systematic Biology, 50(4), 470-478. https://doi.org/10.1080/10635150118513
Dridi, B., Henry, M., Richet, H., Raoult, D., & Drancourt, M. (2012). Age-related prevalence of Methanomassiliicoccus luminyensis in the human gut microbiome. APMIS, 120(10), 773-777. https://doi.org/10.1111/j.1600-0463.2012.02899.x
Edward F. De Long, Stephen Lory, Erko Stackebrandt, & Fabiano Thompson. (2014). The Prokaryotes: Other Major Lineages of Bacteria and The Archaea (4.a ed.). Springer. https://link.springer.com/referencework/10.1007/978-3-642-38954-2
Eme, L., Spang, A., Lombard, J., Stairs, C. W., & Ettema, T. J. G. (2017). Archaea and the origin of eukaryotes. Nature Reviews Microbiology, 15(12), Article 12. https://doi.org/10.1038/nrmicro.2017.133
Gribaldo, S., & Brochier-Armanet, C. (2006). The origin and evolution of Archaea: A state of the art. Philosophical Transactions of the Royal Society B: Biological Sciences, 361(1470), 1007-1022. https://doi.org/10.1098/rstb.2006.1841
Jandhyala, S. M., Talukdar, R., Subramanyam, C., Vuyyuru, H., Sasikala, M., & Reddy, D. N. (2015). Role of the normal gut microbiota. World Journal of Gastroenterology : WJG, 21(29), 8787-8803. https://doi.org/10.3748/wjg.v21.i29.8787
Lyu, Z., Shao, N., Akinyemi, T., & Whitman, W. B. (2018). Methanogenesis. Current Biology: CB, 28(13), R727-R732. https://doi.org/10.1016/j.cub.2018.05.021
Martin, H., & Pinti, D. L. (2011). Archean Eon. En M. Gargaud, R. Amils, J. C. Quintanilla, H. J. (Jim) Cleaves, W. M. Irvine, D. L. Pinti, & M. Viso (Eds.), Encyclopedia of Astrobiology (pp. 61-69). Springer. https://doi.org/10.1007/978-3-642-11274-4_98
Maya-Lucas, O., Murugesan, S., Nirmalkar, K., Alcaraz, L. D., Hoyo-Vadillo, C., Pizano-Zárate, M. L., & García-Mena, J. (2019). The gut microbiome of Mexican children affected by obesity. Anaerobe, 55, 11-23. https://doi.org/10.1016/j.anaerobe.2018.10.009
Moossavi, S., & Azad, M. B. (2020). Origins of human milk microbiota: New evidence and arising questions. Gut Microbes, 12(1), 1667722. https://doi.org/10.1080/19490976.2019.1667722
Rodrigues-Amorim, D., Rivera-Baltanás, T., Regueiro, B., Spuch, C., de las Heras, M. E., Vázquez-Noguerol Méndez, R., Nieto-Araujo, M., Barreiro-Villar, C., Olivares, J. M., & Agís-Balboa, R. C. (2018). The role of the gut microbiota in schizophrenia: Current and future perspectives. The World Journal of Biological Psychiatry, 19(8), 571-585. https://doi.org/10.1080/15622975.2018.1433878
Selma-Royo, M., Calvo-Lerma, J., Bäuerl, C., Esteban-Torres, M., Cabrera-Rubio, R., & Collado, M. C. (2022). Human milk microbiota: What did we learn in the last 20 years? Microbiome Research Reports, 1(3), 19. https://doi.org/10.20517/mrr.2022.05
Togo, A. H., Grine, G., Khelaifia, S., des Robert, C., Brevaut, V., Caputo, A., Baptiste, E., Bonnet, M., Levasseur, A., Drancourt, M., Million, M., & Raoult, D. (2019). Culture of Methanogenic Archaea from Human Colostrum and Milk. Scientific reports, 9(1), 18653. https://doi.org/10.1038/s41598-019-54759-x
Thursby, E., & Juge, N. (2017). Introduction to the human gut microbiota. The Biochemical Journal, 474(11), 1823-1836. https://doi.org/10.1042/BCJ20160510
Zhang, M., Zhao, D., Zhou, G., & Li, C. (2020). Dietary Pattern, Gut Microbiota, and Alzheimer’s Disease. Journal of Agricultural and Food Chemistry, 68(46), 12800-12809. https://doi.org/10.1021/acs.jafc.9b08309