Avances terapéuticos en el tratamiento del cáncer: inhibidores de anhidrasas carbónicas
El cáncer comprende un conjunto de enfermedades que preocupa a todos, pues la posibilidad de verse afectados por esta condición genera una gran incertidumbre. Los tratamientos disponibles son agresivos y no específicos, sin ofrecer garantías, ya que el padecimiento suele presentar resistencia al tratamiento y disminuir así las tasas de supervivencia.
En el mundo se reportaron alrededor de 20 millones de nuevos casos de cáncer y 10 millones de muertes causadas por tumores malignos. Se prevé que, en los próximos 20 años, la incidencia aumente en 60%, lo que supondrá graves problemas para los sistemas de salud, personas y comunidades en general (OMS, 2022).
Según datos del INEGI, en 2021 se registraron 1,222,249 decesos en México, de las cuales 90,123 fueron causadas por tumores malignos. Entre las entidades federativas con las tasas más altas de decesos por cáncer se encuentran la Ciudad de México, Colima, Veracruz, Sonora, Chihuahua y Morelos. Los tipos de cáncer más comunes en hombres son los tumores malignos de las meninges, el encéfalo, el estómago y el linfoma de Hodgkin, mientras que, en mujeres, son los tumores malignos de útero, mama y ovario (INEGI, 2023).
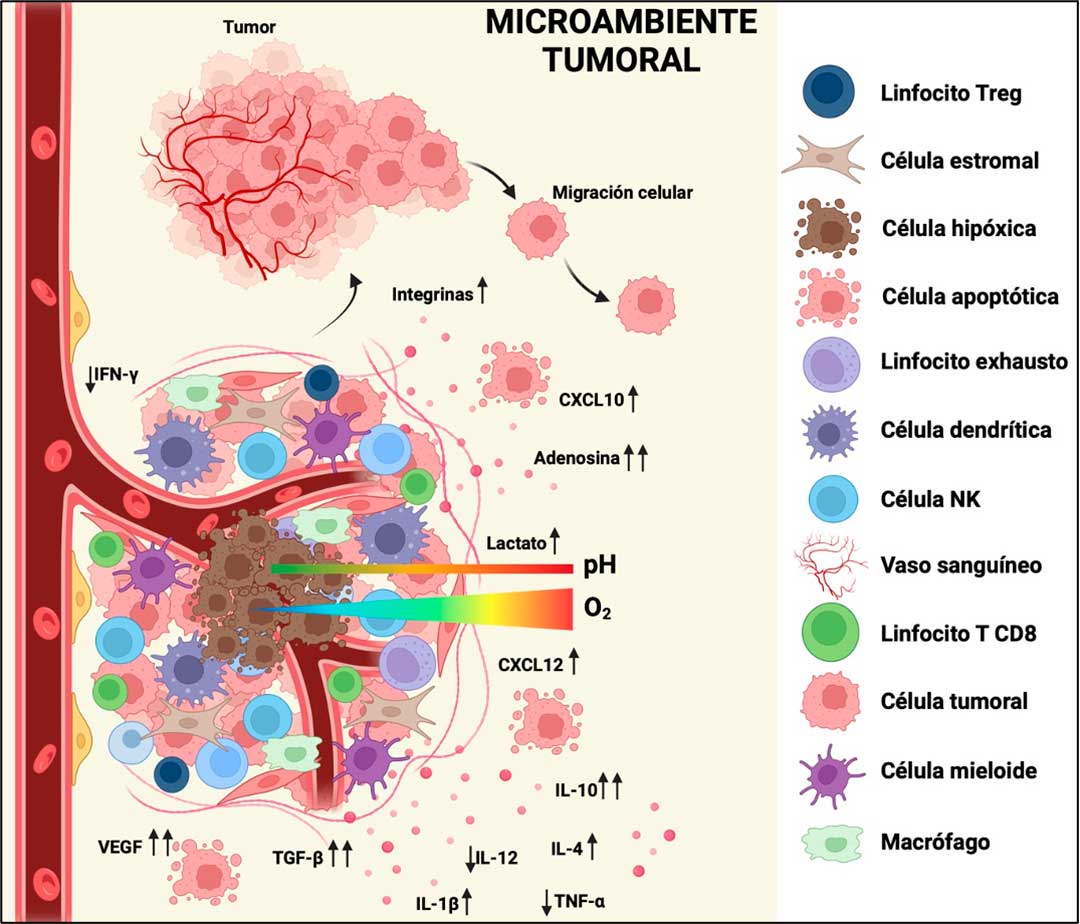
Durante el desarrollo del cáncer, se establecen condiciones que involucran células del sistema inmunológico, tumorales y otras, que secretan diversas sustancias. Estos componentes en conjunto, conforman el microambiente tumoral (MT), el cual desempeña un papel crucial al proporcionar un entorno propicio ácido e hipóxico para que las células cancerosas adquieran la capacidad de invadir otros órganos y tejidos, provocando metástasis, además de evadir al sistema inmunológico (Arneth, 2019) (Figura 1).
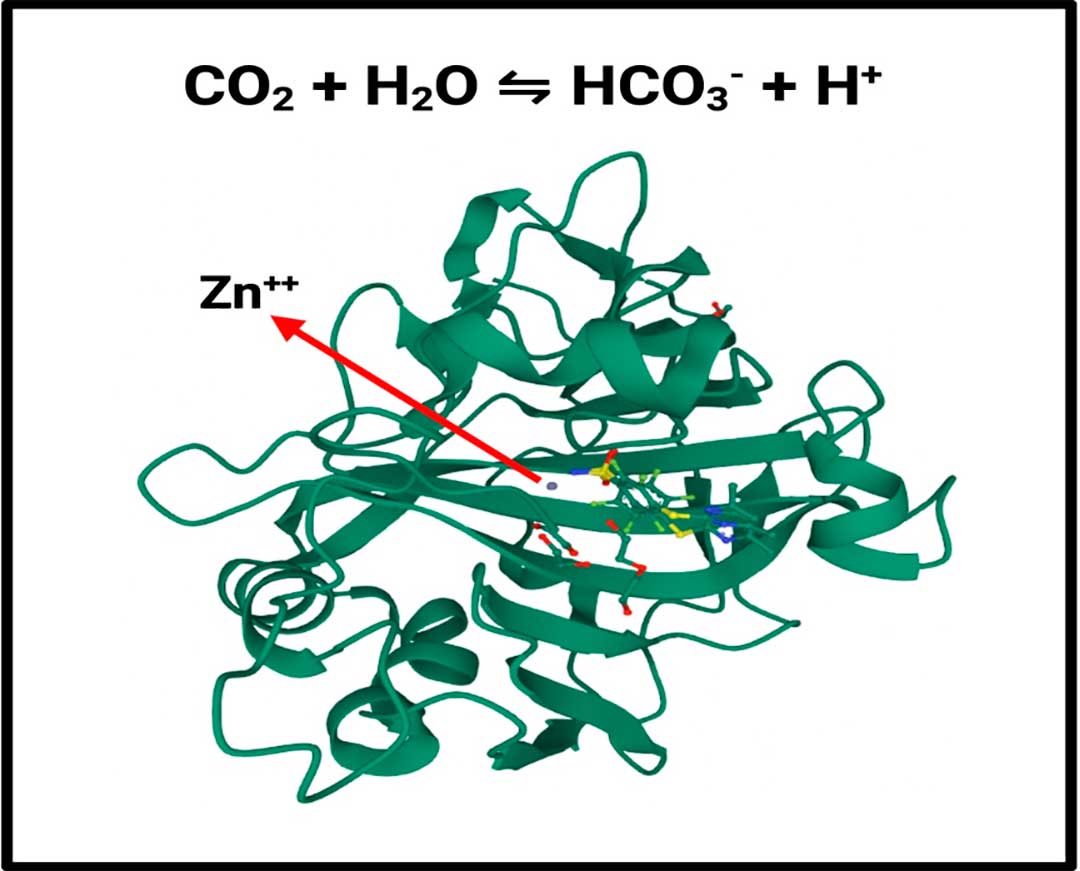
Las anhidrasas carbónicas (CAs), son parte de una familia de metaloenzimas que contienen zinc (Zn2+) en su sitio catalítico, y desempeñan un papel crucial en varios tejidos y procesos biológicos, como la respiración, la regulación ácido-base, la calcificación y la reabsorción ósea. Además, participan en la reacción reversible del dióxido de carbono (CO2) con agua para producir bicarbonato (HCO3–) y un protón (H+), según la reacción: CO2 + H2O <—> HCO3– + H+ (Lindskog, 1997) (Figura 2). Ésto contribuye a mantener el equilibrio del pH intracelular y extracelular, lo cual es esencial para su óptimo funcionamiento. En contexto de cáncer, estas enzimas facilitan la supervivencia celular en condiciones de hipoxia (baja concentración de oxígeno) y acidez (nivel de pH bajo) (Takacova et al., 2022).
Los inhibidores de las anhidrasas carbónicas (CAIs) son fármacos que se unen directamente al ion metálico dentro del sitio activo de la enzima (Zn2+), y se han utilizado durante mucho tiempo con diversas aplicaciones como diuréticos, anticonvulsivos sistémicos, agentes antiglaucomatosos y para tratar el mal de altura. Actualmente se ha propuesto su uso en el tratamiento de diferentes tipos de cáncer. El mecanismo de acción de los CAIs es mediante la inhibición de la reacción enzimática que llevan a cabo las CAs (Figura 3). Estas enzimas son producidas en situaciones donde las células se encuentran en hipoxia, condición frecuente en tumores sólidos y que es un componente importante del MT. En la actualidad, las CAs más estudiadas son la CA IX y la CA XII, debido a su papel relevante durante el desarrollo de los tumores hipóxicos, además de su utilidad como biomarcadores y blancos terapéuticos en diversos tipos de cáncer.
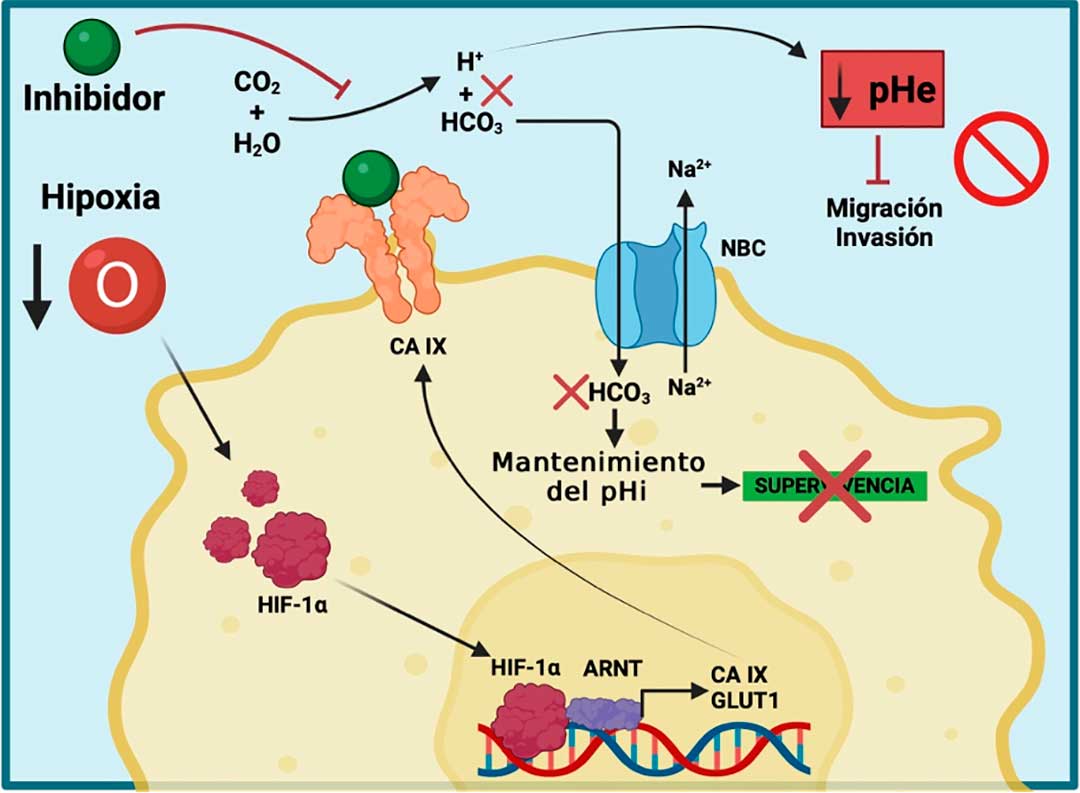
Las células cancerosas, al encontrarse en un ambiente hipóxico y con una alta expresión de CAs, activan mecanismos que las hacen más agresivas favoreciendo su supervivencia, lo que es importante, ya que la función principal de las CAs radica en mantener el equilibrio del pH intracelular y extracelular, permitiendo así que se lleven a cabo las reacciones bioquímicas necesarias para que las células cancerosas puedan sobrevivir en estas condiciones, además de promover la resistencia a los tratamientos con quimioterapia y radiación, esto gracias a la acidificación del pH extracelular (De Milito & Fais, 2005; Tavares-Valente et al., 2013). Este fenómeno contribuye al deterioro de la tasa de supervivencia de los pacientes afectados.
Por lo anterior, comprender la función de estas enzimas en las células cancerosas y el resultado de su inhibición mediante estos fármacos, abre la puerta al desarrollo de estrategias innovadoras para el diseño de moléculas capaces de emplearse como terapias coadyuvantes que permitan disminuir la resistencia a quimioterapéuticos, eliminando así a las células cancerosas y brindar una posible alternativa a los tratamientos convencionales.
Uno de los CAIs más prometedores es el SLC-011, el cual se convirtió en el primer compuesto en completar exitosamente la Fase I de ensayos clínicos para el tratamiento de tumores hipóxicos y metastásicos, en etapas avanzadas con sobreexpresión de la CA IX y la CA XII, ingresando a la Fase II en 2018 (Eloranta et al., 2023; Sarnella et al., 2022).
La inhibición de estas enzimas se ha asociado con la reducción del crecimiento tumoral, la invasión y la metástasis (Betof et al., 2012; Chiang et al., 2002; Chiche et al., 2009; Hiepp et al., 2022). Recientemente se han obtenido resultados alentadores mediante el uso de inhibidores de la CA IX y CA XII en combinación con agentes quimioterapéuticos, lo que ha permitido revertir la resistencia generada por las células cancerosas a estos fármacos a nivel in vitro e in vivo, en ensayos con líneas celulares y animales de laboratorio (Kalinin et al., 2021).
La lucha contra el cáncer es una batalla que sigue cobrando un alto costo en el mundo, con millones de nuevos casos y defunciones cada año. El aumento proyectado en la incidencia de cáncer en las próximas décadas, plantea desafíos significativos para los sistemas de salud y la sociedad en su conjunto. En este contexto, los CAIs han surgido como una nueva esperanza en el arsenal terapéutico contra estas enfermedades devastadoras. Estos compuestos, especialmente el SLC-0111, muestran un potencial prometedor en el tratamiento de tumores hipóxicos y metastásicos. La combinación de CAIs con agentes quimioterapéuticos es una estrategia innovadora para superar la resistencia a los tratamientos convencionales, abriendo nuevas posibilidades para mejorar la supervivencia y calidad de vida de los pacientes con cáncer. Sin embargo, queda mucho por hacer en la investigación para aprovechar plenamente el potencial terapéutico de los CAIs en la lucha contra el cáncer. Con un enfoque continuo en la investigación y la colaboración interdisciplinaria, podemos avanzar hacia un futuro donde el cáncer sea una enfermedad más tratable y, en última instancia, prevenible.
Referencias
- Arneth, B. (2019). Tumor microenvironment. Medicina, 56(1), 15.
- Betof, A. S., Rabbani, Z. N., Hardee, M. E., Kim, S. J., Broadwater, G., Bentley, R. C., Snyder, S. A., Vujaskovic, Z., Oosterwijk, E., & Harris, L. N. (2012). Carbonic anhydrase IX is a predictive marker of doxorubicin resistance in early-stage breast cancer independent of HER2 and TOP2A amplification. British journal of cancer, 106(5), 916–922.
- Chiang, W.-L., Chu, S.-C., Yang, S.-S., Li, M.-C., Lai, J.-C., Yang, S.-F., Chiou, H.-L., & Hsieh, Y.-S. (2002). The aberrant expression of cytosolic carbonic anhydrase and its clinical significance in human non-small cell lung cancer. Cancer letters, 188(1–2), 199–205.
- Chiche, J., Ilc, K., Laferriere, J., Trottier, E., Dayan, F., Mazure, N. M., Brahimi-Horn, M. C., & Pouysségur, J. (2009). Hypoxia-inducible carbonic anhydrase IX and XII promote tumor cell growth by counteracting acidosis through the regulation of the intracellular pH. Cancer research, 69(1), 358–368.
- De Milito, A., & Fais, S. (2005). Tumor acidity, chemoresistance and proton pump inhibitors.
- Eloranta, K., Pihlajoki, M., Liljeström, E., Nousiainen, R., Soini, T., Lohi, J., Cairo, S., Wilson, D. B., Parkkila, S., & Heikinheimo, M. (2023). SLC-0111, an inhibitor of carbonic anhydrase IX, attenuates hepatoblastoma cell viability and migration. Frontiers in oncology, 13, 1118268.
- Hiepp, L., Mayr, D., Gärtner, K., Schmoeckel, E., Klauschen, F., Burges, A., Mahner, S., Zeidler, R., & Czogalla, B. (2022). Carbonic anhydrase XII as biomarker and therapeutic target in ovarian carcinomas. PloS one, 17(7), e0271630.
- Kalinin, S., Malkova, A., Sharonova, T., Sharoyko, V., Bunev, A., Supuran, C. T., & Krasavin, M. (2021). Carbonic Anhydrase IX Inhibitors as Candidates for Combination Therapy of Solid Tumors. International Journal of Molecular Sciences, 22(24), 13405.
- Lindskog, S. (1997). Structure and mechanism of carbonic anhydrase. Pharmacology & therapeutics, 74(1), 1–20.
- Sarnella, A., Ferrara, Y., Auletta, L., Albanese, S., Cerchia, L., Alterio, V., De Simone, G., Supuran, C. T., & Zannetti, A. (2022). Inhibition of carbonic anhydrases IX/XII by SLC-0111 boosts cisplatin effects in hampering head and neck squamous carcinoma cell growth and invasion. Journal of Experimental & Clinical Cancer Research, 41(1), 1–16.
- Takacova, M., Kajanova, I., Kolarcikova, M., Lapinova, J., Zatovicova, M., & Pastorekova, S. (2022). Understanding metabolic alterations and heterogeneity in cancer progression through validated immunodetection of key molecular components: A case of carbonic anhydrase IX. Cancer and Metastasis Reviews, 1–19.
- Tavares-Valente, D., Baltazar, F., Moreira, R., & Queirós, O. (2013). Cancer cell bioenergetics and pH regulation influence breast cancer cell resistance to paclitaxel and doxorubicin. Journal of bioenergetics and biomembranes, 45, 467–475.
Imagen de portada: veckstock