Barrera Intestinal al Ritmo del Estrés
Introducción
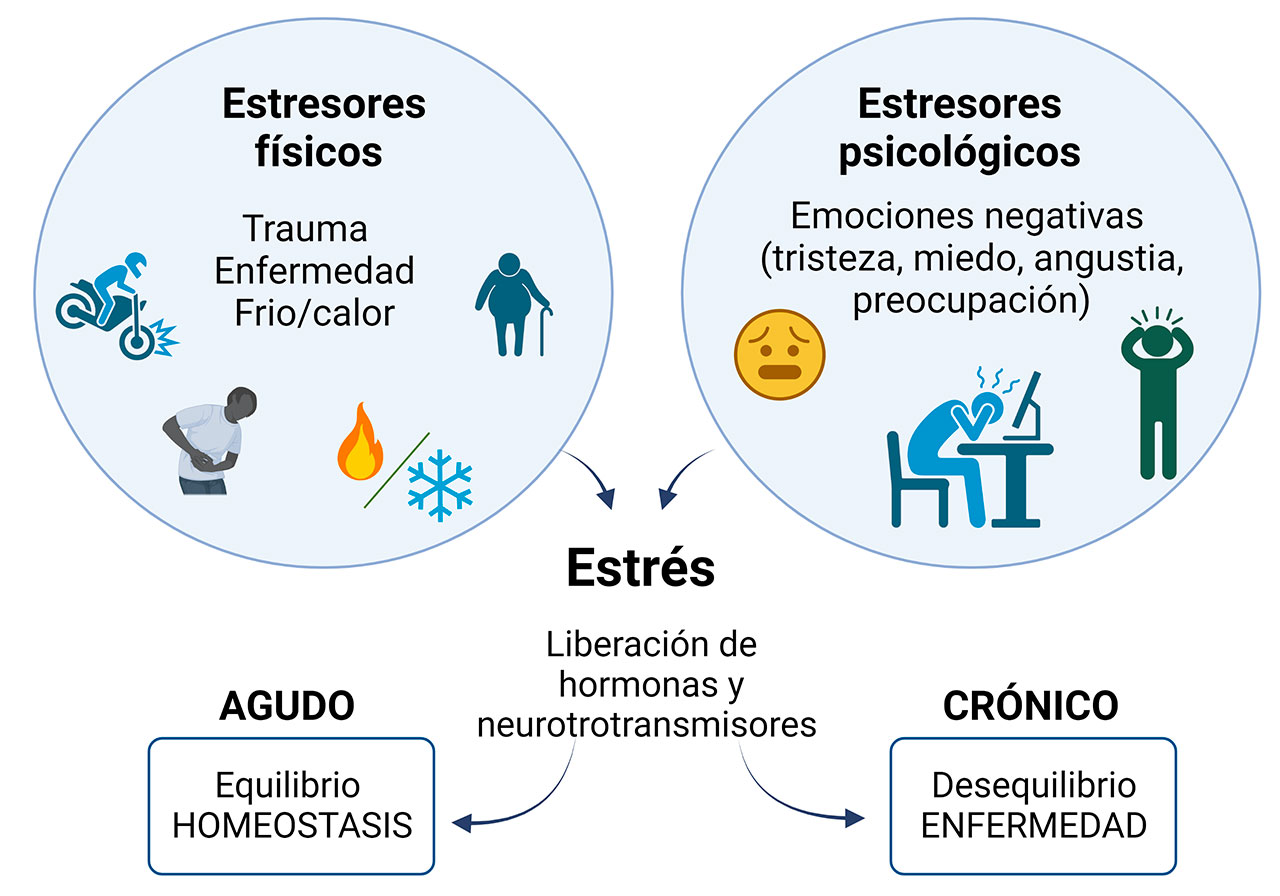
En condiciones de salud, existen mecanismos de resiliencia de la barrera intestinal que permiten restablecer y robustecer la homeostasis (equilibrio fisiológico) ante diversos eventos causantes de estrés. Sin embargo, estos mecanismos no operan con eficiencia en algunos trastornos crónico degenerativos, de hecho, se considera al estrés como factor de riesgo de disfunciones de importancia clínica, por ejemplo, el síndrome de intestino irritable y la enfermedad inflamatoria intestinal, que incluye a la colitis ulcerativa y a la enfermedad de Crohn (Vancamelbeke and Vermeire 2017; Brzozowski et al. 2016).
El estrés es una respuesta fisiológica generada cuando el organismo detecta un estímulo que amenaza su homeostasis. El estrés puede ser agudo cuando es inducido por un solo evento estresor, mientras que el estrés crónico conlleva la exposición repetida a estímulos estresores. En condiciones de estrés agudo, los mecanismos implicados en el mantenimiento de la homeostasis se restituyen a corto tiempo; en cambio, en situaciones de estrés crónico, el restablecimiento de la homeostasis no se logra, lo cual puede tener impacto perjudicial en la salud física y emocional de los seres humanos (Figura 1). Debido a las limitaciones éticas que conllevan los estudios clínicos gran parte de los conocimientos sobre las vías neuroendocrinas que alteran a los componentes de la barrera intestinal se han evaluado en modelos de estrés en animales de experimentación. El estudio de las vías neuroendocrinas que alteran a los componentes de la barrera intestinal es de interés para el desarrollo de intervenciones terapéuticas que contrarresten el efecto del estrés sobre el agravamiento de las disfunciones crónicas intestinales.
- Estrés
En la actualidad, los individuos están expuestos a estimulos estresores que de manera crónica se relacionan con el desarrollo y exacerbación de enfermedades intestinales. El estrés conlleva los siguientes eventos: i) percepción, ii) integración y iii) respuesta (Figura 2). i) La percepción del estrés depende del tipo de estresor. Si es físico, los nervios sensoriales periféricos llevan la señal al sistema nervioso central (SNC). Si es psicológico, el sistema límbico, centro encargado de las emociones en el SNC, procesa la señal. ii) En el SNC se integran las señales recibidas desde la periferia o en el sistema límbico para activar al sistema nervioso simpático (SNS) y al eje hipotálamo hipófisis adrenal (HHA). iii) La respuesta al estrés implica la liberación de neurotransmisores del SNS, de hormonas del eje del HHA y de neurotransmisores y enteropéptidos del sistema nervioso entérico (SNE) (Brzozowsky et al., 2016; Qin et al., 2014); estas moléculas bioactivas ejercen sus efectos a través de su unión a receptores expresados en el intestino (Brzozowsky, et al., 2016).
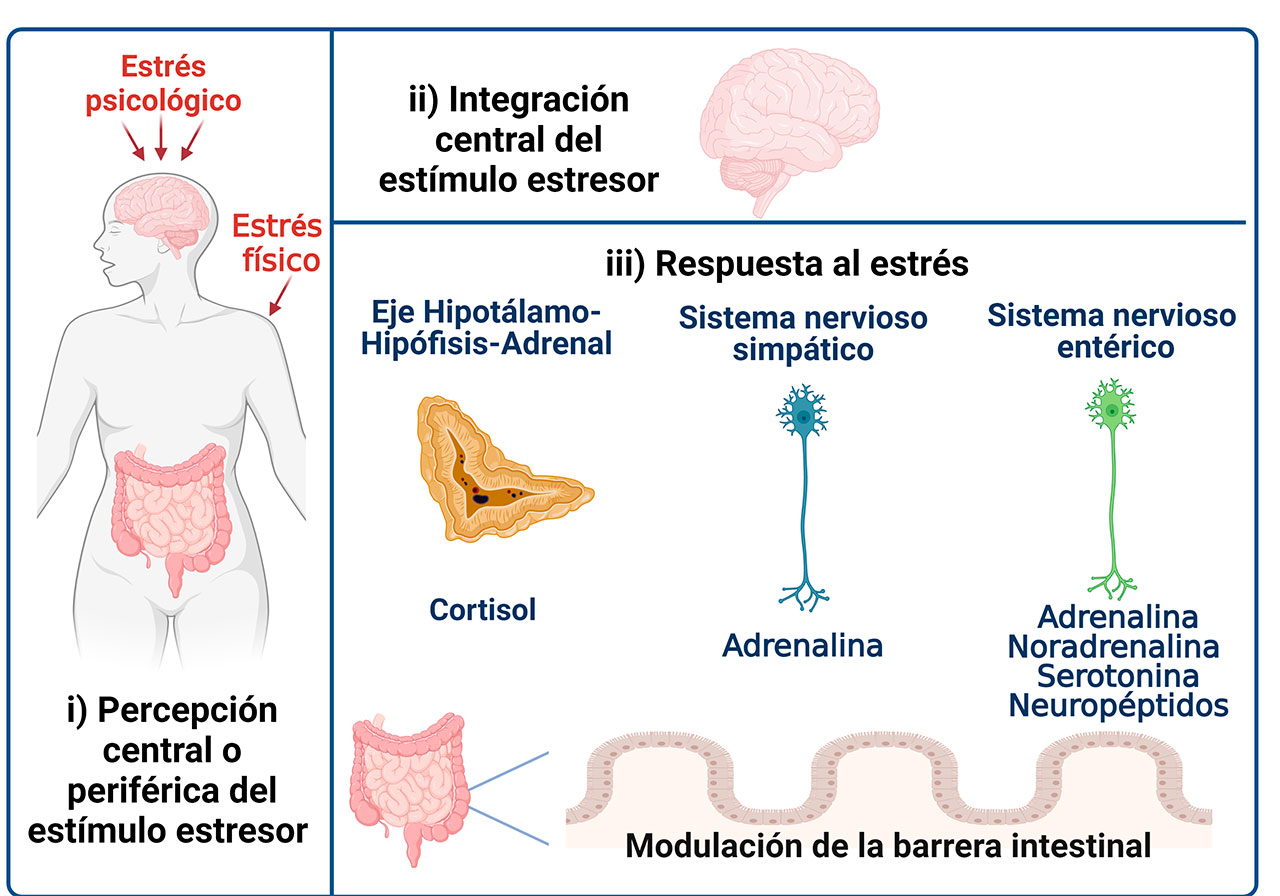
La respuesta inmediata al estrés activa al SNS, promoviendo la secreción de neurotransmisores como la adrenalina que induce el incremento en el flujo sanguíneo, el ritmo cardiaco y la excitabilidad del sistema cardiovascular. Estas manifestaciones caracterizan la reacción de “lucha” o “huida” típica de la respuesta autonómica inducida por el estrés (Dhabhar 2018). Un ejemplo clásico de estrés agudo es el “golpe de adrenalina” que experimentamos cuando escuchamos la alarma sísmica que nos prepara ante la inminente percepción de la “sacudida” con el fin de preservar nuestra sobrevivencia. Al mismo tiempo, el estrés induce la activación endócrina del eje HHA, produciendo la liberación de la hornoma liberadora de la corticotropina (CRH) en el hipotálamo. La CRH promueve la producción de la hormona adrenocorticotrópica (ACTH) en la hipófisis que entra al torrente sanguíneo hasta llegar a la corteza adrenal, en donde estimula la producción de hormonas glucocorticoides, como el cortisol, que mejora la disponibilidad de la energía necesaria para enfrentar la situación de estrés. La exposición crónica al estrés promueve la liberación sostenida de las hormonas glucocorticoides que es perjudicial para la salud fisica y mental.
El eje HHA y SNS convergen con los nervios del SNE, que es exclusivo del intestino y puede funcionar de forma independiente de cualquier entrada neuronal del sistema nervioso central. El SNE actúa a través de la producción de diversos neurotransmisores (acetilcolina, adrenalina, noradrenalina y serotonina), y de neuropéptidos como el péptido intestinal vasoactivo, taquicininas, bradicininas, péptidos de la familia de CRH y las urocortinas (Niesler et al., 2021; Brzozowsky et al., 2016; Qin et al., 2014). Las vías activadas en respuesta al estrés que llegan al intestino modulan componentes que integran la barrera intestinal; algunas características de esta barrera se describen a continuación.
- Barrera intestinal
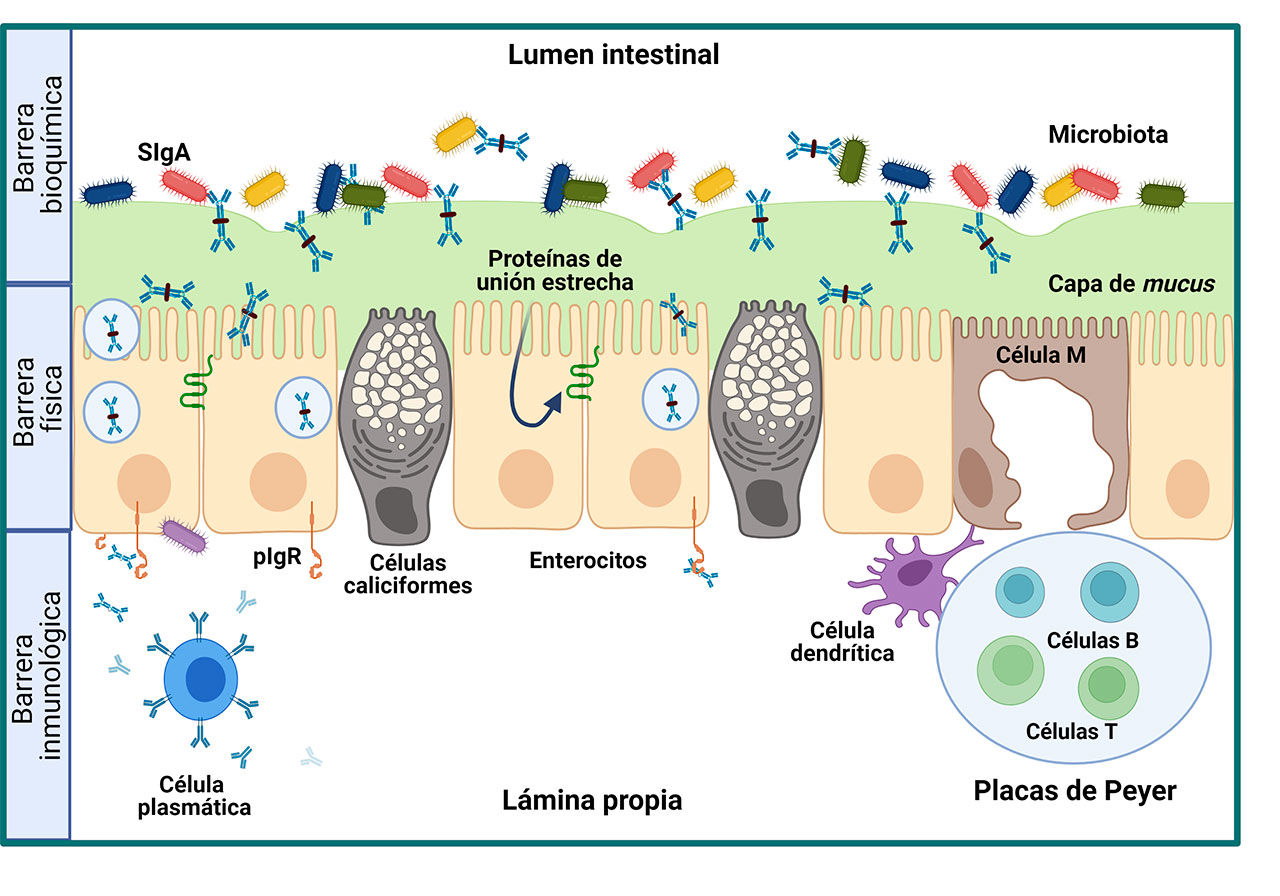
Cuando hablamos de “homeostasis intestinal” nos referimos a la condición de equilibrio lograda por la convergencia de una compleja red de procesos implicados en la barrera intestinal (Wells et al. 2017). La barrera intestinal tiene como principal función permitir la entrada de nutrientes y moléculas inocuas y paralelamente, impedir la entrada de agentes tóxicos potencialmente nocivos. Esta función dicotómica se logra gracias a la colaboración de diversos componentes que la conforman, como son las barreras i) bioquímica, ii) física e iii) inmunológica (Bischoff et al. 2014) (Figura 3).
i) La barrera bioquímica está conformada por el mucus que recubre la superficie epitelial. El mucus es un biopolímero formado por mucopolisacáridos y por mucinas que le confieren una consistencia pegajosa y aspecto gelatinoso. El mucus forma una capa de gel, que además de actuar como hábitat y fuente de nutrientes, bloquea el contacto directo de la microbiota con la superficie epitelial y por ende, previene una potencial respuesta inflamatoria.
ii) La barrera física separa el medio externo del interno y está constituida por el epitelio intestinal formado por enterocitos, células de Paneth, células enteroendócrinas y células caliciformes. Las células epiteliales expresan proteínas de unión estrecha, implicadas en la regulación de la permeabilidad intestinal entendida como la magnitud del flujo de moléculas que atraviesan el epitelio (Wells et al. 2017).
iii) La barrera inmunológica se localiza a nivel sub-epitelial en donde reside la maquinaria humoral y celular involucrada en la generación de respuesta inmunitaria intestinal. Esta respuesta implica la captación de agentes extraños y su transporte a nivel sub-epitelial por las células M que recubren la superficie luminal de las placas de Peyer. En las placas de Peyer ocurre la activación y generación de células productoras de IgA, que emigran hacia la lámina propia en donde maduran a células plasmáticas secretoras de inmunoglobulina A (IgA). La IgA forma un complejo con el componente secretor (CS) derivado del receptor de inmunoglobulina polimérica expresado en el epitelio. El complejo IgA-SC se conoce como IgA secretora (SIgA) que colabora con el mucus y con el epitelio para preservar la integridad funcional y estructural de la barrera intestinal, y por ende, mantener la homeostasis (Wells et al. 2017).
- Estrés y Disfunciones intestinales
Desde el punto de vista clínico, el estrés es considerado como un factor agravante de padecimientos crónicos como el síndrome de intestino irritable y la enfermedad inflamatoria intestinal, que incluye a la colitis ulcerativa y a la enfermedad de Crohn (Vancamelbeke and Vermeire 2017; Brzozowski et al. 2016).
El síndrome de intestino irritable es un trastorno gastrointestinal funcional y crónico de gravedad moderada de tipo continuo o remitente, que se caracteriza por dolor abdominal o malestar asociado con un cambio en la consistencia y en la frecuencia de las heces (Qin et al., 2017). En la enfermedad de Crohn ocurre la inflamación en “parches” en cualquier segmento del tracto gastrointestinal, que afecta desde la boca hasta el recto, aunque se localiza con mayor frecuencia en el segmento terminal del intestino delgado y el inicio del colon. En la colitis ulcerativa, la inflamación se localiza únicamente en el colon y/o en el recto y afecta a la mucosa y a la submucosa, lo que lleva a la ulceración (Jarmakiewicz-Czaja et al., 2023).
El estrés exacerba estas patologías mediante mecanismos que involucran hormonas y neurotransmisores con un espectro de acciones en los componentes de la barrera intestinal. Estas hormonas inducen la disbiosis intestinal que se refiere al desbalance de la abundancia, composición, distribución y metabolismo de las comunidades que conforman la microbiota intestinal. La disbiosis asociada al estrés favorece la degradación de mucus, que facilita el contacto de la microbiota con la superficie apical del epitelio y en consecuencia, se induce la respuesta inflamatoria. Los mediadores del estrés fomentan la generación de moléculas inflamatorias a nivel epitelial y sub-epitelial; por ejemplo, las especies reactivas de oxígeno y citocinas pro-inflamatorias como el factor de necrosis tumoral α (TNF-α) causantes de daño en la monocapa epitelial que alteran la generación, transporte y secreción de SIgA (Figura 4) (Vancamelbeke and Vermeire 2017; Brzozowski et al. 2016).
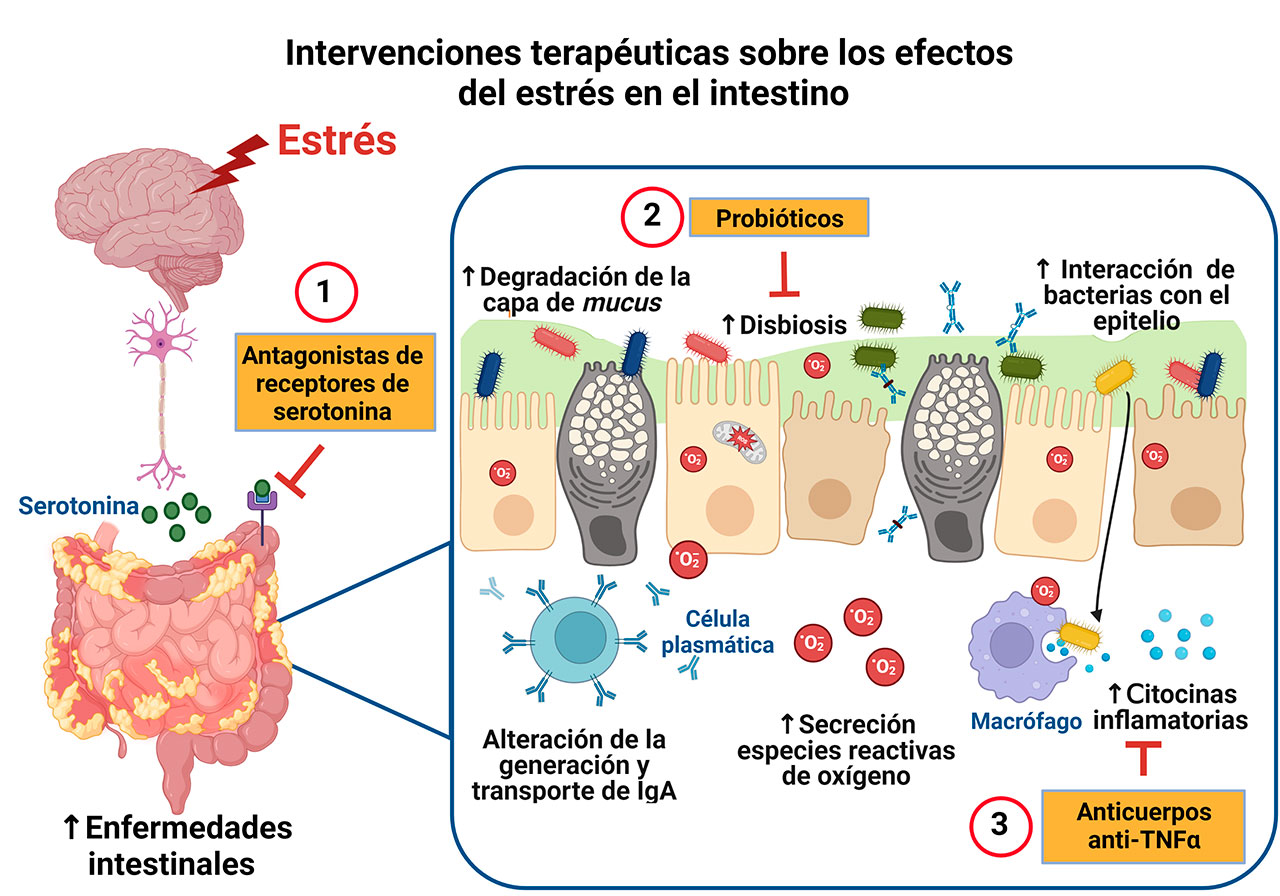
Actualmente hay algunas propuestas farmacológicas para el tratamiento de padecimientos crónicos, como el síndrome de intestino irritable, en el cual el estrés es un factor de riesgo (Qin et al., 2014). El tratamiento de este síndrome intestinal incluye antagonistas de los receptores a serotonina (alosetrón y ramosetron) y al inhibidor de la enzima triptófano hidroxilasa (LX1031) que sintetiza la serotonina. Este neurotransmisor está implicado en la motilidad y dolor intestinal, así como en otras enfermedades asociadas al estrés, como la ansiedad y la depresión. En el caso de la enfermedad inflamatoria intestinal, el tratamiento farmacológico involucra al infliximab, un anticuerpo que neutraliza al TNF-α implicado en la inflamación y que también controla la depresión.
En relación con la enfermedad inflamatoria intestinal los tratamientos incluyen a los antibióticos, considerados como un valioso recurso para aliviar disfunciones intestinales crónicas; sin embargo, su aplicación es controvertida debido a su efecto sobre la generación de multirresistencia microbiana. La suplementación alimenticia con prebióticos y probióticos reduce los trastornos conductuales relacionados con el estrés; ambos disminuyen la ansiedad y la depresión y protegen contra la enteritis presente en la enfermedad inflamatoria intestinal. La terapia basada en el trasplante de la microbiota fecal de individuos sanos a pacientes con enfermedad inflamatoria intestinal restablece la microbiota intestinal disminuyendo la inflamación asociada a dicho padecimiento (Oligschlaeger et al. 2019; Peppas et al. 2021; Sun et al. 2019).
Además de los tratamientos convencionales, otras moléculas de origen biológico, como la lactoferrina, han demostrado tener acciones moduladoras sobre los componentes de la barrera intestinal. La lactoferrina es una glicoproteína con funciones antioxidantes, antiinflamatorias e inmunomoduladoras. En estudios preclínicos la lactoferrina ha sido utilizada en el diseño nanopartículas, nanoemulsiones y liposomas, demostrando potencial efecto terapéutico contra las enfermedades inflamatorias intestinales. Estas preparaciones se han implementado como sistemas de liberación, dado que la lactoferrina mejora el desempeño terapéutico de fármacos sensibles a la degradación gastrointestinal. Por otra parte, gracias a la presencia de receptores de la lactoferrina en el tracto gastrointestinal, la lactoferrina se ha utilizado para dirigir fármacos hacia su diana terapéutica, mejorando su actividad farmacológica (Guzmán-Mejía et al. 2023).
En conclusión, el estudio de los mecanismos básicos a través de los cuales el estrés afecta la barrera intestinal es esencial para fundamentar la elaboración de intervenciones para el tratamiento de enfermedades inflamatorias intestinales.
Referencias
Brzozowski, B., Mazur-Bialy, A., Pajdo, R., Kwiecien, S., Bilski, J., Zwolinska-Wcislo, M., Mach, T., & Brzozowski, T. (2016). Mechanisms by which Stress Affects the Experimental and Clinical Inflammatory Bowel Disease (IBD): Role of Brain-Gut Axis. Current Neuropharmacology, 14, 892–900. https://doi.org/10.2174/1570159X14666160404124
Dhabhar, F. S. (2018). The Short-Term Stress Response – Mother Nature’s Mechanism for Enhancing Protection and Performance Under Conditions of Threat, Challenge, and Opportunity. Frontiers in Neuroendocrinology (Vol. 49, pp. 175–192). Academic Press Inc. https://doi.org/10.1016/j.yfrne.2018.03.004
Niesler, B., Kuerten, S., Demir, I. E., & Schäfer, K. H. (2021). Disorders of the enteric nervous system — a holistic view. In Nature Reviews Gastroenterology and Hepatology (Vol. 18, Issue 6, pp. 393–410). Nature Research. https://doi.org/10.1038/s41575-020-00385-2
Wells, J. M., Brummer, Robert J Derrien, M., Macdonald, T. T., Troost, F., Cani, P. D., Theodorou, V., Dekker, J., Méheust, A., De Vos, W. M., Mercenier, A., Nauta, A., & Garcia-Rodenas, C. L. (2017). Homeostasis of the gut barrier and potential biomarkers. Am J Physiol Gastrointest Liver Physiol, 312, 171–193. https://doi.org/10.1152/ajpgi.00048.2015
Bischoff, S. C., Barbara, G., Buurman, W., Ockhuizen, T., Schulzke, J. D., Serino, M., Tilg, H., Watson, A., & Wells, J. M. (2014). Intestinal permeability – a new target for disease prevention and therapy. BMC Gastroenterology (Vol. 14, Issue 1, pp. 1–25). BioMed Central Ltd. https://doi.org/10.1186/s12876-014-0189-7.
Qin, H. Y., Cheng, C. W., Tang, X. D., & Bian, Z. X. (2014). Impact of psychological stress on irritable bowel syndrome. In World Journal of Gastroenterology (Vol. 20, Issue 39, pp. 14126–14131). WJG Press. https://doi.org/10.3748/wjg.v20.i39.14126
Jarmakiewicz-Czaja, S., Ferenc, K., & Filip, R. (2023). Antioxidants as Protection against Reactive Oxidative Stress in Inflammatory Bowel Disease. Metabolites (Vol, 13, Issue 4, pp. 1-16. https://doi.org/10.3390/metabo13040573
Sun, Y., Li, L., Xie, R., Wang, B., Jiang, K., & Cao, H. (2019). Stress Triggers Flare of Inflammatory Bowel Disease in Children and Adults. Frontiers in Pediatrics (Vol. 7, pp. 1–12). Frontiers Media S.A. https://doi.org/10.3389/fped.2019.00432
Guzmán-Mejía, F., Godínez-Victoria, M., Molotla-Torres, D. E., & Drago-Serrano, M. E. (2023). Lactoferrin as a Component of Pharmaceutical Preparations : An Experimental Focus. Pharmaceuticals, 16(214), 1–20.