Cambios en la Barrera Hematoencefálica en el envejecimiento
El envejecimiento es un proceso natural que no implica un estado de enfermedad; la velocidad en que ocurre es variable y depende tanto del comportamiento del individuo como de factores ambientales y factores genéticos; este último aporta aproximadamente un 30% a la longevidad humana. Está asociado a la acumulación de daños moleculares y celulares que reducen gradualmente las reservas fisiológicas del individuo, aumentando el riesgo a contraer enfermedades y disminuyendo la capacidad del mismo.
El envejecimiento poblacional ocurre en casi todos los países del mundo. En México, entre 1970 y 2023 el porcentaje de adultos mayores se incrementó a más del doble, pasando del 4 al 10% de la población total (1). Se espera que continue incrementando como proporción de la población mundial, alcanzando el 21.1% en el 2050. Se espera que pase de 841 millones de personas mayores de 60 años de edad, a más de 2 mil millones. Por primera vez en la historia, en el 2047, el número de personas mayores excederá el número de niños (OMS). En México, de acuerdo con la Encuesta Nacional de Ocupación y Empleo Nueva Edición (ENOEN), para el segundo trimestre de 2022 se estimó que había 17,958,707 personas de 60 años y más. Esta cifra representa 14 % de la población total del país (2).
Barrera Hematoencefálica
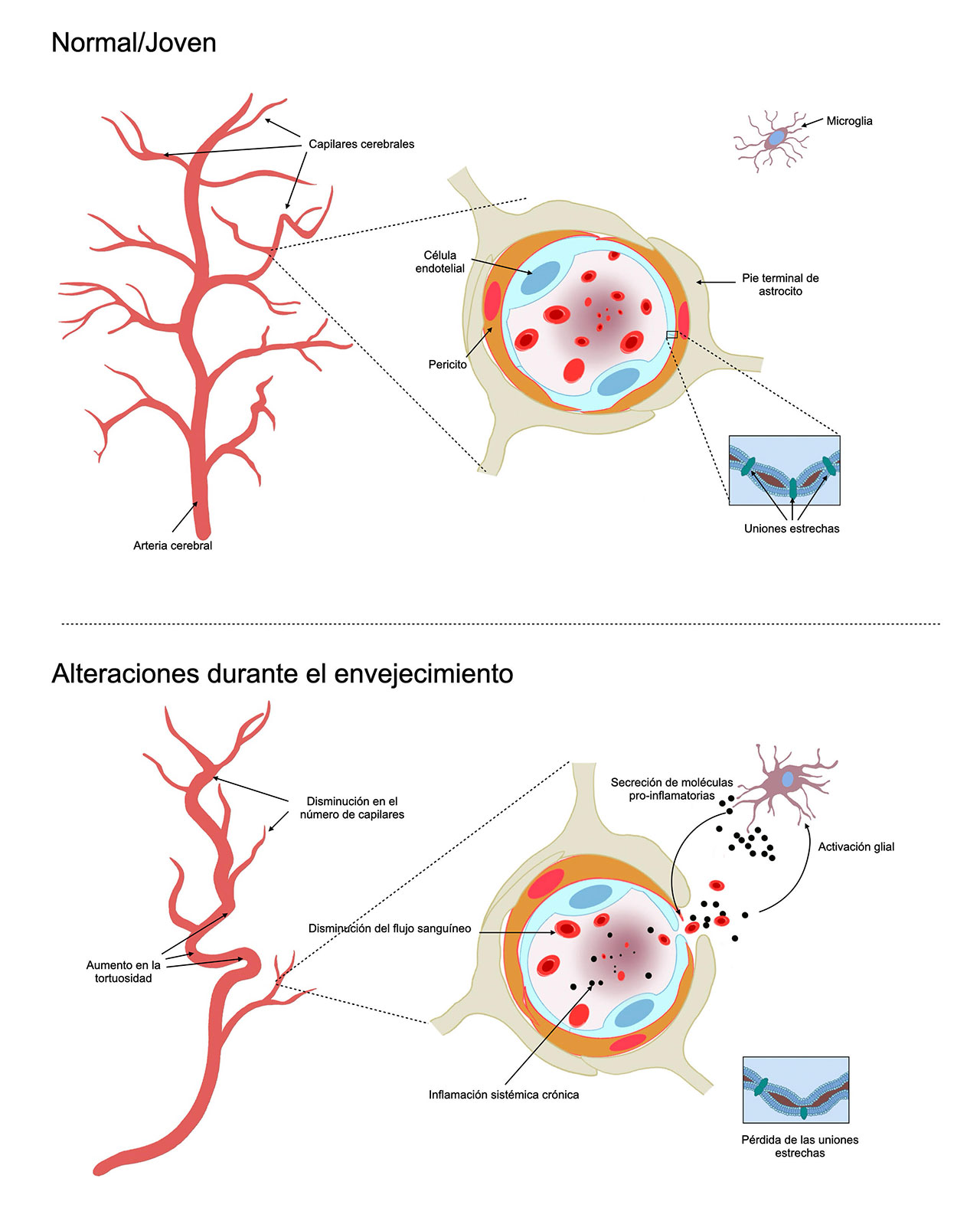
La barrera hematoencefálica (BHE) es una barrera permeable altamente selectiva, está compuesta de una red de vasos sanguíneos y tejido compuesto de células endoteliales estrechamente unidas que evita que las sustancias dañinas penetren en el encéfalo. Durante el envejecimiento, la barrera hematoencefálica (BHE) experimenta alteraciones anatómicas y funcionales que pueden afectar su función. La BHE está formada por células endoteliales, estas células se encuentran en el interior de todos los vasos sanguíneos del cuerpo, pero al llegar al cerebro su distribución espacial se vuelve más densa: están mas juntas, formando una especie de red estrecha. Las células endotelilales forman una membrana continua dentro de los microvasos del cerebro, cuyas células endoteliales tienen contactos de célula a célula, llamadas uniones estrechas, que sellan y aíslan al cerebro de la circulación sistémica.
La asociación e interacciones entre las células endoteliales en los microvasos, y las células gliales o células de soporte de las neuronas, brindan funciones y características muy importantes a la BHE, como el flujo o transporte de nutrientes y algunas moléculas a través de ella, manteniendo de esta forma un medio interno óptimo para llevar a cabo todos los procesos y funciones de las células que conforman al sistema nervioso central (SNC).
Las investigaciones realizadas en animales envejecidos muestran que hay un incremento en la tortuosidad en los vasos grandes como son las arterias cerebrales; esto se observó por medio de una angiografía por tomografía de coherencia óptica realizada a través de una ventana craneal (3). En cuanto a los microvasos, y a partir de imágenes obtenidas por microscopía de dos fotones, se ha observado que hay una reducción en el número de bifurcaciones y de ramificaciones, así como en la longitud de los capilares, lo que se traduce como una menor densidad capilar (4). Esto provoca reducción del flujo sanguíneo cerebral (3,5), y disminución del metabolismo cerebral (6).
También se ha descrito una disrupción de leve a moderada de la BHE, es decir, el paso de moléculas de la sangre al cerebro y viceversa, que no ocurre en los animales jóvenes. Esto se demostró realizando un estudio en el que se inyectaron tintes fluorescentes de diferentes tamaños, con el fin de detectar la extravasación de cada uno de estos tintes. Encontraron que el tinte de mayor tamaño (dextran de 40kDa) no pasaba, mientras que los tintes de menor tamaño (dextran de 3kDa) sí pasan a través de la BHE (4). La figura 1 es la representación gráfica de los cambios que se han descrito en la BHE durante el envejecimiento (7).
Inflamación en el envejecimiento
Por otra parte, también se han observado cambios en la secreción de algunas moléculas proinflamatorias dentro del cerebro asociados al envejecimiento. Las investigaciones realizadas para estudiar estos cambios van de la mano del concepto de “inflammaging” o inflamación por envejecimiento, que se refiere a un proceso inflamatorio crónico de baja intensidad que se desarrolla durante el envejecimiento natural de un individuo. Este proceso se puede identificar mediante análisis sanguíneos convencionales y no tiene síntomas aparentes; sin embargo, al transcurrir junto a distintos problemas de salud también asociados a la edad, sí puede incrementar la sintomatología de estas comorbilidades.
Si bien, el “inflammaging” ocurre en todo el cuerpo, cuando lo hace en el SNC puede tener efectos muy particulares. Se ha encontrado que gracias a este proceso, se incrementa la producción de algunas moléculas asociadas con la disminución de procesos neurogénicos, activación de la microglía y deterioro de funciones cognitivas (aprendizaje, memoria, etc.) (8–10), así como de TNFa, IL-6, IL-2 e IL-1b en ratones envejecidos en comparación con ratones jóvenes (11).
La secreción de estas moléculas es relevante ya que provocan activación glial, lo que a su vez favorece un incremento en la secreción de más moléculas proinflamatorias que siguen produciendo más activación glial, lo que puede derivar en un círculo vicioso de inflamación en el SNC. Esta inflamación ocurre con el fin de que el cerebro regrese a su estado basal natural, un proceso conocido como homeostasis, una propiedad de los organismos que consiste en la capacidad de mantener un ambiente interno estable y relativamente constante compensando los cambios en su entorno. Cuando el proceso de inflamación no es suficiente para regresar el sistema a la homeostasis o el proceso en sí no se detiene por completo, los procesos activados en un inicio para restablecer el estado basal, causan daño al organismo.
Por su parte, durante la inflamación sistémica, se producen una serie de respuestas cerebrales; un conjunto de cambios fisiológicos y conductuales que en caso de peligro, protegerían al individuo de los depredadores mientras está enfermo, le permitiría luchar contra la infección y proteger a la especie en su conjunto. Esta cualidad permisiva de la BHE puede ser exagerada durante la inflamación sistémica sostenida o abrumadora, volviéndola más permeable a los solutos, aumentando el tráfico de linfocitos y la infiltración de células inmunitarias innatas; ocasionalmente produciendo daño en las células endoteliales.
Referencias
- https://www.inegi.org.mx/contenidos/saladeprensa/aproposito/2023/EAP_DMPO23.pdf
- https://www.inegi.org.mx/contenidos/saladeprensa/aproposito/2022/EAP_ADULMAY2022.pdf
- Li Y, Choi WJ, Wei W, Song S, Zhang Q, Liu J, et al. Aging-associated changes in cerebral vasculature and blood flow as determined by quantitative optical coherence tomography angiography. Neurobiol Aging. 2018 Oct;70:148–59.
- Nyúl-Tóth Á, Tarantini S, DelFavero J, Yan F, Balasubramanian P, Yabluchanskiy A, et al. Demonstration of age-related blood-brain barrier disruption and cerebromicrovascular rarefaction in mice by longitudinal intravital two-photon microscopy and optical coherence tomography. Am J Physiol Heart Circ Physiol. 2021 Apr 1;320(4):H1370–92.
- Lowerison MR, Sekaran NVC, Zhang W, Dong Z, Chen X, Llano DA, et al. Aging-related cerebral microvascular changes visualized using ultrasound localization microscopy in the living mouse. Sci Rep. 2022 Jan 12;12(1):619.
- Kisler K, Nelson AR, Montagne A, Zlokovic BV. Cerebral blood flow regulation and neurovascular dysfunction in Alzheimer disease. Nat Rev Neurosci. 2017;18:419–34.
- Lozano-Villalobos C. BHE-envejecimiento.jpg [Internet]. figshare; 2023. Available from: https://figshare.com/articles/figure/BHE-envejecimiento_jpg/23159519
- Villeda SA, Luo J, Mosher KI, Zou B, Britschgi M, Bieri G, et al. The ageing systemic milieu negatively regulates neurogenesis and cognitive function. Nature. 2011 Aug 31;477(7362):90–4.
- Das MM, Godoy M, Chen S, Moser VA, Avalos P, Roxas KM, et al. Young bone marrow transplantation preserves learning and memory in old mice. Commun Biol. 2019 Feb 20;2:73.
- Fernández-Castañeda A, Lu P, Geraghty AC, Song E, Lee MH, Wood J, et al. Mild respiratory COVID can cause multi-lineage neural cell and myelin dysregulation. Cell. 2022 Jul 7;185(14):2452–68.e16.
- Elahy M, Jackaman C, Mamo JC, Lam V, Dhaliwal SS, Giles C, et al. Blood-brain barrier dysfunction developed during normal aging is associated with inflammation and loss of tight junctions but not with leukocyte recruitment. Immun Ageing. 2015 Mar 7;12:2.
Foto de portada: Amel Uzunovic en pexels