Chagas, una enfermedad olvidada: descubrimiento único en la medicina tropical y un problema actual de salud global
Trypanosoma cruzi es el agente causal de la enfermedad de Chagas (ECh), un padecimiento potencialmente mortal, altamente incapacitante, de transmisión vectorial y endémico de Latinoamérica, por lo que también es conocido como Tripanosomiasis Americana. Se clasifica como una enfermedad tropical desatendida (Neglected Tropical Disease, NTD) por la Organización Mundial de la Salud (OMS), sin que existan hasta el momento medicamentos o vacunas eficaces para su tratamiento. El hallazgo de la ECh se dio en 1909 por el médico e investigador brasileño Carlos Justiniano Ribeiro das Chagas (Figura 1) [1], quien es considerado como un personaje único en la historia de la medicina tropical ya que describió completamente una enfermedad infecciosa nueva, sus manifestaciones clínicas, su epidemiología, el agente causal, el vector transmisor (miembros de la familia Triatominae), los hospederos mamíferos y su profilaxis [2]. Se han encontrado porcentajes variables de infección por T. cruzi en Latinoamérica, estimándose de 6 a 7 millones de personas infectadas [1]. Sin embargo, debido a los recientes flujos de migrantes infectados a países no endémicos como Estados Unidos, Canadá, diversos países de Europa y el oeste del Pacífico, el padecimiento se ha convertido en una enfermedad mundial desatendida con una alta tasa de morbimortalidad y un impacto social sustancial, emergiendo como una amenaza de salud pública importante en estos países (Figura 1). Además, hay un alto riesgo de transmisión no vectorial del parásito por transfusión sanguínea, trasplante de órganos, o por transmisión vertical congénita en países no endémicos. Con este escenario, actualmente se estima que hay entre 65 a 100 millones de personas viviendo en áreas con riesgo de infección en el mundo [3]. En México la seroprevalencia reportada de infección por T. cruzi varía ampliamente. Un trabajo reciente reportó la revisión sistemática y el meta-análisis de estudios epidemiológicos realizados entre 2006 y 2017 en México, mostrando niveles de infección mayores a los reconocidos anteriormente. Así, a nivel nacional se estima una seroprevalencia de 3.38% [IC 95% 2.59–4.16], sugiriendo que hay 4.06 millones de casos de infección con el parásito en el país. Además, también se determinó una seroprevalencia en mujeres embarazadas del 2.21% [IC 95% 1.46–2.96], en menores de 18 años del 1,51% [IC del 95%: 0,77–2,25] indicando una transmisión en curso, y una seroprevalencia nacional estimada en bancos de sangre del 0,55% [IC del 95%: 0,43 a 0,66] [4]. Estas estimaciones colocan a México como el país con el mayor número de infectados con T. cruzi en Latinoamérica, incluso por encima de Argentina, Brasil, Honduras y Bolivia, que son los países considerados con el mayor porcentaje de seropositividad y/o número de infectados con el parásito [3]. Esto representa un alto costo para el sector salud de México, ya que además de la incapacidad laboral que produce, representa un gasto de 4,463 a 9,601 dólares estadunidenses para la atención de pacientes ambulatorios y de 6,700 a 11,838 dólares estadunidenses anuales para el tratamiento de pacientes ingresados a unidades de emergencia [5].
T. cruzi es transmitido principalmente a través de heces de insectos pertenecientes a la subfamilia Triatominae (Hemiptera: Reduviidae), de los géneros Rhodnius, Triatoma y Panstrongylus, que se agrupan en 151 especies [6]. En México se encuentra el mayor número de especies diferentes de triatominos y de vectores potenciales del parásito, existiendo 31 especies distintas de los géneros Rhodnius, Triatoma, Meccus, Panstrongylus, Dipetalogaster, Belminus, Eratyrus y Paratriatoma. Por su amplia distribución geográfica y capacidad para transmitir al parásito, T. barberi, T. dimidiata y M. pallidipennis son considerados como vectores de gran importancia médica en México [7]. Los triatominos infectados con T. cruzi se distribuyen en más del 80% del territorio nacional [8], lo que resulta en un estimado de 100 millones de mexicanos en riesgo de contraer la infección, de acuerdo con datos del censo de población del INEGI del 2019. En la naturaleza, la transmisión de T. cruzi se lleva a cabo en el ciclo selvático, donde la infección se transmite del insecto infectado a mamíferos silvestres (más de 70 géneros) y viceversa. Pero la distribución de la ECh depende del ciclo doméstico, en el que el insecto vector se ha adaptado a vivir en el domicilio y peri-domicilio, favoreciéndose la transmisión del parásito al humano, animales domésticos y animales de corral. Consecuentemente, la infección por T. cruzi se mantiene como una zoonosis compleja, lo que hace difícil su erradicación a pesar de los esfuerzos de control del vector en los países endémicos (Figura 1).
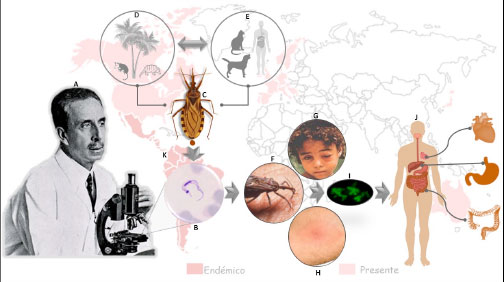
El ciclo de vida de T. cruzi es bifásico, y en él se alternan cuatro estadios de desarrollo diferentes entre el insecto vector (epimastigotes y tripomastigotes metacíclicos) y el hospedero mamífero (amastigotes y tripomastigotes sanguíneos). Durante la ingesta sanguínea el vector se infecta al tomar sangre de mamíferos contaminada con tripomastigotes sanguíneos. A lo largo del tracto digestivo del insecto, el parásito se transforma de tripomastigote sanguíneo a epimastigote, el cual se replica en el intestino medio del insecto y se traslada al recto donde se diferencia a tripomastigote metacíclico, eliminándose en las heces del triatomino durante la ingesta sanguínea. Los tripomastigotes metacíclicos penetran al hospedero vertebrado a través del sitio de la picadura, heridas o excoriaciones en la piel o a través de la mucosa intacta ocular, nasal o bucal, iniciando el ciclo intracelular infeccioso. Este ciclo es un proceso complejo con etapas secuenciales en donde los tripomastigotes metacíclicos invaden células fagocíticas y no fagocíticas a través de una vacuola parasitófora. Aquí es donde los tripomastigotes metacíclicos se diferencian a amastigotes, los cuales escapan para replicarse en el citoplasma. Después de su transformación a tripomastigotes sanguíneos, los parásitos salen a la circulación sanguínea y linfática para luego invadir diversos órganos, propagando la infección. Las células con mayor índice de infección son las reticuloendoteliales, del bazo, hígado y linfáticas; así como células del corazón, músculo liso y esquelético, aunque también en algunos casos pueden ser infectadas células del sistema nervioso, piel, gónadas, mucosa intestinal, médula ósea y placenta. Estos parásitos liberados a la circulación sanguínea pueden ser ingeridos nuevamente por el vector invertebrado completando así su ciclo de vida. El proceso de infección en el hospedero mamífero es un evento determinante en el ciclo de vida y supervivencia del parásito, así como en el establecimiento de la enfermedad; sin embargo, es poco lo que se sabe de los mecanismos moleculares involucrados. La mayor parte de los estudios están dirigidos a entender los mecanismos de infección en las células no fagocíticas, ya que es en éstas en donde se establece la patogenia de la enfermedad [9].
T. cruzi es un protozoario intracelular hemoflagelado que pertenece al orden Kinetoplastida, familia Trypanosomatidae (Figura 1). Este parásito se caracteriza por mostrar una heterogeneidad genética. Sus poblaciones se componen de complejos multiclonales con genomas de tamaño variable hasta en un 48% (aproximadamente 73 Mb), lo que permite clasificar a sus cepas utilizando diversos marcadores moleculares, en 7 DTUs distintos (TcI-TcVI y Tcbat). La mayoría de las poblaciones del parásito han evolucionado de forma clonal, en donde los genotipos de las generaciones descendientes son idénticos o altamente similares al de origen. Por ello, la variedad génica de la especie se debe principalmente a polimorfismos genéticos. Además, sus cepas han llevado a cabo eventos de recombinación genética entre poblaciones homocigotas, resultando en la producción de cepas con genotipos híbridos, como los pertenecientes a TcV y TcVl, derivados de Tcll y Tclll. Se ha propuesto que la variabilidad genética de las cepas se relaciona con el comportamiento biológico y molecular de cada DTU, presentando diferencias en sus niveles de infectividad, virulencia, patogénesis, histo-tropismo, susceptibilidad a fármacos, antigenicidad, generación de las diferentes formas clínicas de la enfermedad, epidemiología y distribución geográfica [10].
La ECh cursa por dos fases consecutivas: la aguda y la crónica. La fase aguda es posterior a la infección, de duración corta, con alta parasitemia en la sangre y regularmente asintomática, aunque en alrededor del 5% de los casos se observan síntomas inespecíficos y esporádicamente los signos característicos de la infección (signo de Romaña o el Chagoma de inoculación). La fase crónica se divide en dos etapas, una asintomática o indeterminada, y una sintomática que se presenta después de 10 a 30 años del inicio de la infección en el 30% a 40% de los individuos. Estos últimos desarrollan las manifestaciones clínicas de la enfermedad, consistentes en daño cardíaco (Cardiomiopatía Chagásica crónica), digestivo (síndromes de megacolon y megaesófago), cardio digestivo, o neurológico (siendo éste poco frecuente) (Figura 1) [3]. No se conoce el o los mecanismos para la generación de la ECh, y existen grandes vacíos de información con relación a su establecimiento. La escasa cantidad de parásitos encontrados en las diversas fases de la enfermedad, dificulta una explicación aceptable para la severidad de la misma y no existen datos concluyentes que permitan explicar por qué infecta preferentemente células de músculo cardiaco y músculo liso gastrointestinal. Se han propuesto dos posibles teorías para explicar la fisiopatología de la ECh, que son la persistencia física del parásito y el daño autoinmune. En la primera, durante la etapa crónica la presencia del parásito, determinada por PCR y observación de nidos de amastigotes, induce un daño directo a los plexos nerviosos mientéricos y cardiacos, lo que se observa también en modelos animales, en que la enfermedad no se desarrolla en ausencia de los parásitos. Por otro lado, la teoría autoinmune propone que el daño existente podría ser resultado de una interacción hospedero-parásito constante, la cual origina diversas reacciones autoinmunes que ocasionan daño al hospedero. Se ha propuesto que esto podría ser resultado de alteraciones en la regulación del sistema inmune del hospedero durante la fase crónica, llevando a la pérdida de la tolerancia por parte de sus ramas efectoras hacia los tejidos propios, o por un mecanismo de “mimetismo molecular” dado por los antígenos del parásito hacia antígenos propios del hospedero, lo que se traduce en auto-reactividad del sistema inmunológico. A pesar de los conocimientos obtenidos hasta el momento, todavía es imposible predecir qué sucederá en un individuo infectado con T. cruzi, debido a la gran variabilidad en la virulencia de las cepas del parásito, la diferente susceptibilidad humana a la infección y/o la combinación de ambas. Aunque se han estudiado de forma aislada varios mecanismos de patogénesis distintos, se ha propuesto que es la combinación de múltiples mecanismos coincidentes lo que determina la patología final de la enfermedad, considerándose incluso como una colección de enfermedades relacionadas, pero a su vez distintas [11].
A 110 años de su descubrimiento, la ECh ha pasado de ser una enfermedad endémica de Latinoamérica a un problema de salud global. La carga económica mundial de esta enfermedad ya rebasa los 7,200 millones de dólares estadunidenses por año, superando los costos de otras enfermedades de gran impacto en la salud, como algunos tipos de cáncer (6,700 millones de dólares para el cáncer uterino, 4,700 millones para cáncer cervical y 5,300 millones para cáncer oral) o infecciones por rotavirus (2,000 millones de dólares) [12]. Dado el escenario actual, es esencial unir esfuerzos con un enfoque multidisciplinario y en el ámbito global, para enfrentar esta enfermedad tan desafiante. Continuar con los esfuerzos para lograr mejores estrategias de control del vector y de la enfermedad, así como desarrollar métodos diagnósticos confiables, medicamentos efectivos sin efectos secundarios severos y vacunas eficaces, debe ser una prioridad para el sector salud no solo de países endémicos, sino también de aquellos no endémicos en que las vías de transmisión no vectorial se han convertido en un riesgo constante y la ECh un problema de salud importante.
Este trabajo fue apoyado por el donativo No. 6671 de CONACyT otorgado a RGMC.
Bibliografía
[1] WHO, Chagas disease (American trypanosomiasis), Fact sheet N˚340., 2017
[2] Kropf, SP, Carlos Chagas: science, health, and national debate in Brazil, Lancet, 2011 377, 1740-1741.
[3] Lidani, KCF;FA Andrade;L Bavia;FS Damasceno;MH Beltrame;IJ Messias-Reason; TL Sandri, Chagas Disease: From Discovery to a Worldwide Health Problem, Front Public Health, 2019 7, 166.
[4] Arnal, A;E Waleckx;O Rico-Chavez;C Herrera; E Dumonteil, Estimating the current burden of Chagas disease in Mexico: A systematic review and meta-analysis of epidemiological surveys from 2006 to 2017, PLoS Negl Trop Dis, 2019 13, e0006859.
[5] Ramsey, JM;M Elizondo-Cano;G Sanchez-Gonzalez;A Pena-Nieves; A Figueroa-Lara, Opportunity cost for early treatment of Chagas disease in Mexico, PLoS Negl Trop Dis, 2014 8, e2776.
[6] Justi, SA; C Galvao, The Evolutionary Origin of Diversity in Chagas Disease Vectors, Trends Parasitol, 2017 33, 42-52.
[7] Ramsey, JM;AT Peterson;O Carmona-Castro;DA Moo-Llanes;Y Nakazawa;M Butrick;E Tun-Ku;K la Cruz-Felix; CN Ibarra-Cerdena, Atlas of Mexican Triatominae (Reduviidae: Hemiptera) and vector transmission of Chagas disease, Mem Inst Oswaldo Cruz, 2015 110, 339-352.
[8] Cruz-Reyes, A; JM Pickering-Lopez, Chagas disease in Mexico: an analysis of geographical distribution during the past 76 years–a review, Mem Inst Oswaldo Cruz, 2006 101, 345-354.
[9] Espinoza Gutierrez, B; RG Manning Cela (2008). An overview of mammalian cell infection by Trypanosoma cruzi: Cellular and molecular basis. Advances in the immunobiology of parasitic disases. L. I. Terrazas. Kerala, India. , Research Signpost.
[10] Zingales, B, Trypanosoma cruzi genetic diversity: Something new for something known about Chagas disease manifestations, serodiagnosis and drug sensitivity, Acta Trop, 2018 184, 38-52.
[11] Bonney, KM;DJ Luthringer;SA Kim;NJ Garg; DM Engman, Pathology and Pathogenesis of Chagas Heart Disease, Annu Rev Pathol, 2019 14, 421-447.
[12] Lee, BY;KM Bacon;ME Bottazzi; PJ Hotez, Global economic burden of Chagas disease: a computational simulation model, Lancet Infect Dis, 2013 13, 342-348.
Margarita Rubio-Ortiz 1, Gabriel Noris-Sarabia 1,2, Santiago Martínez-Calvillo 3 y Rebeca Georgina Manning-Cela 1*
1 Departamento de Biomedicina Molecular, Centro de Investigación y de Estudios Avanzados del IPN. Av. Instituto Politécnico Nacional No. 2508, Col. San Pedro Zacatenco, Gustavo A. Madero, CP 07360. A P: 14-740, 07000 Ciudad de México.
2 Departamento de Ciencias de la Salud. Universidad Autónoma de Occidente. Unidad Regional Culiacán. Blvd. Lola Beltrán y Blvd. Rolando Arjona S/N. Col. 4 de Marzo. Culiacán, Sinaloa, México. CP 80020.
3 Unidad de Biomedicina, Facultad de Estudios Superiores Iztacala, Universidad Nacional Autónoma de México. Av. de los Barrios 1, Col. Los Reyes Iztacala, Tlalnepantla, Estado de México, CP 54090, México.