De bacterias y humanos: compactación del DNA
Unidades básicas en la organización del DNA cromosómico en bacterias y eucariontes. Imagen basada en Verma, 2019.
Cada célula humana compacta 2 metros de DNA en su interior. ¿Cómo sabemos esta longitud? El genoma humano contiene aproximadamente 3 mil millones de pares de bases empaquetados dentro de 23 cromosomas, y la mayoría de las células en el cuerpo humano son diploides, por lo cual hay dos copias de cada cromosoma y eso significa que en cada célula hay 6 mil millones de pares de bases.
Cuando Watson y Crick postularon el modelo de doble hélice del DNA, explicaron que en cada vuelta existían 10 pares de bases en una longitud de 3.4 nanómetros, por lo tanto, cada par de bases tendría una longitud de 0.34 nanómetros. Siguiendo estos datos se obtiene:
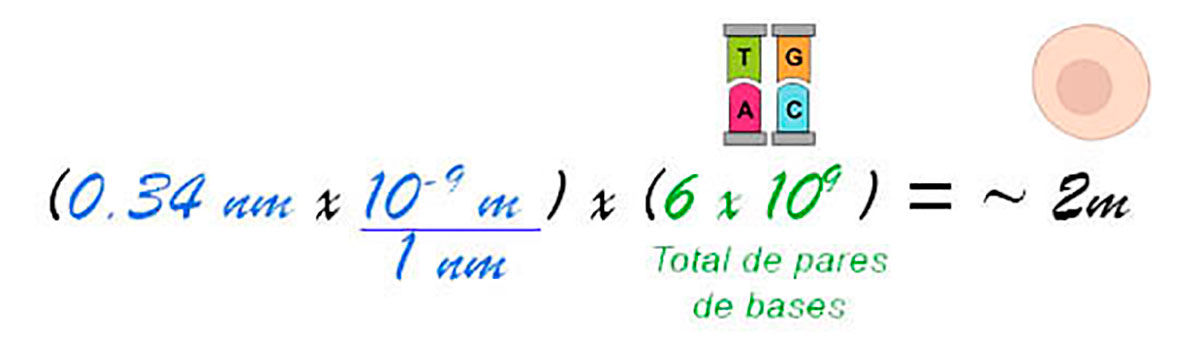
Según algunas estimaciones, el cuerpo humano contiene aproximadamente 30 billones de células (Sender, 2016). En total, cada ser humano contendría 60 billones de metros de DNA (de manera lineal, descompactado). Comparando esta longitud con la distancia de la Tierra al Sol -150 millones de kilómetros- el DNA de cada individuo podría recorrer esa distancia aproximadamente 200 veces de ida y vuelta.
¿Cómo podemos compactar tanto nuestro DNA?
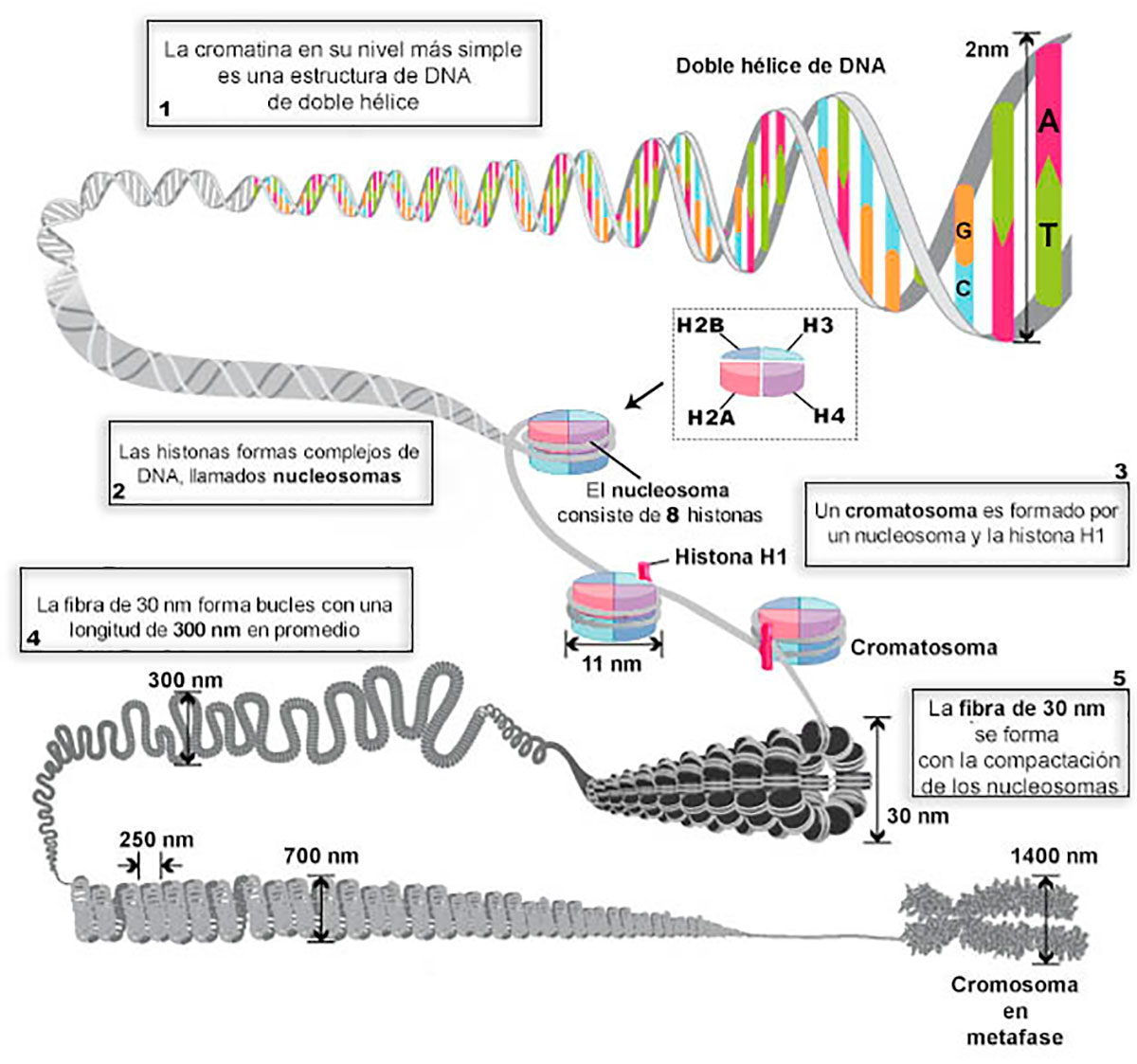
El DNA en las células eucariotas está empaquetado en el núcleo como cromatina (Figura 1), y se ha determinado que se encuentra en un modelo jerárquico de compactación, comenzando por las unidades fundamentales, los nucleosomas, que están compuestos de proteínas histonas y DNA.
A las proteínas histonas se les asignó inicialmente un papel pasivo en la compactación del DNA, sin embargo, con posterioridad se demostró que participan de forma relevante en la regulación génica, es decir, cuando se activan o desactivan los genes. Las histonas predominantes son H2A, H2B, H3 y H4, proteínas que se asocian en pares de cada una para conformar octámeros de histonas y posteriormente con el DNA, modelando los nucleosomas. Las histonas también pueden presentar modificaciones posteriores a la traducción (postraduccionales), las cuales tienen efectos en los procesos biológicos, por ejemplo; la división celular y la regulación génica (Zhou, 2019).
A diferencia del conocimiento temprano sobre la arquitectura de la cromatina en eucariontes, la organización del DNA en el interior de las bacterias permaneció desconocida durante más tiempo. Se creía que el DNA bacteriano no se encontraba organizado en la compactación y que presentaba una distribución aleatoria. En décadas recientes, algunos estudios han cambiado esa visión sobre la estructura del cromosoma bacteriano, así como de los elementos moleculares presentes.
El nucleoide bacteriano
Los cromosomas bacterianos son moléculas normalmente circulares cerradas covalentemente, de una sola copia por célula, aunque el género Streptomyces (Figura 2) presenta cromosomas lineares y en algunas etapas de su crecimiento muestran más de una copia dentro de sus compartimentos celulares.

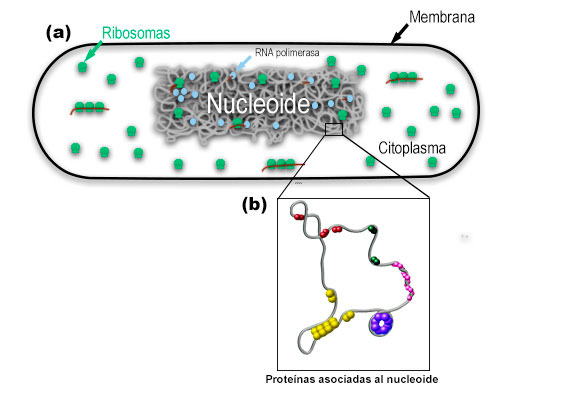
El DNA del cromosoma bacteriano se compacta aproximadamente 1,000 veces en una estructura análoga a la cromatina (Wang, 2013), llamada nucleoide, la cual comprende el DNA cromosomal, RNA y proteínas asociadas (Figura 3.a).
Compactar 104 veces las dobles cadenas de DNA y aún ser compatible con los procesos celulares de la molécula, sugería a científicos que el DNA se organizaba estructuralmente de una manera no aleatoria.
Por lo tanto, diversos estudios en uno de los modelos bacterianos más empleados en los laboratorios, Escherichia coli, demuestran que la forma final del nucleoide surge de una organización jerárquica del DNA (Macvanin, 2012). En la escala más pequeña (~ 1 kilobases), proteínas asociadas al nucleoide compactan el DNA curvándolo, envolviéndolo o formando puentes de regiones distantes (Hołówka, 2020. Figura 3b).
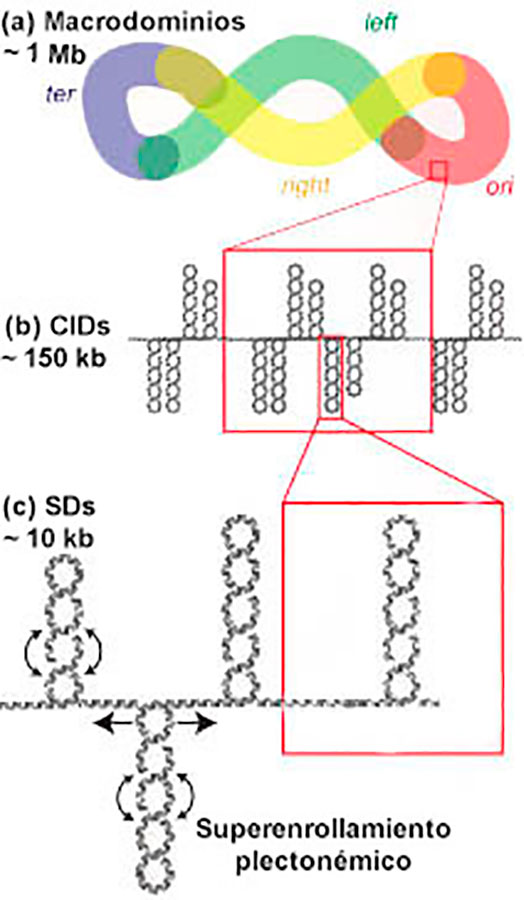
En una escala superior (~ 10 kb), el DNA forma estructuras plectonémicas (Figura 4.c), las cuales son formas trenzadas inducidas por el superenrollamiento, que se han llamado dominios superenrollados (SDs, por sus siglas en ingles). Posteriormente se configuran estructuras denominadas dominios de interacción cromosómica (CIDs, por sus siglas en ingles. Figura 3.b). Existe una interacción preferencial entre los elementos que se localizan dentro de un mismo CID.
Los CIDs son los constituyentes de los macrodominios (Figura 4.a), los cuales se encuentran aislados físicamente entre sí. E. coli presentan 4 macrodominios (Ter, Ori, Left, y Rigth) y otras 2 regiones no estructurales adyacentes al macrodominio Ori (Shen, 2019). Por lo tanto, las bacterias también cuentan con análogos de la cromatina e histonas: el nucleoide y las proteínas asociadas, respectivamente.
Proteínas asociadas al nucleoide
A las proteínas asociadas se les llamó inicialmente proteínas tipo-histonas porque realizan tareas análogas a las histonas en la cromatina eucarionte, sin embargo, después, el término se consideró inapropiado porque estos dos grupos de proteínas no comparten relación. Por lo tanto, se les denominó proteínas asociadas al nucleoide (NAPs, por sus siglas en inglés), el cual es un término más adecuado, ya que indica la localización celular sin sugerir relación con las histonas (Stojkova, 2019).
Las NAPs son algunas de las proteínas más abundantes en la célula bacteriana. Hasta el momento las proteínas más estudiadas son: HU, IHF, H-NS, Fis, Lrp y Dps. Una característica distintiva de ellas, es su habilidad de unión al DNA de manera específica (a una secuencia o estructura) como de manera no especifica; debido a ello, las NAPs presentan una función doble. La interacción especifica al DNA está mayoritariamente comprendida en procesos celulares tales como transcripción (H-NS), replicación (HU, IHF, FIS), recombinación (HU). Además, se considera que la unión inespecífica es crucial en la compactación del cromosoma. Las proteínas asociadas al nucleoide pueden unirse en homodiméros, es decir, diferentes copias de la misma proteína o en heterodiméros, entre proteínas diferentes (Dorman, 2020)
Al no presentar histonas, se consideraba que las bacterias carecían de la opción reguladora que ocurre en las modificaciones postraduccionales, sin embargo, estudios recientes muestran que las NAPs también pueden presentar modificaciones postraduccionales las cuales generarían efectos análogos. Normalmente estas modificaciones (adición de un grupo acetilo o fosfato) se encuentran en los aminoácidos relacionados con la interacción con el DNA (Dilweg, 2018).
Ninguna proteína asociada al nucleoide presenta similitud estructural (forma) ni en su secuencia de aminoácidos (fondo) con las proteínas histonas, por lo tanto, son proteínas sin relación con su historia evolutiva. Sin embargo, presentan similitudes físicas y químicas: un bajo peso molecular (∼11 kDa- 15 kDa), alto número de copias de las proteínas en la célula modulan la compactación del DNA, tienen un rol importante en otros procesos celulares (por ejemplo, la replicación) y además pueden presentar modificaciones postraduccionales que influyen en la expresión génica de las células.
Referencias:
Dilweg, I. W., & Dame, R. T. (2018). Post-translational modification of nucleoid-associated proteins: an extra layer of functional modulation in bacteria?. Biochemical Society transactions, 46(5), 1381–1392.
Dorman, C. J., Schumacher, M. A., Bush, M. J., Brennan, R. G., & Buttner, M. J. (2020). When is a transcription factor a NAP?. Current opinion in microbiology, 55, 26–33.
Hołówka, J., & Zakrzewska-Czerwińska, J. (2020). Nucleoid Associated Proteins: The Small Organizers That Help to Cope With Stress. Frontiers in microbiology, 11, 590.
Macvanin, M., & Adhya, S. (2012). Architectural organization in E. coli nucleoid. Biochimica et biophysica acta, 1819(7), 830–835.
Pierce, B. A. (2004). Genetics: A conceptual approach. W.H. Freeman, New York.
Pul, Ü., Wagner, R. (2010) Nucleoid-Associated Proteins: Structural Properties. In: Dame R.T., Dorman C.J. (eds) Bacterial Chromatin. Springer, Dordrecht.
Sender, R., Fuchs, S., & Milo, R. (2016). Revised Estimates for the Number of Human and Bacteria Cells in the Body. PLoS biology, 14(8), e1002533.
Shen, B. A., & Landick, R. (2019). Transcription of Bacterial Chromatin. Journal of molecular biology, 431(20), 4040–4066.
Stojkova, P., Spidlova, P., & Stulik, J. (2019). Nucleoid-Associated Protein HU: A Lilliputian in Gene Regulation of Bacterial Virulence. Frontiers in cellular and infection microbiology, 9, 159.
Verma, S. C., Qian, Z., & Adhya, S. L. (2019). Architecture of the Escherichia coli nucleoid. PLoS genetics, 15(12), e1008456.
Wang, X., Montero Llopis, P., & Rudner, D. Z. (2013). Organization and segregation of bacterial chromosomes. Nature reviews. Genetics, 14(3), 191–203.
Zhou, B. R., & Bai, Y. (2019). Chromatin structures condensed by linker histones. Essays in biochemistry, 63(1), 75–87.