Descubriendo los secretos de la enfermedad de Chagas
La enfermedad de Chagas es una infección parasitaria causada por el protozoario Trypanosoma cruzi, que es endémica en América Latina. En décadas recientes, la enfermedad se ha expandido a otras regiones del mundo. Esto se debe principalmente a dos factores: por un lado, la migración de personas infectadas desde las zonas endémicas ha contribuido a la diseminación de la enfermedad a nivel global. Por otro lado, si bien la transmisión tradicional a través de insectos hematófagos del género Triatoma sigue siendo la principal vía de contagio, otras formas de propagación, como la vertical de madre a hijo y la transmisión por transfusiones sanguíneas o trasplantes de órganos, se han vuelto cada vez más frecuentes. Como resultado de estos factores, se estima que alrededor de 7 millones de personas en todo el mundo padecen esta enfermedad.
El parásito se transmite principalmente a través de los insectos mencionados, manifestándose inicialmente de forma aguda y luego evolucionando a una fase crónica. Cerca del 30% de los infectados desarrollan complicaciones graves y potencialmente mortales, años e incluso décadas después. Estas complicaciones incluyen trastornos cardíacos como arritmias, miocardiopatía e insuficiencia cardíaca, así como problemas del sistema digestivo representados como megaesófago y megacolon.
Entender por qué el corazón es uno de los órganos más afectados en la fase crónica de la enfermedad, sigue siendo un importante desafío para la investigación. En un artículo publicado recientemente1, abordamos esta pregunta utilizando modelos celulares que se asemejan al músculo esquelético y cardiaco, con el objetivo de desentrañar qué es lo que hace al corazón ser más vulnerable a los daños crónicos causados por esta enfermedad.
Utilizamos una línea celular de mioblastos (H9c2) proveniente de la rata BD1X. Estas células pueden ser cultivadas y diferenciadas en dos tipos celulares: unos que imitan el músculo cardíaco (miotubos cardíacos), y otras que imitan el músculo esquelético (miotubos esqueléticos). También mantuvimos células H9c2 sin diferenciar (mioblastos) como control.
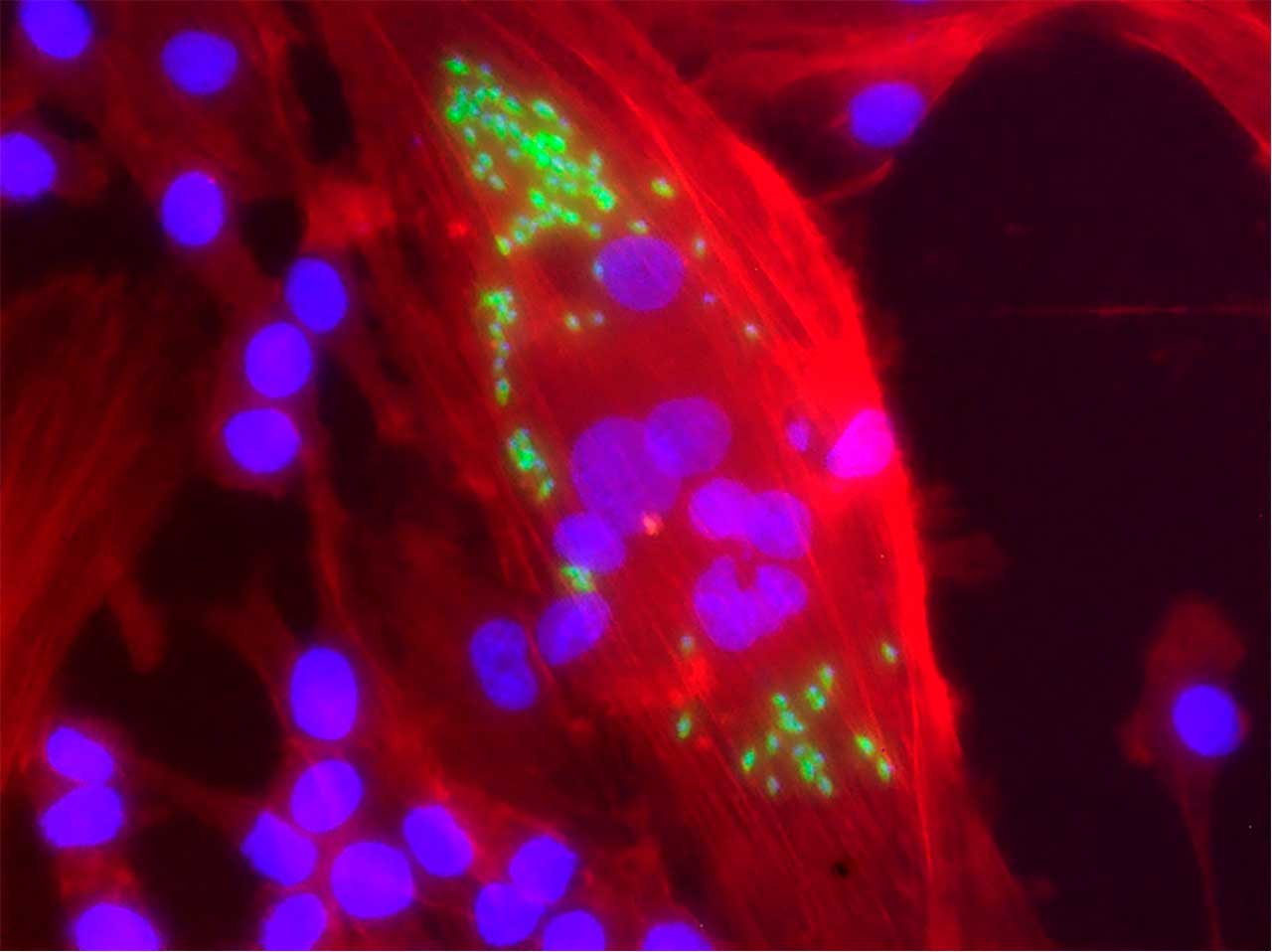
Estos tres tipos de células fueron infectados con T. cruzi y seguimos la progresión de la infección a lo largo del tiempo. Además, medimos cuántas células se infectaron inicialmente y cuántos parásitos se liberaron de las células infectadas. La figura ilustra una sección de un cultivo de miotubos en la que una célula está infectada.
Los resultados mostraron que inicialmente, los tres tipos de células eran igualmente susceptibles a la infección por T. cruzi. Sin embargo, en etapas tardías de la infección, los miotubos cardiacos presentaron niveles mucho más altos de infección, llegando a casi el 13% de células infectadas, en comparación con solo el 3% en miotubos esqueléticos y mioblastos.
Al examinar más de cerca los parásitos dentro y fuera de las células, y con la ayuda de un modelo matemático, descubrimos que esto no se debe a una mayor liberación de parásitos por célula, pero puede ser explicado por una mayor transmisión de parásitos de célula a célula en los miotubos cardiacos. El modelo matemático consiste en un autómata celular en el que cada compartimento puede estar vacío u ocupado por una célula. Las reglas de evolución del autómata determinan las condiciones en que una célula se infecta de la forma tradicional o por contacto, y cómo progresa la infección intracelular.
Estos hallazgos sugieren que mecanismos específicos en los cardiomiocitos, podrían facilitar la propagación del parásito de una célula a otra, sin necesidad de salir al medio extracelular, lo que explicaría por qué el corazón es uno de los órganos más afectados en la enfermedad de Chagas crónica.
Este estudio aporta nuevas luces sobre los procesos que subyacen a la patología cardíaca en la enfermedad de Chagas. Al utilizar modelos celulares in vitro, pudimos identificar diferencias clave en la dinámica de infección entre células que asemejan al músculo esquelético y cardiaco, algo que sería muy difícil de estudiar directamente en pacientes.
Comprender mejor estos mecanismos celulares podría ayudarnos al desarrollo de mejores estrategias de prevención y tratamiento para esta enfermedad desatendida que afecta a millones de personas. Nuestros próximos pasos serán profundizar en los detalles de cómo el parásito se transmite de célula a célula en el modelo celular utilizado en este trabajo, y explorar si existen formas de interrumpir este proceso.
Referencia
- José María Eloy Contreras-Ortiz, Daniel Hernández-Mendoza, Claudia Márquez-Dueñas, Rebeca Manning-Cela and Moisés Santillán (2024) In vitro characterization of Trypanosoma cruzi infection dynamics in skeletal and cardiac myotubes models suggests a potential cell-to-cell transmission in mediating cardiac pathology, PLOS Neglected Tropical Diseases, 18(6): e0012288, DOI: https://doi.org/10.1371/journal.pntd.0012288