Desde la raíz del cabello hasta la punta del pie: terapia fotodinámica para el tratamiento de la micosis
Los Hongos (del latín Fungi) constituyen uno de los reinos de la naturaleza más prolíficos. Están clasificadas unas 100 mil especies, pero se estima que pueden existir más de 1.5 millones. Se encuentran en casi todos los hábitats conocidos y se clasifican en mohos u hongos filamentosos y levaduras. Los hongos tienen una gran importancia económica; las levaduras son las responsables de la fermentación de la cerveza y el pan; la recolección y el cultivo de setas y trufas también es significativo. Desde 1940 se emplean en la producción industrial de antibióticos, así como de enzimas (especialmente proteasas). Algunas especies son agentes de biocontrol de plagas. Otras producen micotoxinas, compuestos bioactivos (como los alcaloides) que son tóxicos para humanos y otros animales.
Las enfermedades fúngicas aquejan a humanos, animales y plantas; el daño a éstas afecta el rendimiento de los cultivos y por ende, incide en la seguridad alimenticia. Las micosis -infecciones por hongos- en humanos, se clasifican de acuerdo con el sitio anatómico en el que surgen, por ejemplo, mucocutáneas o sistémicas; y respecto a la epidemiología, en endémicas u oportunistas. Las infecciones mucocutáneas, como la tiña del cuero cabelludo o la onicomicosis, originan complicaciones desde leves a graves y son muy molestas, aunque rara vez son mortales. Las infecciones sistémicas pueden afectar órganos profundos y suelen ser muy graves y, en la mayor parte de los casos, letales, como la mucormicosis de la que se ha hablado mucho en el contexto de la pandemia de COVID-19. Las micosis endémicas son infecciones causadas por hongos que no forman parte de la flora normal del ser humano, y que se adquieren del entorno. Las micosis oportunistas están ocupando un papel muy importante por el gran aumento de personas inmunodeficientes y su facilidad de transmisión y propagación.
La onicomicosis es una infección mucocutánea endémica que se produce en las uñas de los pies o de las manos por la invasión de hongos patógenos o saprofitos. Es una de las enfermedades micóticas más frecuentes, y los factores predictivos para ésta son el uso de calzado cerrado, humedad en el ambiente, diabetes, obesidad, vejez y tabaquismo, entre otros. La causa más frecuente de onicomicosis son los dermatofitos, aunque también puede producirse por hongos filamentosos no dermatofitos o por levaduras. De las micosis superficiales, se considera la onicomicosis como muy complicada de tratar, ya que se estima que 1 de cada 5 pacientes no se logra curar pese al diagnóstico y tratamiento adecuados [1]. En la Figura 1 se muestran los diferentes tipos de onicomicosis.
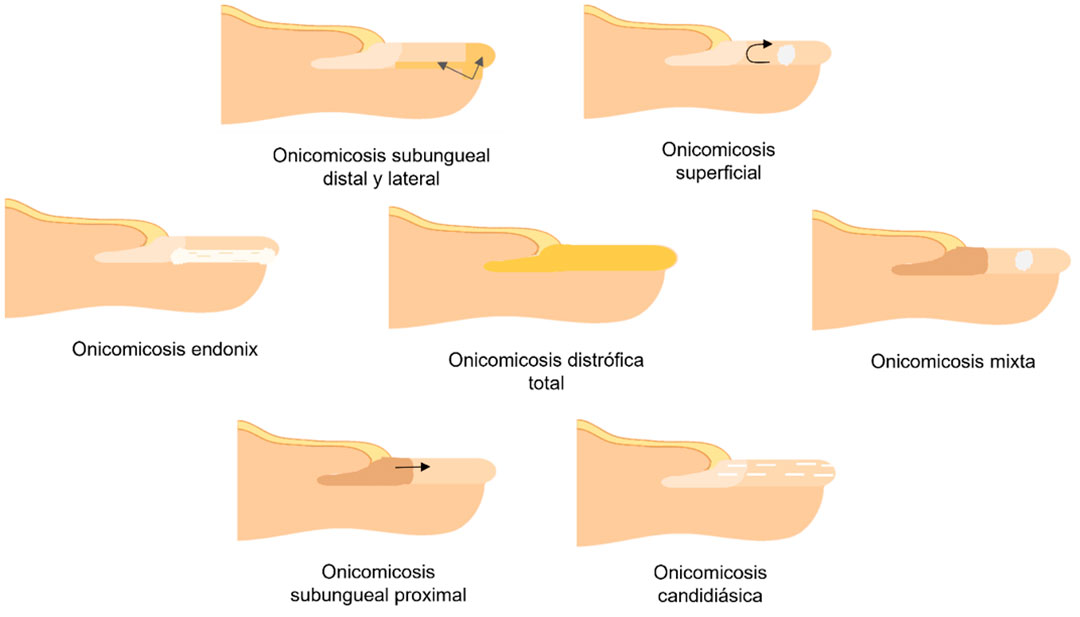
La medicación que existe actualmente tiene algunas limitantes, pues los tratamientos tópicos no logran penetrar por completo la lámina ungueal para atacar directamente el hongo, y los antimicóticos sistémicos como la Anfotericina B, diferentes fármacos del grupo de los azoles (fluconazol, posaconazol, voriconazol, itraconazol, isavuconazol), equinocandinas y flucitosina, tienen, entre otros efectos secundarios, nefrotoxicidad, hipopotasemia, hipomagnesemia, supresión de la médula ósea, malestar gastrointestinal, hipertensión arterial, edema, exantema alérgico, hepatitis, alucinaciones, insuficiencia cardíaca, hepatotoxicidad, trastornos visuales, reacciones cutáneas, exantema y enterocolitis [2].
Entre los tratamientos que se desarrollan con el fin de erradicar la infección o conseguir la persistencia de mejoría durante el mayor tiempo posible, la terapia fotodinámica (TFD) apunta a ser uno de los más prometedores. Consiste en aplicar agentes fotosensibilizadores solos o asociados con nanomateriales que al ser irradiados con láser a una longitud de onda específica (entre 400-1200 nm), generan especies reactivas de oxígeno, las cuales destruyen los hongos.
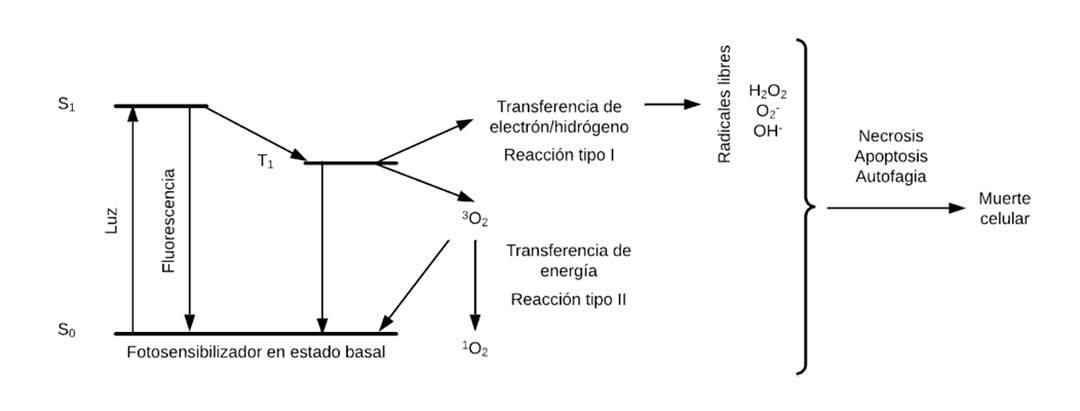
En el mecanismo de funcionamiento de la TFD, cuando un fotón es absorbido por el agente fotosensibilizador que se encuentra en estado basal, un electrón de la banda de valencia se transfiere a un orbital de mayor energía, y la molécula pasa a un estado excitado, cuya duración es apenas de algunos nanosegundos. El electrón puede volver a su estado basal, emitiendo calor y fluorescencia, o sufrir una transición electrónica para pasar a un estado que le permite reaccionar con el oxígeno del ambiente o con moléculas que presentan enlaces oxígeno-oxígeno, de modo que son factibles dos tipos de reacciones. En la Figura 2 se muestra un esquema del proceso de excitación y transferencia electrónica en TFD. En la reacción tipo I no se requiere oxígeno para causar muerte celular, ya que es posible transferir un electrón al sustrato o restar un átomo de hidrógeno para producir radicales peroxilo, hidroxilo o superóxido. En la reacción tipo II se lleva a cabo una transferencia de energía del fotosensibilizador en estado triplete excitado al oxígeno molecular en estado triplete normal para producir oxígeno singlete y fotosensibilizador en estado basal. La formación final de oxígeno singlete o radicales libres (especies reactivas de oxígeno) provoca estrés oxidativo celular, logrando matarlas por apoptosis, necrosis o autofagia. Al finalizar las reacciones, el fotosensibilizador se degrada por la luz (fotoblanqueamiento) o al volver a su estado fundamental podría emplearse en otro ciclo terapéutico. La reacción resultante depende del tipo de fotosensibilizador y de las moléculas con que reaccione.
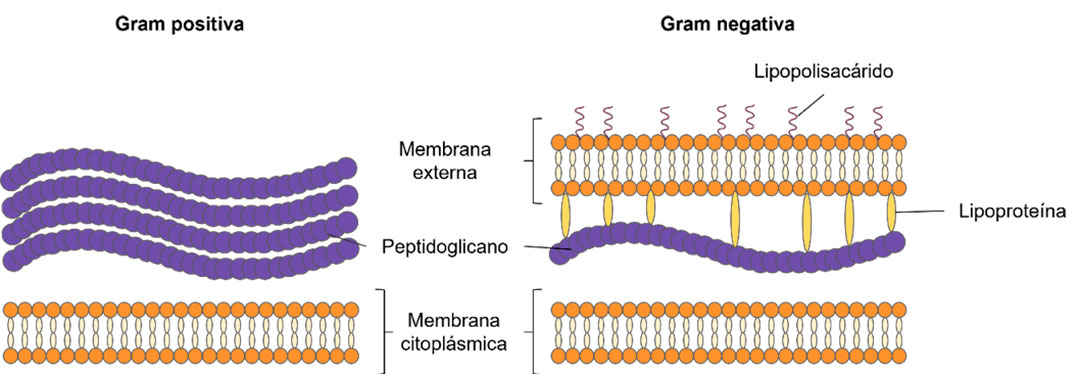
Para que la terapia se efectúe con los mejores resultados, es de suma importancia la absorción o penetración que el fotosensibilizador tenga en las células que se quieren destruir; éstos se absorben en las membranas celulares o en la zona intermembrana, dependiendo de las características de superficie, tanto de la membrana celular como de la estructura molecular del fotosensibilizador. Por ejemplo, en las células denominadas Gram positivas, la pared celular es gruesa y se conforma mayormente por peptidoglicano (80-90%) y en las Gram negativas, la pared celular es más delgada con una mínima parte de peptidoglicano (10-20%) que se encuentra rodeada por una membrana externa, la cual contiene lipoproteínas y lipopolisacáridos (Fig. 3). Ambos tipos de células se presentan en la Figura 3.
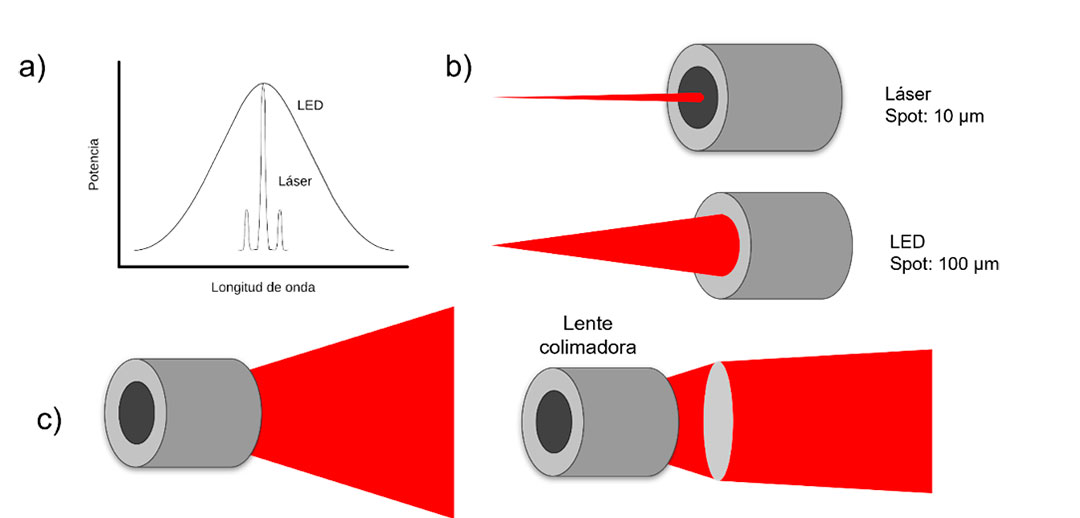
Respecto a la absorción de la luz, es necesario conocer las propiedades ópticas del agente fotosensibilizador, con el fin de seleccionar la fuente de luz y la longitud de onda para maximizar la absorción y generar las transiciones, y así obtener las especies reactivas. Para la TFD se utiliza, de preferencia, radiación monocromática ajustada a la absorción específica del agente fotosensibilizador. Puede emplearse luz láser o luz LED. La ventaja de utilizar láser es que se requiere un menor tiempo de exposición, debido a que se transporta un número mayor de fotones en un haz de luz, además de que puede irradiarse sobre puntos más específicos de la muestra debido al tamaño del spot. Por otra parte, el uso de luz LED es más económico, tiene bajo consumo de energía, mayor vida útil, reducción de emisión de calor y es resistente a vibraciones. En este tipo de fuente, es posible emplear una lente colimadora (Fig. 4), con el fin de reducir la dispersión del haz y dirigir la mayor cantidad posible de fotones sobre la muestra.
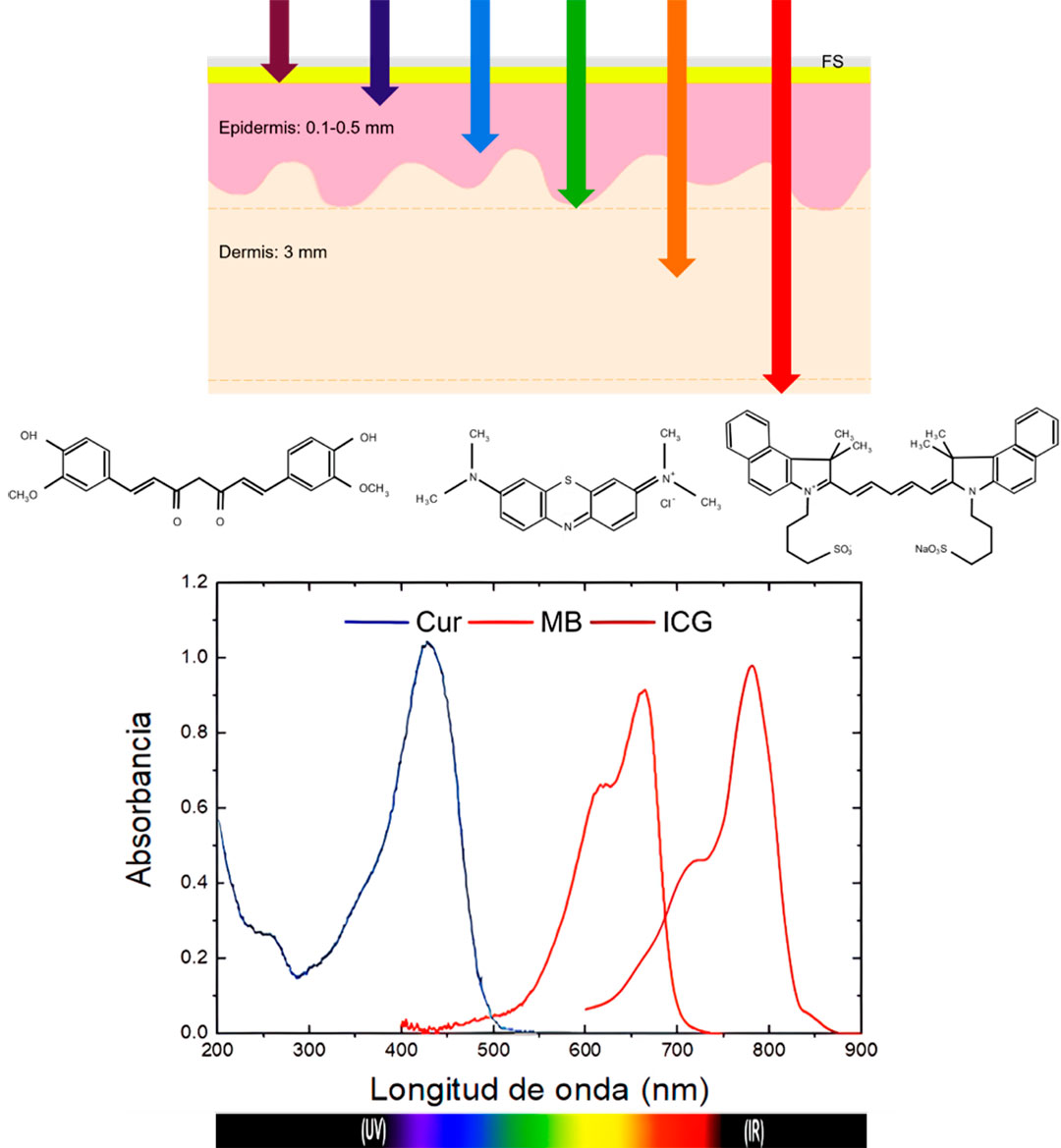
Como se muestra en la Figura 5, la profundidad de penetración de los fotones en la piel, depende de la longitud de onda de la luz con la que se irradie. Es importante considerar el tipo de onicomicosis que se vaya a tratar, pues la infección puede ser superficial o profunda, incipiente o extensa, para definir la longitud de onda y el agente fotosensibilizador. En la Figura 5 se presentan la estructura molecular y los espectros de absorción de tres fotosensibilizadores típicos utilizados en TFD: curcumina (Cur) [3], azul de metileno (MB) y verde de indocianina (ICG) [4], cuyos picos máximos de absorción se encuentran en 405 nm, 650 nm y 800 nm respectivamente. De acuerdo con lo expuesto, la selección del fotosensibilizador estaría relacionada con la profundidad y extensión de la infección micótica.
Se ha reportado que la terapia fotodinámica para combatir la onicomicosis tiene resultados favorables entre 3 y 12 sesiones, llegándose a obtener hasta un 90-100% de curación, con mejoría persistente después de varios meses, aunque los resultados dependen de varios factores [5].
En algunos casos se opta por emplear portadores para los agentes fotosensibilizadores, con el fin de aumentar la capacidad de éstos, mejorar su estabilidad en el tiempo o frente a la radiación, y su capacidad de penetración, por mencionar algunas ventajas. El uso de nanomateriales, y específicamente de materiales grafénicos, como el óxido de grafeno, óxido de grafeno reducido o puntos cuánticos de grafeno, ha demostrado ser viable para el tratamiento de onicomicosis, así como de otras afecciones por fototerapia, por su afinidad química, su integración a células vivas y su elevada área superficial que les permitiría adsorber gran cantidad del fotosensibilizador. En algunos estudios que utilizan derivados del grafeno como portadores de diferentes sensibilizadores para TFD para el tratamiento de bacterias, hongos y levaduras se encontró mejor biocompatibilidad, mayor liberación de especies reactivas del oxígeno, considerable reducción de viabilidad celular, y, con ello, disminución del crecimiento de los microorganismos de interés, comparados con los controles sin derivados del grafeno.
Avance
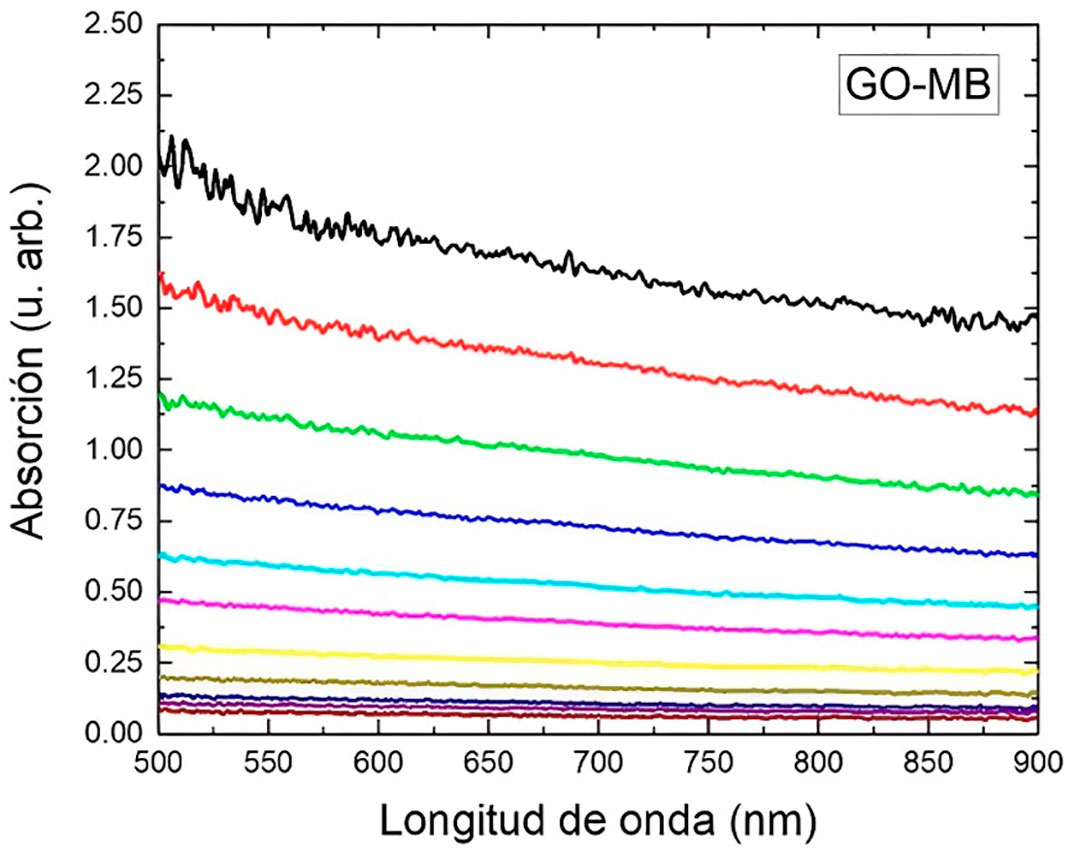
En nuestro grupo estamos estudiando el tratamiento in vitro del hongo causante de onicomicosis Candida haemulonii por TFD, utilizando azul de metileno (MB) como agente fotosensibilizador, óxido de grafeno (GO) como portador del MB y una fuente de luz de 660 nm. Los cultivos se trataron cada semana y con diferentes períodos de irradiación en cada sesión. La soluciones preparadas de GO-MB estudiadas por espectroscopia UV-Vis (Fig. 6), indican una completa adsorción del MB en el GO, pero actualmente se está estudiando la proporción óptima GO:MB para maximizar el efecto sobre el hongo.
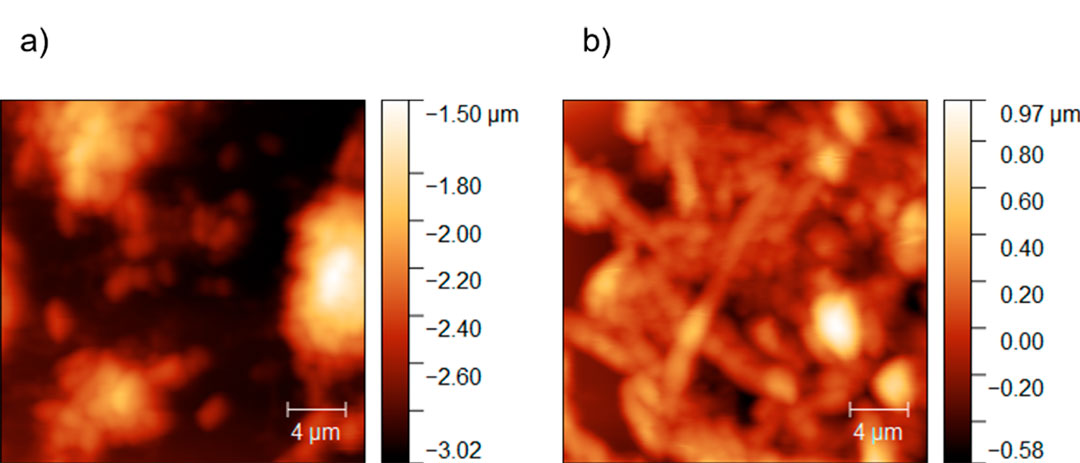
El efecto del tratamiento se estudió por microscopia de fuerza atómica. En la Figura 7 se presentan imágenes de AFM de 20×20 µm2 de un frotis tomado del cultivo sin tratamiento (blanco) y de una muestra tratada con GO-MB después de tres sesiones. Se observa un cambio en la morfología del hongo con el tratamiento, que puede deberse a una destrucción de las paredes celulares, que más adelante esperamos confirmar por microscopia confocal.
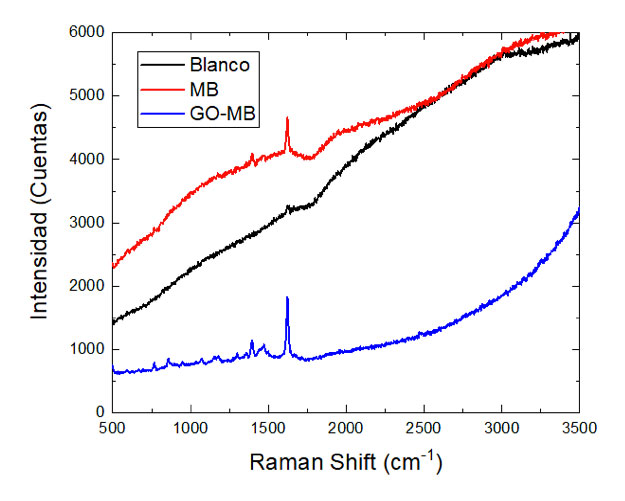
Otro ensayo realizado para estudiar el efecto del tratamiento fue una tinción con MB sobre el blanco y hongo tratado con MB y GO-MB tras la sesión final de TFD. Los espectros Raman (Fig. 8) indican una mayor absorción del colorante en la muestra que se trató con GO-MB, lo cual podría confirmar el daño de la pared celular, favorecido por la penetración del GO en la pared, mientras que el blanco mostró la menor absorción del MB.
Conclusiones y Perspectivas
El tratamiento in vitro de una cepa de hongos causantes de onicomicosis por TFD usando MB como fotosensibilizador y como portador GO, sugiere que el GO favorece la penetración del fotosensibilizador y por tanto, el daño a la pared celular de los hongos. Nos encontramos optimizando las concentraciones de GO y MB, los tiempos de tratamiento y el número de sesiones y también estamos por realizar estudios a nivel celular del efecto causado por el tratamiento y el GO. El uso de GO, un nanomaterial hidrofílico, con buena biocompatibilidad y penetración celular, haría más versátil el tratamiento para onicomicosis y otras infecciones por hongos, desde la raíz del cabello hasta la punta de pie.
Dedicatoria y agradecimientos
A la memoria de nuestro amigo, el Dr. Juan Bernal Martínez, quien falleció durante la preparación de este artículo. Se agradece al proyecto CONACYT Ciencia de Frontera 40798 por el financiamiento.
Referencias
- Dalmay, J., Roé, E., Corella, F., García-Navarro, X., & Puig, L. (2006). Onicomicosis: tratamiento. Farmacia profesional, 20(10), 62-66.
- Revankar, S. (2019). Fármacos antimicóticos. Manual MSD versión para profesionales. https://www.msdmanuals.com/es-cl/professional/enfermedades-infecciosas/hongos/f%C3%A1rmacos-antimic%C3%B3ticos
- Waranyoupalin, R., Wongnawa, S., Wongnawa, M., Pakawatchai, C., Panichayupakaranant, P., & Sherdshoopongse, P. (2009). Studies on complex formation between curcumin and Hg (II) ion by spectrophotometric method: A new approach to overcome peak overlap. Open Chemistry, 7(3), 388-394.
- Prahl, S. (2018). Optical Absorption of Indocyanine Green (ICG). https://omlc.org/spectra/icg/
- Watanabe, D., Kawamura, C., Masuda, Y., Akita, Y., Tamada, Y., & Matsumoto, Y. (2008). Successful treatment of toenail onychomycosis with photodynamic therapy. Archives of Dermatology, 144(1), 19-21.