El microbioma y las espondiloartritis
Espondiloartritis
Las Espondiloartritis (EspA), también llamadas espondiloartropatías, son un grupo de enfermedades que estudia y trata la reumatología y que se agrupan por compartir características clínicas, genéticas, epidemiológicas, fisiopatológicas y de respuesta terapéutica. Clásicamente, este grupo incluye a la espondilitis anquilosante, la artritis reactiva, la artritis psoriásica, la artritis relacionada con la enfermedad inflamatoria intestinal y la EspA indiferenciada (1).
En la actualidad se reconoce a las EspA como una sola enfermedad o entidad clínica y los pacientes se clasifican en EspA axial o periférica en función de los síntomas predominantes. La EspA axial se caracteriza por síntomas en la columna vertebral y articulaciones sacroilíacas que incluyen dolor de espalda y rigidez matutina en la columna, mientras que los síntomas de la EspA periférica son esencialmente en las extremidades e incluyen la presencia de oligoartritis principalmente en los miembros inferiores, entesitis o dactilitis (dedos en salchicha).
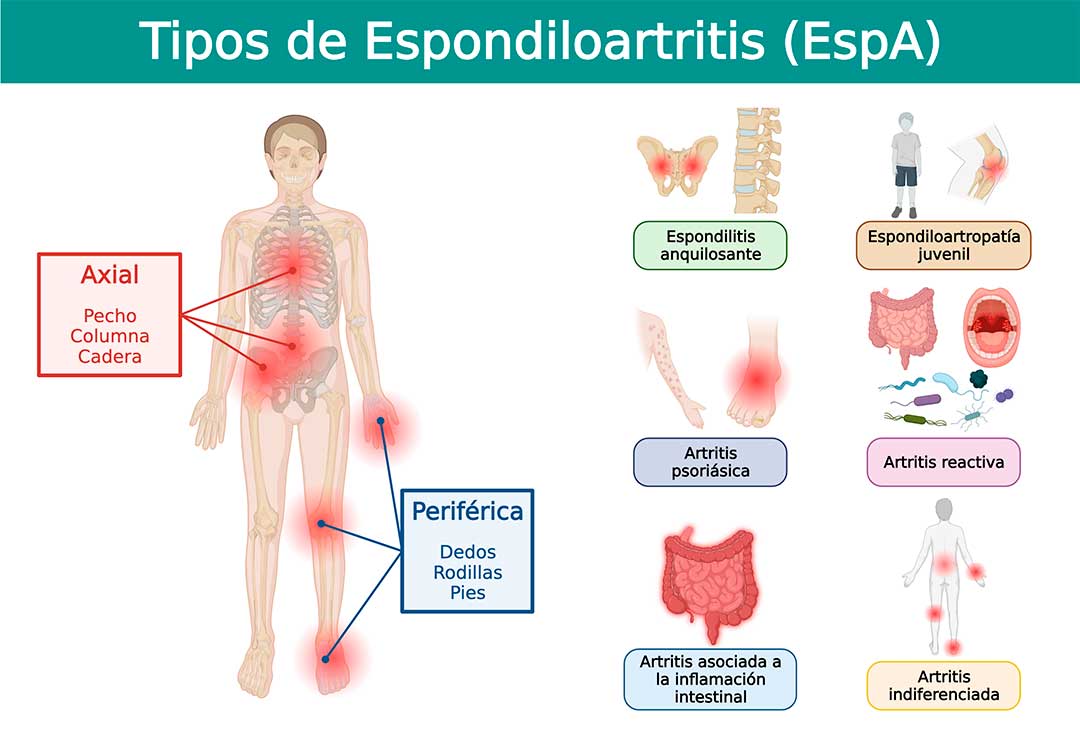
Como su nombre lo indica, la inflamación articular es característica en las EspA, y en etapas más avanzadas, genera crecimiento anormal del hueso, lo que puede ocasionar anquilosis, que es la fusión ósea en los espacios articulares y, en consecuencia, reducir parcial o totalmente la capacidad de movimiento de la articulación. Los pacientes con espondilitis anquilosante, presentan proyecciones óseas llamadas sindesmofitos, que se desarrollan a lo largo de los ligamentos de la columna vertebral, específicamente en las articulaciones intervertebrales, y que son una característica radiográfica distintiva de la enfermedad, a la que comúnmente se denomina “columna en caña de bambú” (2).
El carácter heterogéneo de las manifestaciones clínicas y los subtipos incluidos en las EspA dificultan su diagnóstico, el cual no es sencillo y puede retrasarse muchos años, debido en parte a que los síntomas que presentan una proporción de pacientes son inespecíficos e intermitentes, además, el paciente no suele buscar atención médica especializada, entre otros factores, por la escasa difusión que este grupo de enfermedades tiene. La introducción de la resonancia magnética de la columna ha mejorado sustancialmente el diagnóstico temprano, ya que la enfermedad puede detectarse antes de que se desarrollen daños estructurales visibles en las radiografías.
El manejo de las EspA a menudo requiere un enfoque coordinado entre médicos reumatólogos y otros especialistas como dermatólogos, gastroenterólogos, oftalmólogos, cardiólogos, radiólogos y fisioterapeutas, ya que las distintas manifestaciones clínicas de cada paciente, determinan la selección del tratamiento en forma individualizada.
El objetivo principal del tratamiento en las EspA, es mejorar la calidad de vida reduciendo la intensidad de los síntomas, y controlar la inflamación generada por la enfermedad para mantener un estado de salud a largo plazo. La prevención de la proliferación ósea para la preservación de la función articular, es hoy en día el mayor desafío del tratamiento, toda vez que los medicamentos actuales son efectivos para controlar la inflamación, pero no previenen del daño estructural progresivo (3,4).
El proceso exacto que origina la enfermedad sigue siendo desconocido; sin embargo, cada vez hay más pruebas que señalan que las EspA son consecuencia de una interacción compleja entre factores genéticos y ambientales. El antígeno leucocitario humano (HLA)-B27 es el factor de riesgo genético dominante, y está presente hasta en el 90% de los pacientes; no obstante, la presencia de este antígeno no es suficiente para desarrollar la enfermedad, ya que menos del 5% de los portadores del HLA-B27 la padecen. Esto indica que los factores ambientales tienen un rol notable en el desarrollo de la enfermedad.
Los principales factores ambientales vinculados con estas enfermedades son la microbiota intestinal y el estrés biomecánico. Del primero hablaremos con todo detalle en la sección siguiente. Con respecto al segundo, se ha descrito que los sitios anatómicos con mayor afectación corresponden a aquellos que reciben la mayor demanda mecánica, como la columna y el sacro en la espondilitis anquilosante, o los pies en la tarsitis anquilosante. Una hipótesis propone que las células en las entesis (región donde un tendón, ligamento, cápsula articular o fascia muscular se une al hueso), están impedidas para recibir o traducir correctamente los estímulos mecánicos en el proceso llamado mecanopropiocepción y generan una respuesta exagerada a los estímulos que traen como consecuencia la inflamación y diferenciación y proliferación anormal del hueso (5).
Microbioma y Espondiloartritis
Diversos estudios han demostrado que los microorganismos juegan un papel en la aparición de las EspA. Por ejemplo, la artritis reactiva es desencadenada por Chlamydia trachomatis en infecciones genitourinarias o por otras enterobacterias gramnegativas, como las especies Shigella, Salmonella, Yersinia y Campylobacter, mientras que la artritis inflamatoria se desarrolla con frecuencia después de la infección por organismos entéricos, como Clostridium difficile, Brucella y Giardia (6).
Por otra parte, se ha demostrado la presencia de componentes bacterianos en las articulaciones de pacientes con EspA, y aunque se asume que las bacterias están fragmentadas y no vivas, la identificación del ARN de Chlamydia trachomatis en estos tejidos, demuestra un proceso activo de síntesis de material genético, e indica que existen bacterias viables en las articulaciones de algunos pacientes con EspA.
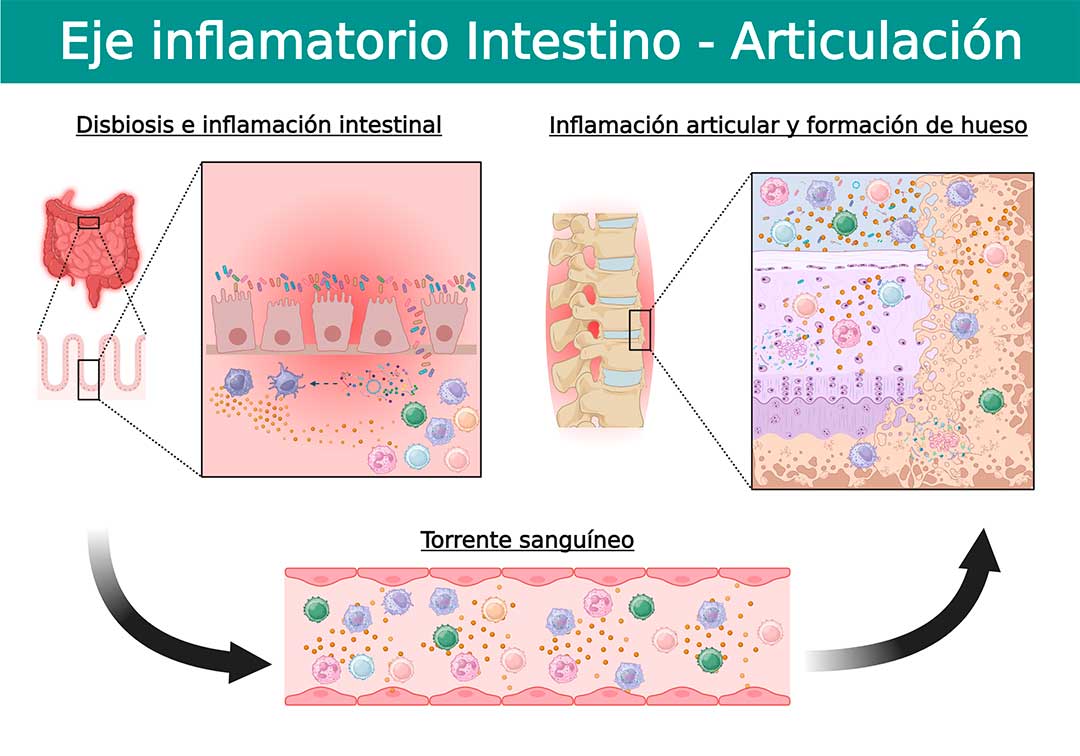
Las fuertes superposiciones genéticas y clínicas entre la EspA y la enfermedad inflamatoria intestinal, han puesto en los últimos años una atención necesaria en la conexión entre la inflamación del intestino y las articulaciones. El término “eje inflamatorio intestino-articulación” es ahora reconocido como un elemento relacionado a la patogenia de las EspA.
Aunque los mecanismos que establecen la conexión entre el intestino y las articulaciones no son conocidos en detalle, estudios recientes han demostrado que los cambios en el microbioma intestinal conducen a cambios estructurales e inmunológicos en las EspA. Además, se ha establecido una relación causal que se observa cuando en los pacientes la inflamación intestinal subclínica precede a la inflamación de las articulaciones, y también que ésta mejora cuando la inflamación articular se controla (7).
La microbiota es un ecosistema homeostático complejo que incluye la totalidad de microorganismos que forman parte de nuestro organismo, incluyendo bacterias, hongos, virus y arqueas. Por su parte, el microbioma refiere al genoma de todos los microorganismos de la microbiota y es mucho más amplio, pues incluye los conjuntos de comunidades microbianas, genes y metabolitos, así como las condiciones ambientales que los rodean.
Las células microbianas superan en número a las células huésped por un factor de diez y, en conjunto, albergan 100 veces más genes que el genoma humano. Se cree que aproximadamente el 10% de todos los metabolitos en humanos tienen orígenes microbianos. Esta relación mutuamente beneficiosa, ofrece nutrientes al huésped para las bacterias comensales intestinales, a cambio de capacidades metabólicas y fisiológicas.
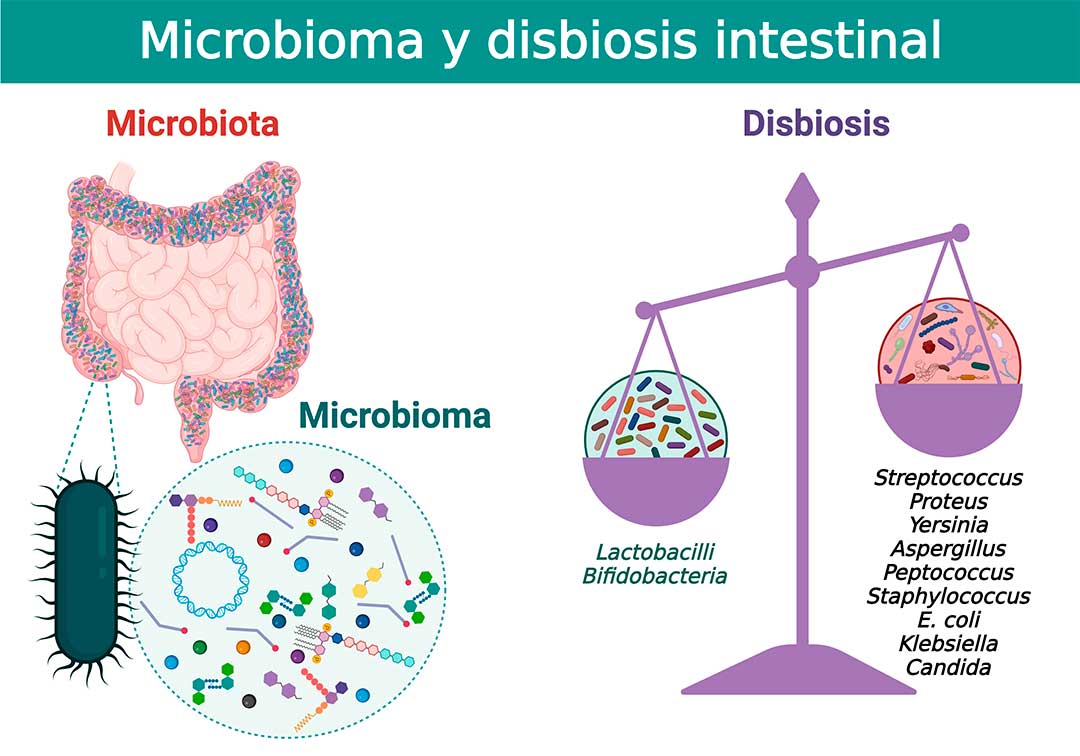
El intestino es crucial para mantener la homeostasis entre la microbiota y el huésped, lo que implica la participación efectiva del sistema inmune. La microbiota intestinal está asociada con actividades metabólicas y fisiológicas humanas, incluido el equilibrio de la respuesta inmune, la regulación de la función endocrina intestinal, la digestión de los alimentos y en la barrera epitelial intestinal. Se ha estimado que el número de células de la microbiota típica del colon humano alcanza 1012 unidades formadoras de colonias, y está compuesta principalmente por Bacteroidetes, Firmicutes, Actinobacteria y Proteobacteria (8).
Cambios específicos en el microbioma intestinal pueden ser los responsables del inicio de enfermedades autoinflamatorias y autoinmunes. Estos cambios, conocidos como disbiosis intestinal, incluyen un mayor número de patógenos oportunistas y un cambio en la composición de las bacterias comensales. La disbiosis intestinal puede desencadenar la activación antigénica de células del sistema inmunológico que generan inflamación crónica (9).
En años recientes, con la llegada de las tecnologías genómicas y la bioinformática, se han producido enormes avances en la comprensión de los cambios del microbioma intestinal de los pacientes con EspA. Hoy en día se sabe que la composición del microbioma intestinal de las personas portadoras de algunas enfermedades es diferente en las personas sanas. Las técnicas de secuenciación masiva de ADN han permitido identificar las bacterias Bacteroides coprophilus, Parabacteroides distasonis, Eubacterium siraeum, Acidaminococcus fermentans, y Prevotella copri se hallan aumentadas en la microbiota de los pacientes con EspA, mientras que Enterococcus faecium se encuentran disminuidas.
La permeabilidad intestinal que determina la cantidad y tipo de substancias que cruzan del interior del intestino al torrente sanguíneo, se encuentra incrementada en pacientes con EspA y ha sido reconocida como un mecanismo explicativo del eje inflamatorio intestino-articulación. La dicotomía del “qué fue primero, el huevo o la gallina” se aplica cuando se trata de explicar la inflamación y pérdida de la función de barrera intestinal. A la fecha no se sabe si la inflamación intestinal provoca daño al epitelio o disbiosis que no favorecen la función epitelial, o si el epitelio alterado promueve una ruptura de la homeostasis de la mucosa con la consiguiente inflamación y disbiosis.
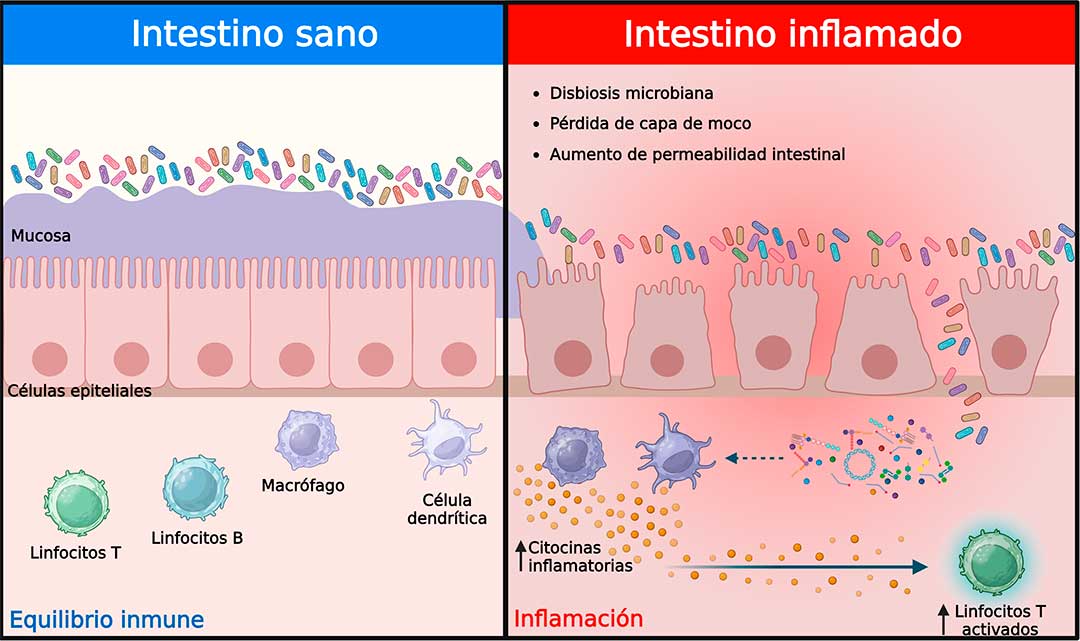
La investigación actual en pacientes y en modelos animales ha permitido teorizar sobre los mecanismos que vinculan el aumento de la permeabilidad e inflamación intestinal, con la inflamación articular en las EspA. Se cree que la disbiosis tiene un impacto en la capa epitelial intestinal, en donde las células se desprenden de la membrana basal, lo que lleva a una arquitectura comprometida. Como resultado, se produce una infiltración microbiana y las células inmunes responden a los productos microbianos y desencadenan la inflamación. Además, también es posible la translocación de productos bacterianos al sistema linfático, y el eventual movimiento en el torrente sanguíneo y más allá, dadas las capacidades fagocíticas de las células presentadoras de antígenos como los macrófagos y las células dendríticas (10,11).
El vínculo entre la disbiosis intestinal y la inflamación articular es hoy en día tan aceptado que se han estudiado nuevas terapias adyuvantes como los probióticos en el tratamiento de las EspA. Los probióticos se describen como microorganismos vivos que brindan ventajas para la salud del huésped cuando se administran en cantidades suficientes. Lactobacillus y Bifidobacterium son los probióticos más frecuentes.
Se ha demostrado que los probióticos mejoran la microbiota al suprimir el crecimiento bacteriano dañino y prevenir mayores daños al sistema inmunológico causados por enfermedades inflamatorias. Los probióticos influyen directamente sobre el sistema inmune al regular la producción de citocinas por las células, y también lo hacen de manera indirecta mediante la manipulación de la barrera epitelial intestinal y la capa mucosa, la liberación de compuestos antimicrobianos y metabolitos que pueden ejercer efectos antiinflamatorios y antibacterianos (12).
Por otra parte, el campo emergente de la farmacomicrobioma, que investiga el efecto de los cambios en la microbiota humana sobre la biodisponibilidad, la eficacia clínica y la toxicidad de una amplia gama de fármacos, es una disciplina que promete facilitar la aparición de enfoques de medicina de precisión basados en el microbioma en la EspA, incluidas estrategias para predecir la respuesta al tratamiento y para mejorar la respuesta a la terapia o reducir la toxicidad de los fármacos (13).
La relación entre las EspA y las bacterias es evidente y ha evolucionado desde una perspectiva histórica. Inicialmente se evidenció la aparición de artritis en respuesta a una infección en otra parte del cuerpo (artritis reactiva), luego se identificó material genético y estructuras bacterianas en el líquido sinovial de pacientes con EspA, y más recientemente se estableció el llamado eje intestino-articulación que supone que la disbiosis en el microbioma intestinal juega un rol fundamental en la activación del sistema inmune que conduce a la artritis. El avance en la biología molecular y en la bioinformática nos ha permitido confirmar que la abundancia y diversidad microbiana en el intestino difiere entre las personas enfermas y sanas, y con ello explorar la posibilidad de la modificación del microbioma como una estrategia terapéutica para las EspA. Éste es un campo de la medicina con un gran potencial y para el cuál la investigación sigue siendo muy necesaria.
Referencias
- Sharip A, Kunz J. Understanding the Pathogenesis of Spondyloarthritis. Biomolecules. el 20 de octubre de 2020;10(10):1461.
- Ulas ST, Deppe D, Ziegeler K, Diekhoff T. New Bone Formation in Axial Spondyloarthritis: A Review. RöFo – Fortschritte Auf Dem Geb Röntgenstrahlen Bildgeb Verfahr. junio de 2024;196(06):550–9.
- Walsh JA, Magrey M. Clinical Manifestations and Diagnosis of Axial Spondyloarthritis. JCR J Clin Rheumatol. diciembre de 2021;27(8):e547–60.
- Drosos AA, Venetsanopoulou AI, Voulgari PV. Axial Spondyloarthritis: Evolving concepts regarding the disease’s diagnosis and treatment. Eur J Intern Med. noviembre de 2023;117:21–7.
- Nagit RE, Rezus E, Cianga P. Exploring the Pathogenesis of Spondylarthritis beyond HLA-B27: A Descriptive Review. Int J Mol Sci. el 31 de mayo de 2024;25(11):6081.
- Zeidler H, Hudson AP. Reactive Arthritis Update: Spotlight on New and Rare Infectious Agents Implicated as Pathogens. Curr Rheumatol Rep [Internet]. julio de 2021 [citado el 16 de septiembre de 2024];23(7). Disponible en: https://link.springer.com/10.1007/s11926-021-01018-6
- Bragazzi MC, Pianigiani F, Venere R, Ridola L. Dysbiosis in Inflammatory Bowel Disease and Spondyloarthritis: Still a Long Way to Go? J Clin Med. el 12 de abril de 2024;13(8):2237.
- Manos J. The human microbiome in disease and pathology. APMIS. diciembre de 2022;130(12):690–705.
- Miyauchi E, Shimokawa C, Steimle A, Desai MS, Ohno H. The impact of the gut microbiome on extra-intestinal autoimmune diseases. Nat Rev Immunol. enero de 2023;23(1):9–23.
- Breban M, Beaufrère M, Glatigny S. The microbiome in spondyloarthritis. Best Pract Res Clin Rheumatol. diciembre de 2019;33(6):101495.
- Shao T, Hsu R, Rafizadeh DL, Wang L, Bowlus CL, Kumar N, et al. The gut ecosystem and immune tolerance. J Autoimmun. diciembre de 2023;141:103114.
- Roy S, Dhaneshwar S. Role of prebiotics, probiotics, and synbiotics in management of inflammatory bowel disease: Current perspectives. World J Gastroenterol. el 14 de abril de 2023;29(14):2078–100.
- Scher JU, Nayak RR, Ubeda C, Turnbaugh PJ, Abramson SB. Pharmacomicrobiomics in inflammatory arthritis: gut microbiome as modulator of therapeutic response. Nat Rev Rheumatol. mayo de 2020;16(5):282–92.
Imagen de portada de kjpargeter en Freepik