El virus dengue y los mecanismos de inmunidad en la piel
El dengue es una enfermedad infecciosa y febril producida por cualquiera de los cuatro serotipos del virus dengue (DENV-1, DENV-2, DENV-3, DENV-4). Este virus es transmitido por el mosquito hembra, de los géneros Aedes aegypti y Aedes albopictus. El virus DEN es uno de los arbovirus con mayor incidencia e importancia médica en México. La infección por un serotipo dado confiere inmunidad permanente contra la re-infección por el serotipo homólogo. En contraste, la re-infección por un serotipo heterólogo sólo induce inmunidad de corta duración y puede condicionar a las formas graves de la enfermedad (Slon Campos, Mongkolsapaya, and Screaton 2018).
Cuando un mosquito infectado con el virus dengue introduce su probóscide en la piel del hospedero para alimentarse de un vaso sanguíneo, el virus ingresa del mismo modo a través de la piel, por lo que estará en contacto con diferentes tipos celulares presentes en los estratos de ésta (Briant et al. 2014). Es importante destacar que la piel es un órgano complejo y dinámico provisto de diferentes tipos celulares, encaminados a mantener la homeostasis del tejido (Di Meglio, Perera, and Nestle 2011). Esta función es esencial, ya que la piel puede usarse como portal de entrada por diversos patógenos, que ingresan al huésped por un daño mecánico o bien por la picadura de un vector. Cada estirpe celular de la piel posee una función concertada y eficiente; algunas de ellas, secretan diferentes mediadores como: citosinas, quimosinas, péptidos antimicrobianos, ácidos grasos, entre otros; todos ellos encaminados a impedir y/o controlar el ingreso de los patógenos al organismo (Nestle et al. 2009).
La piel es un órgano inmunocompetente capaz de establecer una respuesta rápida y eficaz ante patógenos o daño físico, pero también para mantener la homeostasis del organismo. En la piel, el sistema inmune innato es el mecanismo de defensa más primitivo del huésped contra agentes patógenos, no es específico y se inicia por el reconocimiento de un grupo de receptores de patrones moleculares asociados a patógenos (PRRs) los cuales están codificados en línea germinal. El sistema inmune innato, involucra diferentes moléculas y estirpes celulares (Kao, Lai, and Yu 2018).
Es importante destacar que cuando el mosquito vector introduce el estilete a la piel, el tejido cutáneo sufre un daño físico, y por lo tanto se inicia un proceso inflamatorio local, promoviéndose la expresión de citosinas, quimosinas y otros mediadores solubles y la llegada de células en el sitio del daño, contribuyendo de esta manera a la respuesta contra el patógeno. Los mediadores solubles liberados por las células infectadas activan a los polimorfonucleares, neutrófilos, linfocitos T, células naturalmente asesinas NK y otras estirpes celulares que se infiltran al sitio dañado, en donde existen otras células residentes como las células de Langehans queratinocitos y fibroblastos entre otras. Las células residentes y posteriormente las infiltrantes juegan un papel en la señalización temprana que activa y orquesta la respuesta inmune para el establecimiento de un estado antiviral temprano (Navarro-Sanchez, Despres, and Cedillo-Barron 2005).
Dado que el virus DEN ingresa al huésped por la piel, las células blanco son las células dendríticas; adicional a esto se ha demostrado la participación de las células de Lagerhans durante la infección con el virus Dengue en monos, y en modelos “in vitro”, concluyendo más tarde que la molécula DC- SIGN actúa como receptor para el virus dengue. Wu SJ y col (2000) demostraron en un modelo “ex vivo” con explantes de piel cadavéricos, que las células dendríticas migratorias (CD1a) resultaron infectadas (Wu et al. 2000). Con estos resultados se propuso que las LCs dermales y las DC derivados de sangre periférica son el sitio de replicación inicial para el virus dengue, una vez que es introducido por la picadura del mosquito. Más tarde Limón Flores y col 2005, usando explantes de piel humana no cadavérica señalaron la presencia de antígenos virales en la capa supra-basal de la epidermis, donde se encuentran los queratinocitos, sugiriendo que estas células también se infectan y establecen un estado antiviral, siendo estas células en donde se lleva a cabo una primera ronda de replicación viral (Limon-Flores et al. 2005). Este dato fue más tarde confirmado por Surasombatpattana P, (2011) y Lopez González (2018), quienes reportaron que los queratinocitos infectados con el virus dengue, son permisivos a la infección y establecen un estado antiviral, a través de un aumento en la expresión de mRNA de moléculas como TLR3, RIG-I, MDA5 and PKR, resultando en la producción de IFN-β, IFN-γ, β-defensinas y Rnase 7 (Surasombatpattana et al. 2011; Lopez-Gonzalez et al. 2018). En el tejido de primer contacto, hay además células no hematopoyéticas presentes en la piel, las cuales son potencialmente susceptibles a la infección y podrían participar en la respuesta inmune durante las infecciones virales. Kurane y más tarde Busto-Arriaga y col en 2011 infectaron explantes de piel no cadavéricos (provenientes de diferentes donantes) con el virus dengue, para después disgregar el tejido y mostrar que existe una infección productiva con el virus dengue de los fibroblastos dérmicos. Al establecer cultivos primarios de fibroblastos, además de demostrar que son permisivos a la infección por el virus dengue y establecen un estado antiviral a través de la producción de varios mediadores que podrían contribuir a la respuesta inmune innata, unas horas después de que el virus ingresa al huésped (Kurane, Janus, and Ennis 1992; Bustos-Arriaga et al. 2011). (Figura 1).
Recién se demostró que los mastocitos o células cebadas también son blancos de la infección productiva con el virus dengue y que con este estimulo son capaces de desgranularse y modificar su perfil de citosinas. Adicionalmente, se logró aislar al virus dengue de los gránulos liberados por estas células. Este fenómeno podría tener una enorme repercusión en el sentido de la diseminación del virus en el huésped infectado (Troupin et al. 2016).
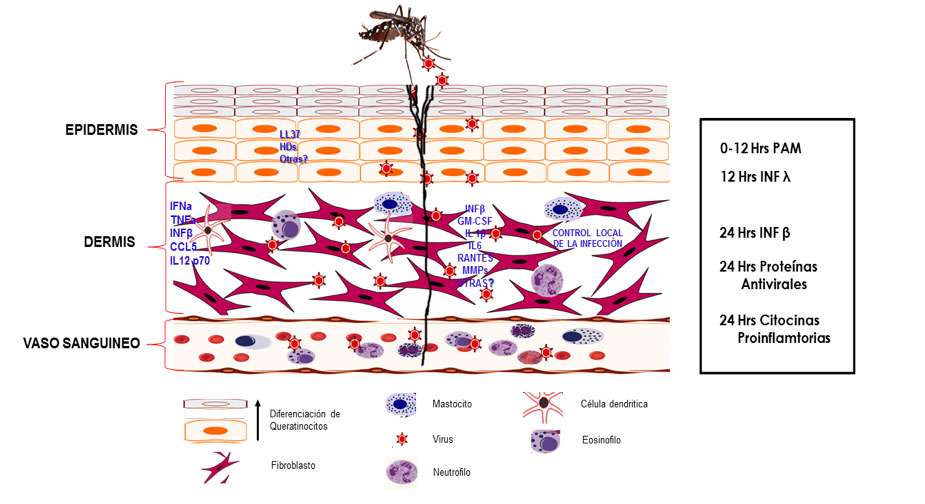
Efecto de la saliva del mosquito en la transmisión de arbovirus
Cuando el mosquito hembra hematófaga, busca un vaso sanguíneo para alimentarse, el virus es introducido a la piel del huésped, inmerso en la saliva del vector. La saliva del vector está compuesta por una gran variedad de moléculas biológicamente activas. Estudios realizados en los últimos años demuestran que la saliva del vector coadyuva el éxito de la infección, favoreciendo de manera adicional la transmisión del virus. Varios trabajos revelan que la saliva tiene la capacidad de modular la respuesta inmune del huésped. Así mismo, la saliva en el sitio de la picadura modifica procesos como la coagulación, la vasoconstricción y la respuesta inflamatoria (Ribeiro 1995). La inhibición de estos procesos asegura una alimentación exitosa del vector, necesaria para su supervivencia y propagación. Los virus aprovechan los efectos que ejercen algunas moléculas de la saliva, sobre la respuesta inmune del hospedero para su propio beneficio, infectando diversas estirpes celulares que se encuentran en la piel. Se han demostrado diferencias importantes entre el proteoma de la saliva proveniente un mosquito sano y la saliva de uno infectado. (Chisenhall et al. 2014).
Los componentes moleculares presentes en la saliva del vector inhiben de manera inicial la respuesta inmune pero a su vez activan procesos que favorecen el reclutamiento celular al sitio de la infección dando a los arbovirus la oportunidad de diseminarse a diversos células permisivas en el hospedero (Fontaine et al. 2011; Cox et al. 2012).
Referencias
- Briant, L., P. Despres, V. Choumet, and D. Misse. 2014. ‘Role of skin immune cells on the host susceptibility to mosquito-borne viruses’, Virology, 464-465: 26-32.
- Bustos-Arriaga, J., J. Garcia-Machorro, M. Leon-Juarez, J. Garcia-Cordero, L. Santos-Argumedo, L. Flores-Romo, A. R. Mendez-Cruz, F. J. Juarez-Delgado, and L. Cedillo-Barron. 2011. ‘Activation of the innate immune response against DENV in normal non-transformed human fibroblasts’, PLoS Negl Trop Dis, 5: e1420.
- Cox, J., J. Mota, S. Sukupolvi-Petty, M. S. Diamond, and R. Rico-Hesse. 2012. ‘Mosquito bite delivery of dengue virus enhances immunogenicity and pathogenesis in humanized mice’, J Virol, 86: 7637-49.
- Chisenhall, D. M., R. C. Christofferson, M. K. McCracken, A. M. Johnson, B. Londono-Renteria, and C. N. Mores. 2014. ‘Infection with dengue-2 virus alters proteins in naturally expectorated saliva of Aedes aegypti mosquitoes’, Parasit Vectors, 7: 252.
- Di Meglio, P., G. K. Perera, and F. O. Nestle. 2011. ‘The multitasking organ: recent insights into skin immune function’, Immunity, 35: 857-69.
- Fontaine, A., I. Diouf, N. Bakkali, D. Misse, F. Pages, T. Fusai, C. Rogier, and L. Almeras. 2011. ‘Implication of haematophagous arthropod salivary proteins in host-vector interactions’, Parasit Vectors, 4: 187.
- Kao, Y. T., M. M. C. Lai, and C. Y. Yu. 2018. ‘How Dengue Virus Circumvents Innate Immunity’, Front Immunol, 9: 2860.
- Kurane, I., J. Janus, and F. A. Ennis. 1992. ‘Dengue virus infection of human skin fibroblasts in vitro production of IFN-beta, IL-6 and GM-CSF’, Arch Virol, 124: 21-30.
- Limon-Flores, A. Y., M. Perez-Tapia, I. Estrada-Garcia, G. Vaughan, A. Escobar-Gutierrez, J. Calderon-Amador, S. E. Herrera-Rodriguez, A. Brizuela-Garcia, M. Heras-Chavarria, A.Flores-Langarica, L. Cedillo-Barron, and L. Flores-Romo. 2005. ‘Dengue virus inoculation to human skin explants: an effective approach to assess in situ the early infection and the effects on cutaneous dendritic cells’, Int J Exp Pathol, 86: 323-34.
- Lopez-Gonzalez, M., D. Meza-Sanchez, J. Garcia-Cordero, J. Bustos-Arriaga, C. Velez-Del Valle, M. Marsch-Moreno, T. Castro-Jimenez, L. Flores-Romo, L. Santos-Argumedo, B. Gutierrez-Castaneda, and L. Cedillo-Barron. 2018. ‘Human keratinocyte cultures (HaCaT) can be infected by DENV, triggering innate immune responses that include IFNlambda and LL37’, Immunobiology, 223: 608-17.
- Navarro-Sanchez, E., P. Despres, and L. Cedillo-Barron. 2005. ‘Innate immune responses to dengue virus’, Arch Med Res, 36: 425-35.
- Nestle, F. O., P. Di Meglio, J. Z. Qin, and B. J. Nickoloff. 2009. ‘Skin immune sentinels in health and disease’, Nat Rev Immunol, 9: 679-91.
- Ribeiro, J. M. 1995. ‘Blood-feeding arthropods: live syringes or invertebrate pharmacologists?’, Infect Agents Dis, 4: 143-52.
- Slon Campos, J. L., J. Mongkolsapaya, and G. R. Screaton. 2018. ‘The immune response against flaviviruses’, Nat Immunol, 19: 1189-98.
- Surasombatpattana, P., R. Hamel, S. Patramool, N. Luplertlop, F. Thomas, P. Despres, L. Briant, H. Yssel, and D. Misse. 2011. ‘Dengue virus replication in infected human keratinocytes leads to activation of antiviral innate immune responses’, Infect Genet Evol, 11: 1664-73.
- Troupin, A., D. Shirley, B. Londono-Renteria, A. M. Watson, C. McHale, A. Hall, A. Hartstone-Rose, W. B. Klimstra, G. Gomez, and T. M. Colpitts. 2016. ‘A Role for Human Skin Mast Cells in Dengue Virus Infection and Systemic Spread’, J Immunol, 197: 4382-91.
- Wu, S. J., G. Grouard-Vogel, W. Sun, J. R. Mascola, E. Brachtel, R. Putvatana, M. K. Louder, L. Filgueira, M. A. Marovich, H. K. Wong, A. Blauvelt, G. S. Murphy, M. L. Robb, B. L. Innes, D. L. Birx, C. G. Hayes, and S. S. Frankel. 2000. ‘Human skin Langerhans cells are targets of dengue virus infection’, Nat Med, 6: 816-20.
Leticia Cedillo-Barrón 1*, Julio García-Cordero1, Paola Valenzuela- León 1 Benito Gutiérrez –Castañeda 2.
1 Departamento de Biomedicina Molecular, Centro de Investigación y de Estudios Avanzados del IPN (CINVESTAV), CDMX, México. 2 Departamento de Inmunología, UMF Facultad de Estudios Superiores-Iztacala. Universidad Nacional Autónoma de México. Av. de los Barrios 1, Los Reyes Iztacala, Tlalnepantla, Estado de México, México. *Correspondencia: lcedillo@cinvestav.mx