La dualidad del oxígeno en la enfermedad sagrada
La epilepsia, la enfermedad sagrada, es tan antigua como la humanidad. Los babilonios decían que, como muchas otras, esta enfermedad se presentaba como un castigo por desobedecer o transgredir las leyes de los dioses. También tiene registro en la Biblia, en el Libro de Marcos capítulo 9, versículos 14-29: “Maestro, te traje a mi hijo, que está poseído por un espíritu que le ha robado el habla. Cada vez que lo agarra, lo tira al suelo, echa espuma por la boca, rechina los dientes y se pone rígido. Pedí a tus discípulos que expulsaran el espíritu, pero no pudieron”. Para el caso de nuestros antepasados mayas la epilepsia se debía a la magia y se adquiría de adulto. Por último, los mexicas la llamaron yolpapatzimiquilitzy (fuerte opresión en el corazón), cuando se manifestaba como desmayos. La palabra epilepsia se deriva del verbo griego epilambanein (επιλαμϖανειν), que significa “ser agarrado o atacado”.
En la actualidad, la Organización Mundial de la Salud (OMS) menciona que en el mundo hay alrededor de 50 millones de personas con epilepsia. Otra institución es la International League Against Epilepsy (Liga Internacional Contra la Epilepsia), que se encarga, junto con otros grupos de trabajo, de dar una definición operativa de la epilepsia, además, de difundir investigaciones y nuevos tratamientos con la finalidad de dar un apoyo al diagnóstico clínico. Su más reciente actualización fue en 2017 cuando se renovó la clasificación de 1981 (Fisher et al., 2017). La característica principal de la epilepsia son las crisis convulsivas que pueden variar en severidad; van desde pérdida de conciencia por un breve periodo (ausencia), a movimientos bruscos de las extremidades, tronco y cabeza (tónico clónico). De manera general las crisis convulsivas se pueden dividir en: 1) focales (se involucra un hemisferio cerebral), 2) generalizadas (comprende ambos hemisferios cerebrales) y 3) de tipo desconocido. El inicio de la epilepsia se vincula con un desequilibrio excitatorio (sistema glutamatérgico, que abarca al glutamato) e inhibitorio (sistema GABAérgico, que incluye al ácido gamma aminobutírico), inclinándose a una hiperexcitación cerebral. Imaginemos que somos como una balanza; para tener un buen funcionamiento debe de existir una igualdad en ambas partes para mantener sano nuestro organismo, sin embargo, cuando existe inestabilidad en cualquiera de los lados, impacta directamente en la salud de nuestro sistema. Cada vez que se presenta una crisis convulsiva, se genera una importante carga física y química, incrementando la necesidad de la oxigenación cerebral, en el que se encuentra una gran cantidad de lípidos y requiere de gran cantidad de oxígeno, por lo que es muy susceptible a la oxidación. Para poder vivir se necesita la oxigenación, sin embargo, existe una dualidad, ya que este mismo también, oxida, por lo que se denomina estrés oxidativo, proceso ligado estrechamente con la epilepsia.
El estrés oxidativo es un desequilibrio entre la producción y la eliminación de radicales libres (moléculas inestables), llamadas especies reactivas de oxígeno (ERO) y de nitrógeno (ERN). La excitación neuronal descontrolada proveniente de las convulsiones ocasiona un aumento de ERO, debido a que los electrones no apareados (Figura 1) que escapan de la cadena de transporte de electrones (respiración celular) ubicada en la membrana de la mitocondria de las células, reaccionan con el oxígeno molecular (O2), generando así, una molécula llamada superóxido, que contribuye al daño cerebral (Méndez-Armenta et al., 2014).
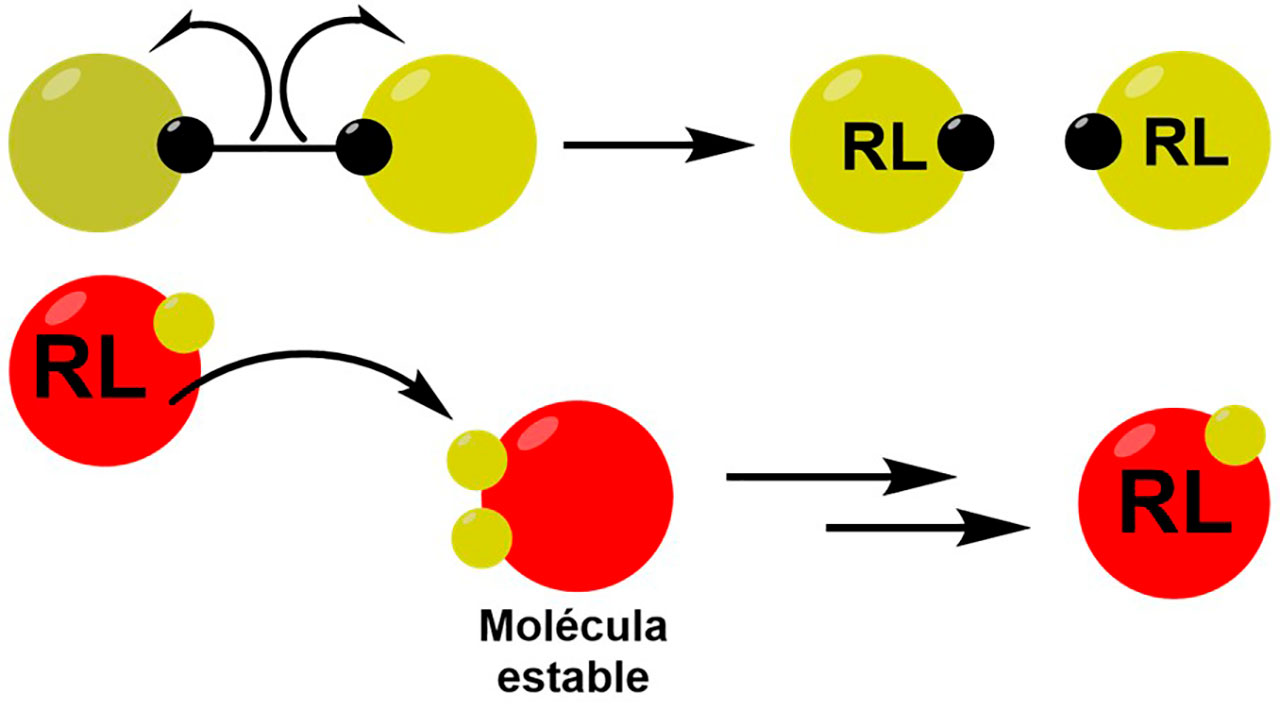
Los radicales libres generados son especies altamente inestables y reactivas, que inician una reacción en cadena al extraer electrones de los fragmentos moleculares cercanos para formar enlaces estables. Como resultado, las proteínas y los lípidos cambian su forma, llegando incluso a perder funciones y en ocasiones, a destruirse (Figura 2). En detalle, la producción de convulsiones es un momento de alteraciones neuronales muy intensas, que incluyen la producción excesiva de ERO y ERN, además de promover a mediadores proinflamatorios, neurodegeneración y daño a la barrera hematoencefálica (astrocitos). Las ERO mitocondriales están implicadas en múltiples procesos biológicos que incluyen daño del ADN, mitofagia (degradación de la mitocondria), apoptosis (muerte celular programada), inflamación y peroxidación lipídica (degeneración de lípidos, Yang et al., 2020).
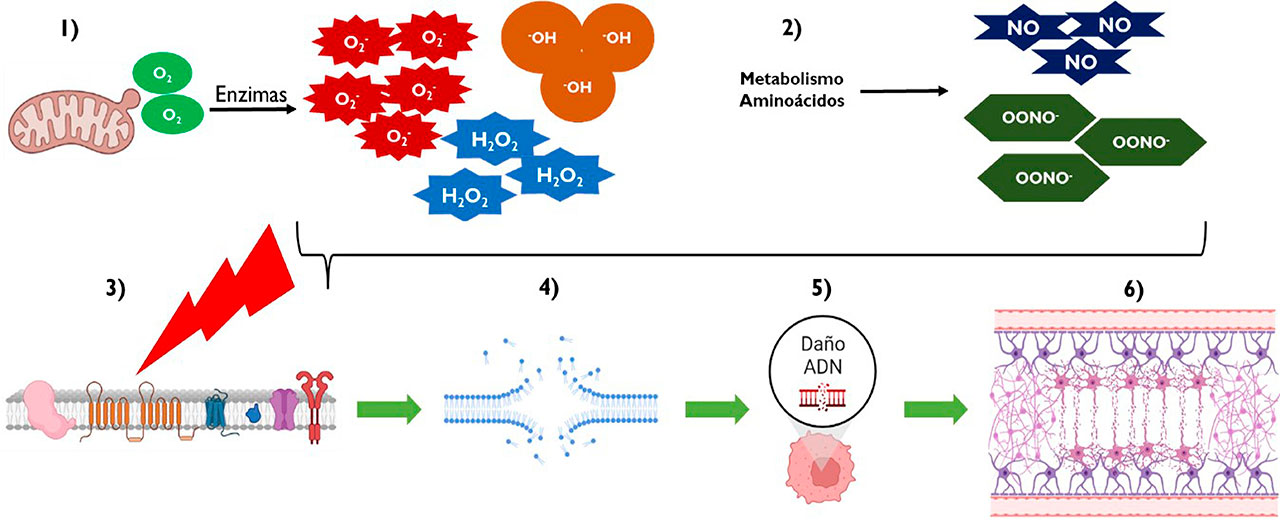
Por otra parte, la liberación excesiva del glutamato conduce a repetidos ciclos de despolarización-repolarización en las terminales de glutamato. Como consecuencia, se produce la degeneración de las neuronas postsinápticas por el aumento de la entrada de calcio, principalmente a través de la activación del receptor NMDA (N-metíl-D-aspartato). Los astrocitos normalmente toman el glutamato liberado de las sinapsis y lo convierten rápidamente en glutamina, un aminoácido que no afecta a la conductividad eléctrica, mediante una enzima llamada glutamina sintasa (GS). Esta enzima es fundamental, pero en astrocitos epileptogénicos en una estructura del cerebro llamada hipocampo, se ve disminuida la expresión de GS; además, la actividad enzimática se inhibe directamente por la generación de ERO inducida por las convulsiones.
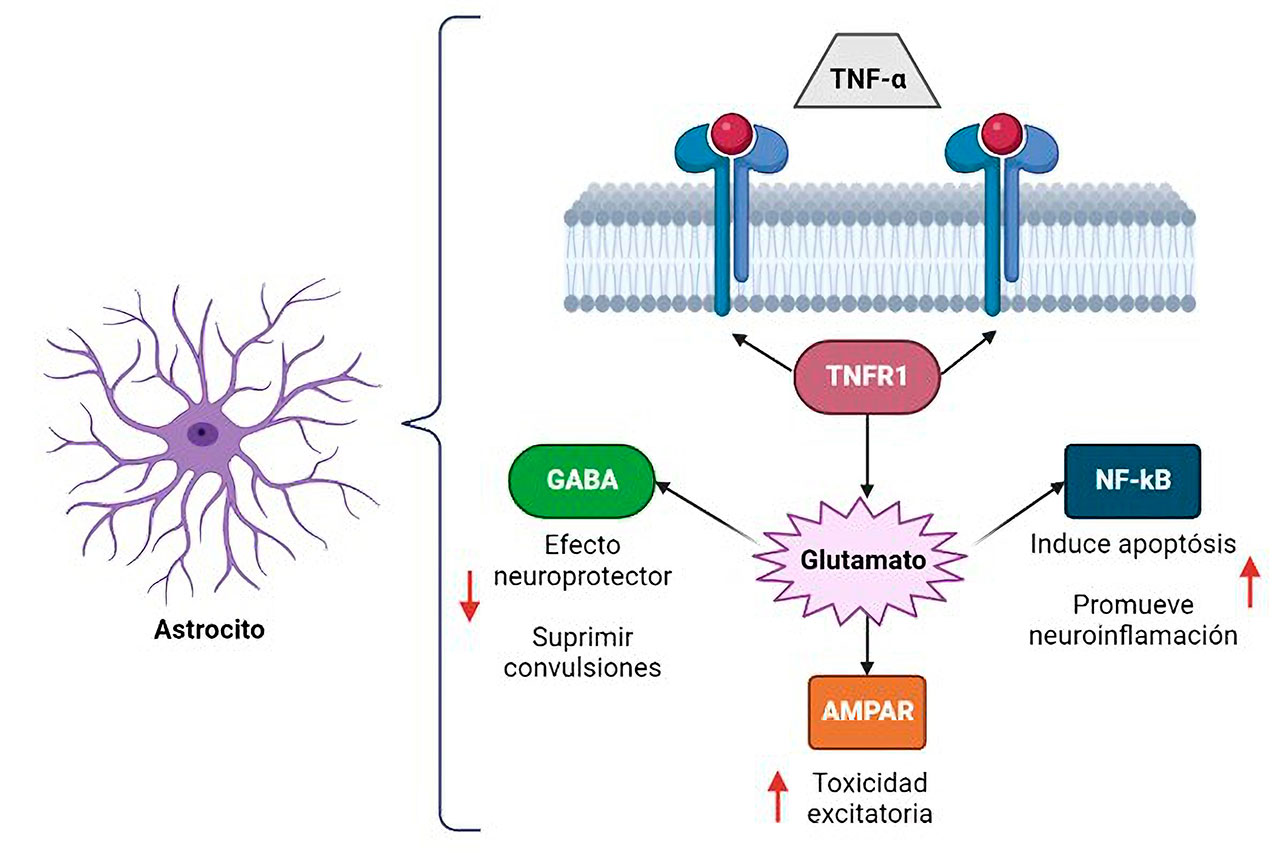
La exposición repetida al estrés agudo (convulsiones) es un factor que activa a la microglia (sistema inmunológico del cerebro) y el reclutamiento de monocitos periféricos al sistema nervioso central (SNC), mediante la expresión de mediadores inflamatorios, como las interleucinas IL-1α, IL-1β, IL-6, IL-10, el factor de necrosis tumoral-α (TNF-α) y el interferón gamma (IFN-γ) son inducidos por la actividad convulsiva en los astrocitos y la microglía, lo que origina múltiples procesos inflamatorios. Estas proteínas funcionan como mensajeros y llaman a los glóbulos blancos, desencadenando el proceso de inflamación crónica. Es de especial atención que el TNF-α en condiciones fisiológicas, facilita la proliferación celular, interviene en procesos cognitivos y controla el equilibrio iónico. Pero cuando el TNF-α se une al receptor TNFR1, aumenta la liberación de glutamato, lo que deriva en un aumento de la transmisión sináptica. Adicionalmente activa a una variedad de proteínas que envían señales que afectan el crecimiento celular y conducen a la muerte celular e inflamación a través de la vía de señalización del factor nuclear potenciador de las cadenas ligeras kappa de las células B activadas (NF-κB), el cual es un complejo proteico que controla la transcripción del ADN, es decir, induce la expresión de los genes que causan muerte celular. El NF-κB actúa como punto clave de convergencia para múltiples señales de estrés, incluidas las citocinas proinflamatorias y el estrés oxidativo, causando un círculo vicioso entre la epilepsia y el estrés oxidativo (Figura 3).
El organismo responde al estímulo estresante mediante los astrocitos, activados por el factor nuclear 2 regulado por eritroides (Nrf2, un factor de transcripción), induciendo la producción de enzimas antioxidantes, como superóxido dismutasa (SOD), catalasa (CAT) y glutatión peroxidasa (GPx) (Borowicz-Reutt y Czuczwar, 2020; Hannan et al., 2020). La actividad de la CAT o la GPx, es diez veces menor en el cerebro. En consecuencia, los radicales libres producidos pueden oxidar y afectar la función de neurotransmisores, como la serotonina, la dopamina o la noradrenalina y dañar las membranas neuronales, ricas en ácidos grasos, convirtiéndose en un blanco ideal para la peroxidación de lípidos, lo que resulta en una disminución de la fluidez de la membrana y una alteración en su función transportadora.
Los principales antioxidantes enzimáticos que el organismo produce son:
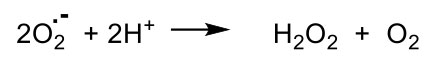
La SOD (superóxido dismutasa) cataliza la conversión de superóxido en peróxido de hidrógeno y oxígeno molecular:
La SOD de Cobre-Zinc (CuZnSOD) actúa en el citoplasma y los peroxisomas, mientras que la forma de Manganeso (MnSOD) lo hace en las mitocondrias.
La CAT descompone el peróxido de hidrógeno en oxígeno molecular y agua:
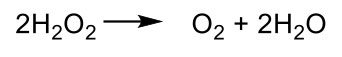
La CAT no elimina los radicales libres, pero protege la conversión de peróxido de hidrógeno en radical de hidrógeno.
La GPx, cataliza reacciones entre hidroperóxidos y GSH a glutatión oxidado (GSSG) y agua:

La GPx se encuentra en el citoplasma, las membranas celulares y en el exterior de la célula (Borowicz-Reutt y Czuczwar, 2020).
Para finalizar, la evidencia de estudios experimentales y clínicos apoya la hipótesis de que el estrés oxidativo está involucrado en la patogénesis de la epilepsia, además, los antioxidantes o fármacos que son captadores de radicales libres o que tienen propiedades protectoras redox, pueden reducir la actividad convulsiva y el daño neuronal. Hoy existen en el mercado fármacos antiepilépticos que poseen efectos neuroprotectores y son captadores de radicales libres, por ejemplo: diazepam, carbamazepina, ácido valproico, fenitoína, lamotrigina, levetiracetam y topiramato (Geronzi et al., 2018; Miziak et al., 2020). El estrés oxidativo puede explicar el mayor riesgo que tienen los pacientes con epilepsia de desarrollar afecciones psiquiátricas, como la depresión. Este ambiente excepcionalmente dañino producido por la combinación de estrés y actividad convulsiva sugiere la necesidad de nuevos tratamientos anticonvulsivantes para el manejo de la epilepsia y el estrés oxidativo.
Referencias
Fisher, R. S., Cross, J. H., D’Souza, C., French, J. A., Haut, S. R., Higurashi, N., Hirsch, E., Jansen, F. E., Lagae, L., Moshé, S. L., Peltola, J., Roulet Perez, E., Scheffer, I. E., Schulze-Bonhage, A., Somerville, E., Sperling, M., Yacubian, E. M., & Zuberi, S. M. (2017). Instruction manual for the ILAE 2017 operational classification of seizure types. Epilepsia, 58(4), 531–542. https://doi.org/10.1111/epi.13671
Borowicz-Reutt, K. K., & Czuczwar, S. J. (2020). Role of oxidative stress in epileptogenesis and potential implications for therapy. Pharmacological Reports, 72(5), 1218–1226. https://doi.org/10.1007/s43440-020-00143-w
Hannan, M. A., Dash, R., Sohag, A. A. M., Haque, M. N., & Moon, I. S. (2020). Neuroprotection Against Oxidative Stress: Phytochemicals Targeting TrkB Signaling and the Nrf2-ARE Antioxidant System. Frontiers in Molecular Neuroscience, 13(July). https://doi.org/10.3389/fnmol.2020.00116
Yang, N., Guan, Q. W., Chen, F. H., Xia, Q. X., Yin, X. X., Zhou, H. H., & Mao, X. Y. (2020). Antioxidants targeting mitochondrial oxidative stress: Promising neuroprotectants for epilepsy. Oxidative Medicine and Cellular Longevity, 2020, 1–14. https://doi.org/10.1155/2020/6687185
Méndez-Armenta, M., Nava-Ruíz, C., Juárez-Rebollar, D., Rodríguez-Martínez, E., & Yescas Gómez, P. (2014). Oxidative stress associated with neuronal apoptosis in experimental models of epilepsy. Oxidative Medicine and Cellular Longevity, 2014. https://doi.org/10.1155/2014/293689
Geronzi, U., Lotti, F., & Grosso, S. (2018). Oxidative stress in epilepsy. Expert Review of Neurotherapeutics, 18(5), 427–434. https://doi.org/10.1080/14737175.2018.1465410
Miziak, B., Konarzewska, A., Ułamek-Kozioł, M., Dudra-Jastrzębska, M., Pluta, R., & Czuczwar, S. J. (2020). Anti-epileptogenic effects of antiepileptic drugs. International Journal of Molecular Sciences, 21(7), 1–16. https://doi.org/10.3390/ijms21072340