Las alteraciones del epigenoma espermático: villanas en la toxicología generacional
La toxicología como una herramienta en la evaluación del riesgo a la salud
El incremento de elementos o compuestos tóxicos en el ambiente, también llamados xenobióticos, es la respuesta a las actividades antropogénicas derivadas de los sectores industrial, agrícola, minero, salud, y actividades domésticas. Lo anterior derivado del manejo inadecuado o eliminación de los compuestos utilizados en estas actividades, lo que provoca la liberación y acumulación de los mismos en el ambiente. Algunos ejemplos de estos xenobióticos son los plaguicidas, los metales y el material particulado, entre otros, los cuales son considerados como potencialmente tóxicos para la salud de los ecosistemas y todos los seres vivos, incluyendo el ser humano.
Una de las ciencias multidisciplinarias que ha ganado relevancia por su papel en la evaluación del riesgo a la salud por la exposición a xenobióticos, es la toxicología, la cual nos ayuda a entender y explicar los efectos adversos que ocasiona la exposición a compuestos tóxicos en los diferentes sistemas biológicos, mediante estudios en modelos in vivo, in vitro, in silico y en poblaciones. Los estudios toxicológicos han ayudado a determinar el riesgo a la salud de los seres humanos expuestos a un xenobiótico de interés o mezcla de ellos, y así han contribuido para que los tomadores de decisiones establezcan políticas en materia de salud pública, por ejemplo: sugerir medidas preventivas en áreas muy contaminadas, disponer el manejo adecuado o prohibición de alguna sustancia química, establecer valores de referencia, e informar a la población de los daños que provocan.
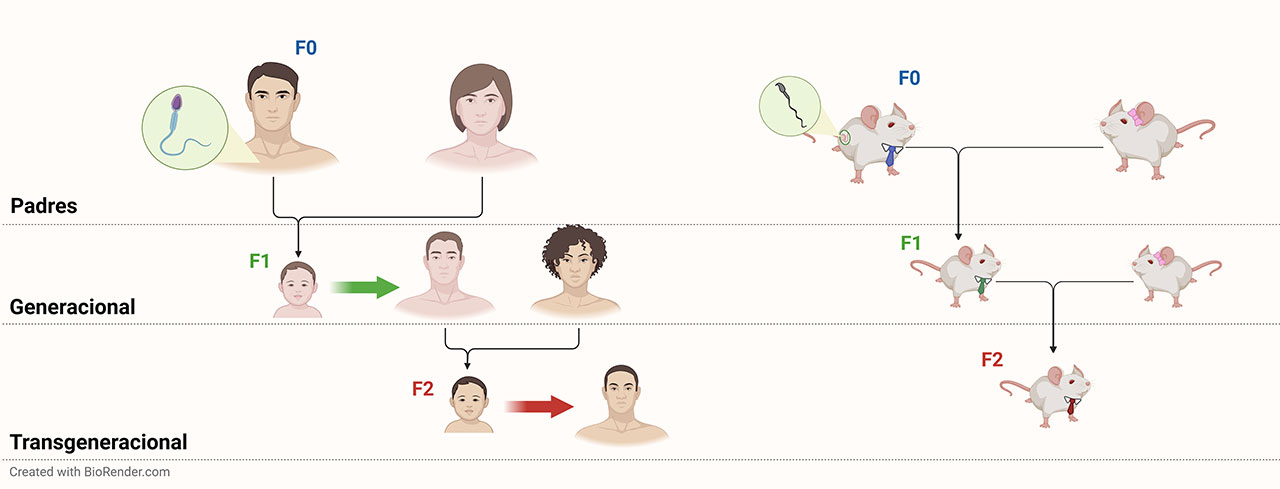
En sus inicios, la toxicología se enfocó principalmente en aquellos individuos directamente expuestos; en la actualidad, es de interés y preocupación que dichos efectos no solo se presentan en los individuos directamente expuestos, sino que pueden afectar a las generaciones futuras. Aquellos efectos provocados por la exposición paterna – el varón- que perjudica a la siguiente generación (hijos, expuestos como gametos masculinos), se conocen como efecto generacional, mientras que los efectos transgeneracionales involucran una segunda generación que no estuvo expuesta al xenobiótico (nietos, libre de exposición) (Figura 1). Así, el enfoque de las investigaciones en los efectos generacionales ha tomado relevancia en años recientes, por lo que ha surgido un nuevo campo conocido como “toxicología generacional” que se encarga de estudiar la capacidad de algunos xenobióticos de promover la herencia generacional y transgeneracional de enfermedades. Es aquí donde la epigenética juega un papel relevante.
Epigenética: mediador de los efectos generacionales y transgeneracionales
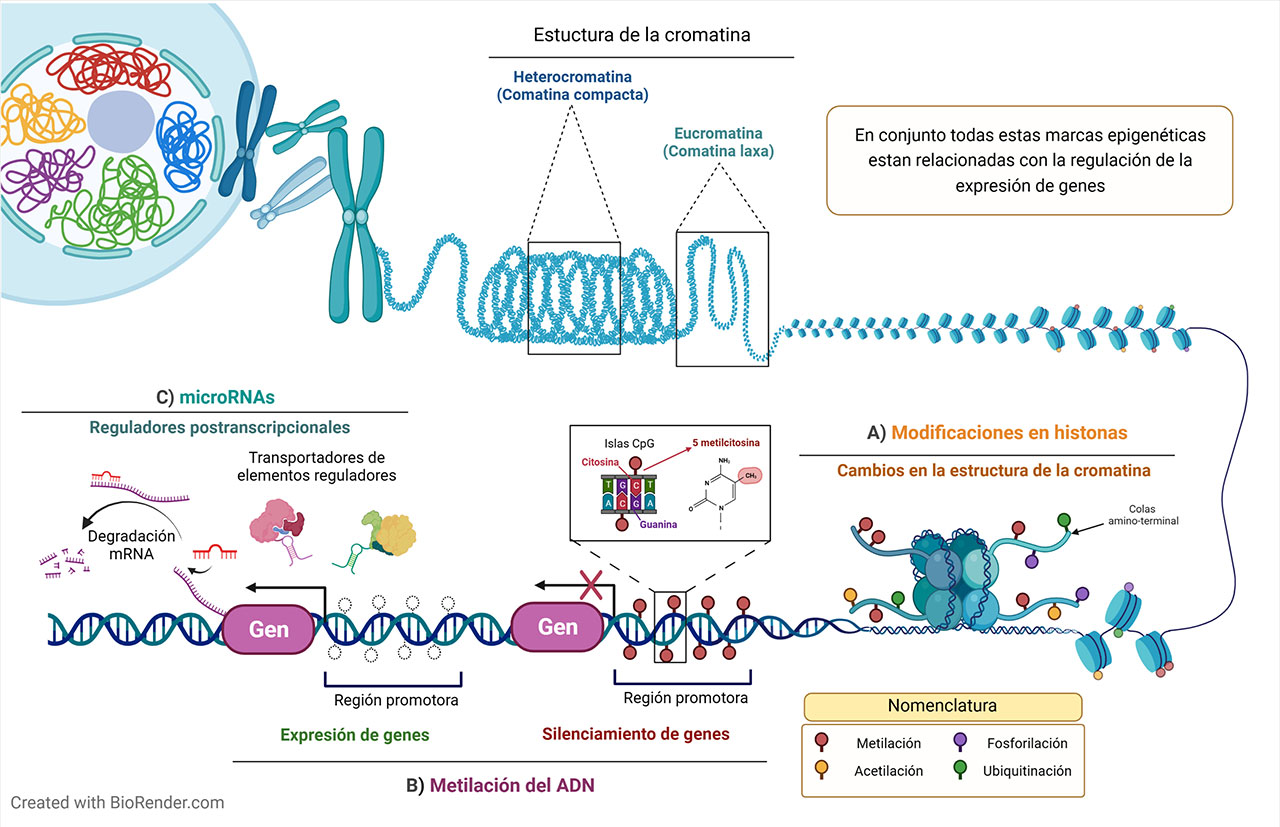
La epigénetica es la ciencia que estudia la expresión de genes en función de la relación gen-ambiente, sin que se presente un cambio en la secuencia del ADN, es decir, se afecta el fenotipo (aquellos cambios observables, por ejemplo, el color de ojos, tipo de sangre, presencia o ausencia de una enfermedad) sin alterar el genotipo (material genético). Entre los mecanismos epigenéticos más estudiados se encuentran: i) la metilación del ADN, que consiste en la transferencia de un grupo metilo (CH3) a residuos de citosina, regulando la expresión de genes, ii) las modificaciones en histonas, entre ellas la acetilación, fosforilación y metilación de los residuos amino-terminal, lo cual provoca cambios en la estructura de la cromatina, y iii) microRNAs, que actúan como reguladores postranscripcionales (Figura 2) (Nilsson et al., 2022).
En conjunto, todas estas marcas son esenciales para la regulación de la expresión de genes y son únicas en cada tipo celular (células sanguíneas, hepáticas, neuronales, renales, gametos), así como para la diferenciación celular, es decir, pasar de una célula madre a una célula con función muy particular, como un linfocito. Estas marcas epigenéticas no están libres de sufrir modificaciones por acción de un xenobiótico, en particular, la alteración en la firma epigenética (epigenoma) en ovocitos o espermatozoides (células sexuales que al unirse permiten la formación de un ser vivo) podría afectar a las generaciones subsecuentes. La fecundación con espermatozoides u ovocitos con epigenoma alterado puede conducir al establecimiento inadecuado del epigenoma en el embrión, ocasionando su muerte, alteración en la expresión de genes, defectos de nacimiento o predisposición a enfermedades en una etapa avanzada de la vida (Nilsson et al., 2022).
Las villanas en la toxicología generacional
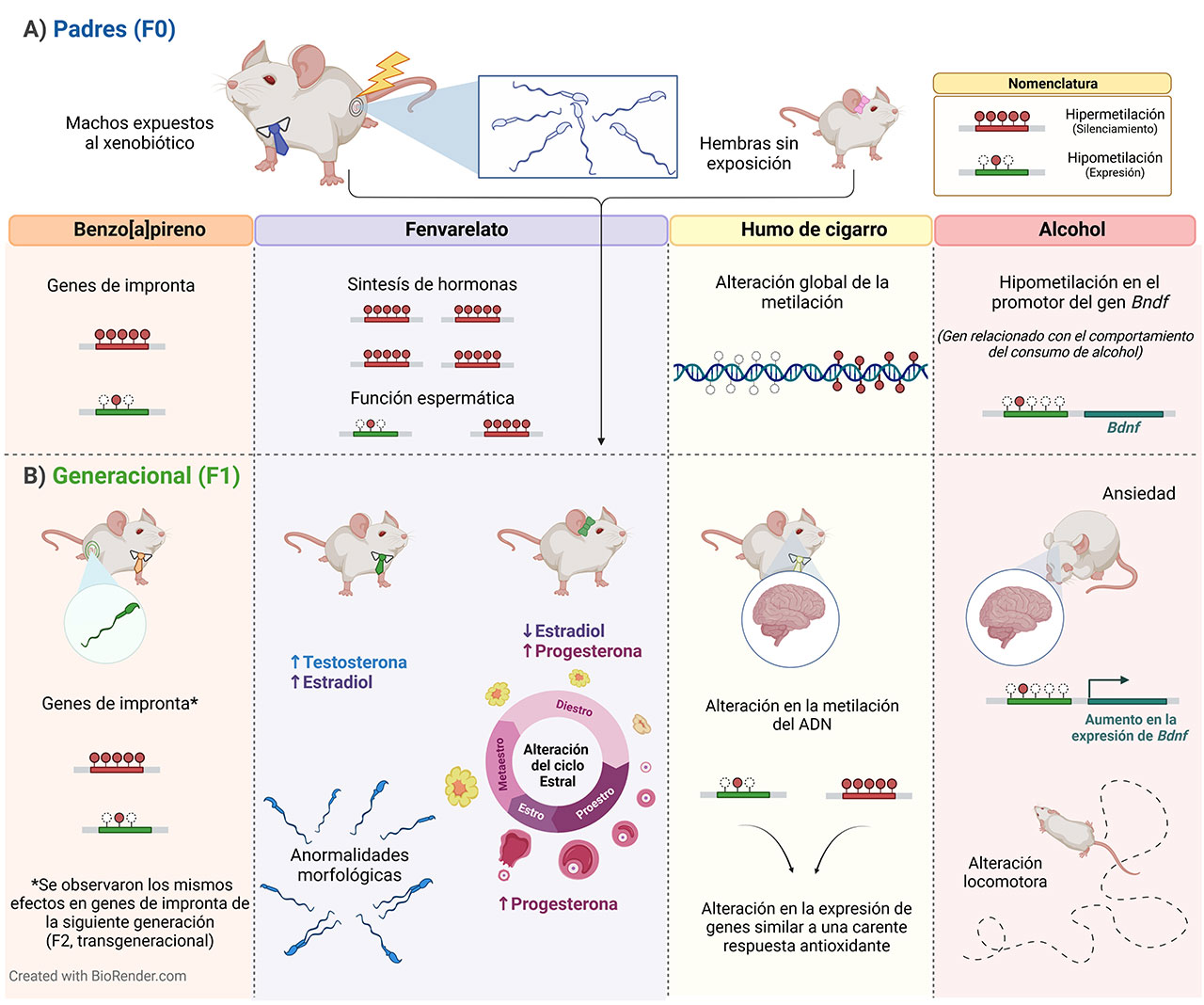
Para dilucidar cómo es que el daño causado en un individuo puede afectar el desarrollo de otro ser, se han realizado estudios generacionales aplicando modelos murinos expuestos a distintos xenobióticos. Estos efectos generacionales pueden ocurrir por la exposición paterna (espermatozoide), materna (ovocitos) o durante la gestación. Sin embargo, no se ha dado la suficiente importancia a la exposición paterna antes de la concepción y cómo ésta afecta a su descendencia. Por lo tanto, es de nuestro interés dar a conocer los efectos de la exposición paterna, y en específico, cómo es que las alteraciones del epigenoma espermático (villanas) pueden afectar a una o más generaciones (Figura 3). A continuación, se presentan algunos ejemplos de estas modificaciones epigenéticas, principalmente metilación del ADN, modificación más estudiada, en los espermatozoides y sus efectos en las siguientes generaciones.
Se ha reportado que la combustión de leña y derivados del petróleo y el consumo de alimentos quemados o asados al carbón, por ejemplo, carnes, originan subproductos como el benzo[a]pireno que es un hidrocarburo aromático policíclico clasificado como carcinógeno para los humanos (grupo 1) por la Agencia Internacional para la Investigación del Cáncer (IARC, por sus siglas en inglés). Este hidrocarburo tiene efectos negativos durante la gestación, originando alteraciones neurológicas y en medidas antropométricas en recién nacidos (peso, talla y perímetros corporales). También se ha visto que causa alteración en la metilación de genes de la impronta (genes que se expresan dependiendo del sexo), en los espermatozoides de ratones expuestos (generación F0), efecto que también se observó en los espermatozoides de las subsecuentes generaciones de los roedores (generaciones F1 y F2) (Zhang et al., 2019).
Otro grupo de compuestos tóxicos ampliamente utilizados en la agricultura y para el control de plagas, son los plaguicidas, por ejemplo, el fenvalerato, insecticida piretroide considerado como moderadamente tóxico por la Organización Mundial de la Salud (OMS), que ocasiona daños en la reproducción masculina (calidad y función espermáticas). Se ha descrito que causa alteración en la metilación de genes involucrados con la función espermática y síntesis de hormonas en los espermatozoides de los roedores expuestos al insecticida (generación F0) que posteriormente se reflejó en las crías (generación F1), alterando los niveles de las hormonas testosterona y estrógeno (en machos) y estradiol y progesterona (en hembras). Adicionalmente, en las crías macho se observó una mala calidad espermática, y en las hembras, alteraciones en el ciclo estral (Xia et al., 2013).
Otro ejemplo es el tabaquismo, problema que perjudica la salud de un gran número de personas, afectando tanto al fumador como a los fumadores pasivos (personas expuestas de forma indirecta al humo del cigarro por convivir con fumadores). En el humo del cigarro están presentes más de 100 compuestos tóxicos como los hidrocarburos aromáticos policíclicos, benceno, formaldehído y metales pesados. Algunos padecimientos con los que se asocia la exposición al humo del cigarro son enfermedades respiratorias, cardiovasculares, cáncer y alteraciones reproductivas. También se ha observado que provoca alteración en la metilación del ADN espermático de los padres expuestos (generación F0), mientras que en las crías macho (generación F1) se detectaron alteraciones en la metilación del ADN en el cerebro, asociadas con cambios en la expresión de genes, efecto similar a cuando no hay una adecuada respuesta antioxidante (Murphy et al., 2020).
El alcoholismo es otro problema de salud que genera enfermedades crónicas como cirrosis, cáncer y deterioro de la salud mental, además de considerarse un problema hereditario. Se ha revelado una hipometilación (metilación baja) del gen Bndf (factor neurotrófico derivado del cerebro, regulador del comportamiento del consumo del alcohol) en espermatozoides de padres expuestos al alcohol (generación F0). De igual manera se observó una hipometilación y aumento en la expresión del gen Bndf en el cerebro de sus crías (generación F1), que se reflejó en un comportamiento ansioso y alteración motora. (Finegersh & Homanics, 2014).
En resumen, queremos resaltar la importancia de la toxicología generacional al evaluar los efectos negativos heredados a las generaciones futuras por estar expuestas indirectamente (a través de los padres) e incluso sin ningún tipo de exposición (efecto transgeneracional en los nietos), así como el papel que juegan las alteraciones epigenéticas en las células germinales, en este caso en los espermatozoides, en los trastornos causados en la descendencia. Hasta el momento, la evidencia en modelos animales marca una pauta y una alerta del alcance que estas villanas pueden tener en la salud de los individuos y en aquellos por nacer. La metilación del ADN es la modificación epigenética más estudiada; su interpretación es aún compleja y su análisis costoso y aún falta realizar más investigaciones, incluyendo otras marcas epigenéticas como las modificaciones en histonas y microRNAs, y de ser posible, confirmarlas con estudios poblacionales.
Referencias
Finegersh, A., & Homanics, G. E. (2014). Paternal Alcohol Exposure Reduces Alcohol Drinking and Increases Behavioral Sensitivity to Alcohol Selectively in Male Offspring. PLoS ONE, 9(6), e99078. https://doi.org/10.1371/journal.pone.0099078
Murphy, P. J., Guo, J., Jenkins, T. G., James, E. R., Hoidal, J. R., Huecksteadt, T., Broberg, D. S., Hotaling, J. M., Alonso, D. F., Carrell, D. T., Cairns, B. R., & Aston, K. I. (2020). NRF2 loss recapitulates heritable impacts of paternal cigarette smoke exposure. PLOS Genetics, 16(6), e1008756. https://doi.org/10.1371/journal.pgen.1008756
Nilsson, E. E., Ben Maamar, M., & Skinner, M. K. (2022). Role of epigenetic transgenerational inheritance in generational toxicology. Environmental Epigenetics, 8(1), dvac001. https://doi.org/10.1093/eep/dvac001
Xia, D., Parvizi, N., Zhou, Y., Xu, K., Jiang, H., Li, R., Hang, Y., & Lu, Y. (2013). Paternal Fenvalerate Exposure Influences Reproductive Functions in the Offspring. Reproductive Sciences, 20(11), 1308-1315. https://doi.org/10.1177/1933719113483015
Zhang, W., Yang, J., Lv, Y., Li, S., & Qiang, M. (2019). Paternal benzo[a]pyrene exposure alters the sperm DNA methylation levels of imprinting genes in F0 generation mice and their unexposed F1-2 male offspring. Chemosphere, 228, 586-594. https://doi.org/10.1016/j.chemosphere.2019.04.092