Las microalgas intensifican la producción de camarón blanco
“Las microalgas locales son una alternativa de alimento para el cultivo de camarón blanco cuando se trata de reducir costos de producción y de mitigar el impacto al medio ambiente”
Producción de camarón en Zonas Áridas Costeras
La producción de alimentos para consumo humano en el Estado de Baja California Sur es difícil en comparación con otras regiones de México debido a las lluvias escasas durante todo el año. Esto afecta a la agricultura y a la ganadería, por lo que una de las alternativas para la obtención de alimentos es la pesca de peces, moluscos y crustáceos. El camarón blanco Penaeus vannamei es uno de los alimentos que actualmente tienen mayor demanda en México y en el mundo. Sin embargo, el incremento en la captura de este crustáceo en el pacífico mexicano ha provocado la reducción de las tallas obtenidas por pesca, afectando el rendimiento sostenible del recurso. La acuacultura ha contribuído a atender la demanda y en los últimos años ha aumentado su producción a través de cultivos con mayores densidades de organismos por m3, lo que produce desechos como amonio, entre otros, el cual afecta el crecimiento de los camarones, pudiendo ocasionar su muerte (Valencia-Castañeda et al., 2019; Luo y Meng, 2020). Para evitar este problema se realizan cambios de agua continuamente ocasionando más costos y aumentando la contaminación ambiental. Aunado a esto, las altas temperaturas en esta zona árida disminuyen la concentración de oxígeno en el agua, lo que junto con el amonio producido, da lugar a una mala calidad del agua que genera estrés a los organismos en cultivo, afectando el rendimiento. La producción intensiva de camarón en las condiciones descritas es limitada y ha hecho que se opte por sistemas tradicionales con bajas o medianas densidades.
Por otra parte, los cultivos hiperintensivos producen en poco espacio hasta 400 camarones por m3 o más, con poco o nulo recambio de agua, empleando una biotecnología biofloc. Ésta es recomendada por la calidad nutricional de los flocs (flóculos integrados por bacterias y fitoplancton), que son un complemento alimenticio para el camarón al contener una gran diversidad de microrganismos (Kaya et al., 2020).

La tecnología del Biofloc
Los sistemas Biofloc son un tipo único de recirculación acuícola (RAS, por sus siglas en inglés) que mantienen suspendida una comunidad de microalgas, bacterias autótrofas y heterótrofas (Khanjani et al., 2022), que comúnmente se desarrollan en estos sistemas de intercambio limitado en tanque, siendo los más empleados los de geomembrana (Figura 2). La tecnología Biofloc es considerada un método sostenible en camaronicultura ya que el floc se utiliza como fuente de alimento. Esta tecnología consiste en generar flocs, agregando al agua fuentes de carbono, como harina de trigo, maíz, arroz, melaza, entre otras (Serra et al., 2015). Estos ingredientes son conocidos como floculantes que ayudan a la formación de flocs, donde crecen y se mantienen microalgas y bacterias que llevan a cabo la foto asimilación autotrófica y la conversión de NH3 en NO2– y NO3–. Además, las bacterias heterótrofas utilizan las fuentes potenciales de nitrógeno (materia orgánica) para convertirlas en biomasa microbiana, realizan la limpieza del agua y contribuyen en la trasformación de desechos tóxicos como el amonio (Flores-Valenzuela et al., 2021; Xu et al., 2020). Los microorganismos mencionados están disponibles al inicio de la cadena trófica y sirven como alimento para otro tipo de microorganismos como flagelados, ciliados, nemátodos, rotíferos, entre otros (Figura 3). Todos ellos son alimento vivo para los camarones y aportan nutrientes como proteínas, lípidos y carbohidratos (Ponnusamy et al., 2023).

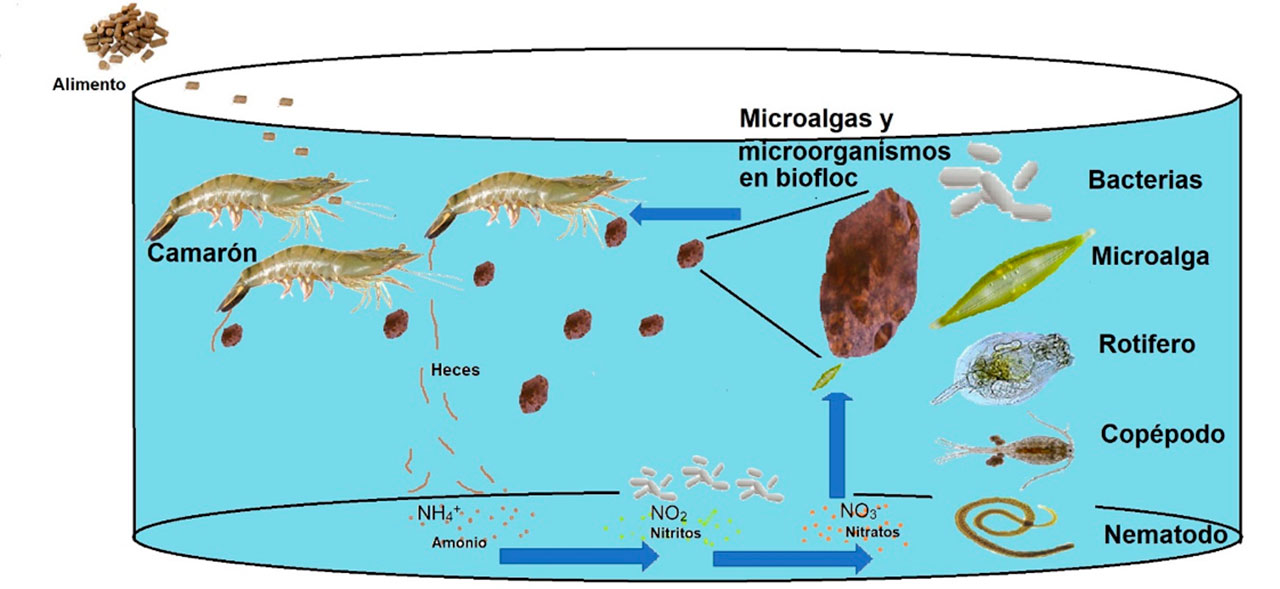
La importancia de emplear microalgas
El biofloc provee alimento reutilizando los desechos del camarón e incorporando una comunidad microbiana diversa (Wei y Wang, 2016). En particular, las microalgas contribuyen a mantener la calidad del agua en el cultivo gracias a que funcionan como biofiltros (Khan et al., 2021), con lo que se disminuye los recambios de agua o son nulos. Esto hace que el sistema sea considerado respetuoso con el medio ambiente. Los microrganismos que están casi al final de la cadena trófica dentro del biofloc pueden variar en su calidad nutricional por la influencia de las microalgas que consumen, las cuales tienen un papel importante en el aporte de proteínas, carbohidratos, lípidos y vitaminas esenciales. Es recomendable seleccionar las microalgas por ser la base de la cadena trófica en el biofloc, ya que dependiendo de la especie, aportan diferentes nutrientes y cantidades de éstos (Jiménez-Ordaz et al., 2021). Algunos de ellos son clorofila, beta carotenos, ácido alfa-linolénico (ALA), ácido eicosapentaenoico (EPA) y ácido docosahexaenoico (DHA) (ácidos grasos omega 3), ácido linoleico, γ-linolénico y araquidónico (ácidos grasos omega 6), esteroles y polisacáridos como alginato, almidón, significativos en una gran cantidad de actividades biológicas relevantes para la salud (Sun et al., 2014).
Las microalgas se encuentran en la naturaleza formando parte de sistemas marinos y de agua dulce, son microorganismos autótrofos y fotosintéticos e incluyen microorganismos procariotas y eucariotas. Los grupos de microalgas eucariotas son pirrofitas, crisófitas, euglenofitas, gamofitas y bacilariofitas; en este último grupo están las diatomeas, que pueden alcanzar hasta 5 milímetros de longitud, pueden ser de vida libre o colonial y sirven como alimento de organismos marinos. Las diatomeas, taxonómicamente se encuentran dentro del filo heterokontophyta y se dividen en dos órdenes: centrales y penales; las primeras con simetría radial y las segundas bilateralmente simétricas; estas células tienen membrana de pectina con una cubierta conocida como frústula de sílice, que puede presentar diferentes ornamentaciones. Las diatomeas se encuentran en todos los hábitats acuáticos; en los océanos son vitales porque proporcionan un 45% del total de la producción primaria para iniciar el flujo de energía en estos ecosistemas, además de que contribuyen al balance de oxígeno. Estas características dan a las diatomeas un perfil de requisitos para emplearlas en biotecnología acuícola (Mengstie, 2023). En el cultivo de camarón coadyuvan a mejorar el crecimiento y la resistencia a enfermedades porque proporcionan nutrientes, metabolitos bioactivos, hormonas, sustancias como ácidos grasos, ficobiliproteínas, polisacáridos, compuestos fenólicos y carotenos que fortalecen su sistema inmune con efectos terapéuticos y con aplicaciones anticancerígenas, antiinflamatorias, anticoagulantes, antivirales, antibacterianas y antifúngicas (Borowitzka, 2018; Rizwan et al., 2018; Ramana et al., 2017 y Basheer et al., 2020). Según González-Meza (2022), la adición de microalgas a cultivos de camarón ocasionan una estimulación del sistema inmunológico, generando actividad antimicrobiana y protegiendo contra la infección por V. parahaemolyticus que causa su muerte.
Las microalgas pueden ser cultivadas para obtener compuestos de alto valor, extractos o biomasas procesadas para producir biofertilizantes y biocombustibles; también se emplean vivas en procesos de biorremediación de aguas residuales, suelos y gases (Mengstie, 2023). Gracias a que se conocen sus diferentes tamaños se pueden recomendar como alimento para estadios larvarios de muchas especies de importancia acuícola.
Microalgas endémicas para la inducción del Biofloc en el cultivo de camarón
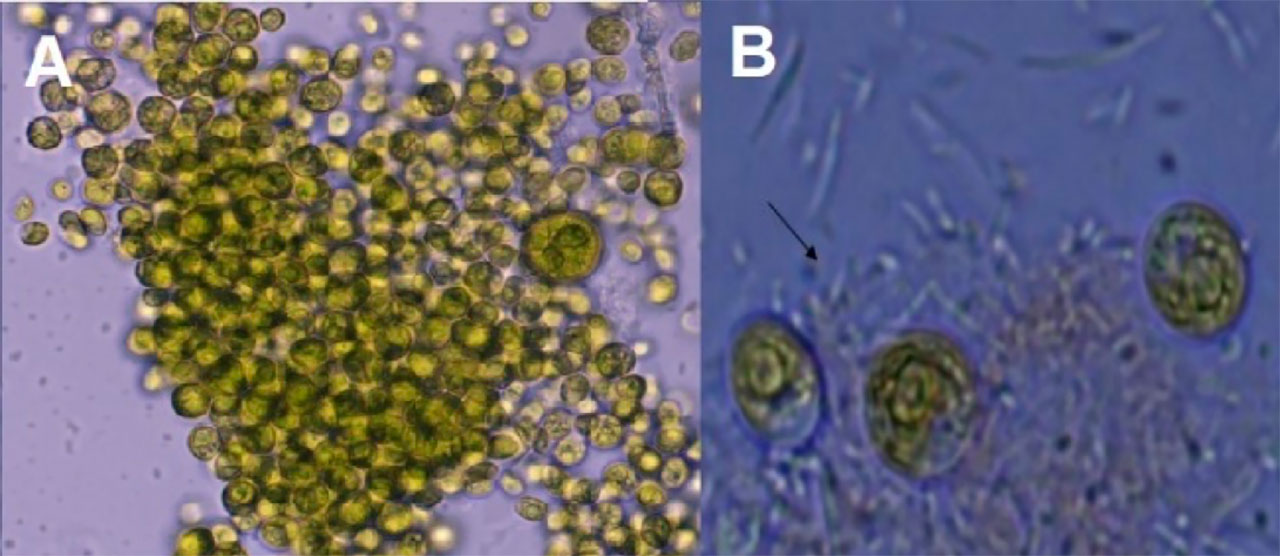
En su zona costera árida, Baja California Sur alberga microalgas adaptadas a las condiciones ambientales reinantes, por lo que se considera un recurso biológico valioso para emplearse en la acuacultura. Investigaciones recientes resaltan la utilidad de las microalgas para la inducción del biofloc de sistemas hiperintensivos en el cultivo de camarón (Pacheco-Vega et al., 2015; Jiménez-Ordaz et al., 2021). Para satisfacer la demanda de microalgas se requieren grandes volúmenes y para producirlas a gran escala es importante que se cultiven en condiciones ambientales. Actualmente cepas de microalgas aisladas de la Bahía de La Paz, que pertenecen a la Universidad Autónoma de Baja California Sur (UABCS), se cultivan en el exterior en volúmenes de 3000 L y se han incorporado al cultivo intensivo de camarón para la inducción de biofloc. Estas microalgas, al ser locales, no impactan el medio ambiente de esta zona árida costera. Asimismo, en la Unidad Pichilingue de la UABCS se determinó su contenido nutrimental y se evaluó la capacidad de diferentes especies para inducir el biofloc (Pacheco-Vega et al., 2015). Una cepa de microalga del género Schizochytrium sp. fue seleccionada para la generación de flóculos por su capacidad para crecer en co-cultivo con bacterias probióticas bajo condiciones ambientales, (Figura 4). Estas bacterias se recomiendan para emplearse en la acuacultura porque reducen las poblaciones de bacterias potencialmente patógenas y favorecen la absorción de nutrientes en el sistema digestivo del camarón.
En otra investigación, Jiménez-Ordaz et al. (2021) evaluaron dos diatomeas aisladas de la Bahía de La Paz y con antecedentes de alto valor nutritivo: Navicula sp. y Grammatophora sp.; esta última estimula el sistema inmune de ratones Balb/c. El estudio sugiere que el conjunto de microalgas que brinda las mejores cualidades nutricionales del biofloc contiene microalgas Schizochytrium sp., Navicula sp. y Grammatophora en co-cultivo con las bacterias probióticas; estos son los microrganismos propuestos como inductores de biofloc en un sistema hiperintensivo para el cultivo de camarón en esta zona árida costera (Figura 5). En esta investigación reciente se incorporaron estos microrganismos a cultivos de camarón con altas densidades, mostrando parámetros adecuados de producción y una excelente sobrevivencia. Los parámetros zootécnicos obtenidos en los cultivos hiperintensivos de 350 a 400 camarones por m3, indicaron que los camarones cultivados con el biofloc obtienen un buen rendimiento de producción y buena salud (Jiménez-Ordaz et al., 2021), lo que se confirmó con estudios de expresión de genes relacionados con el sistema inmune del camarón. Los camarones con dietas complementadas con flocs que contienen microalgas vivas y bacterias probióticas presentaron una activación adecuada del sistema inmune, lo cual indica que poseen mejores mecanismos de defensa para combatir bacterias, hongos o virus que dañen al organismo.
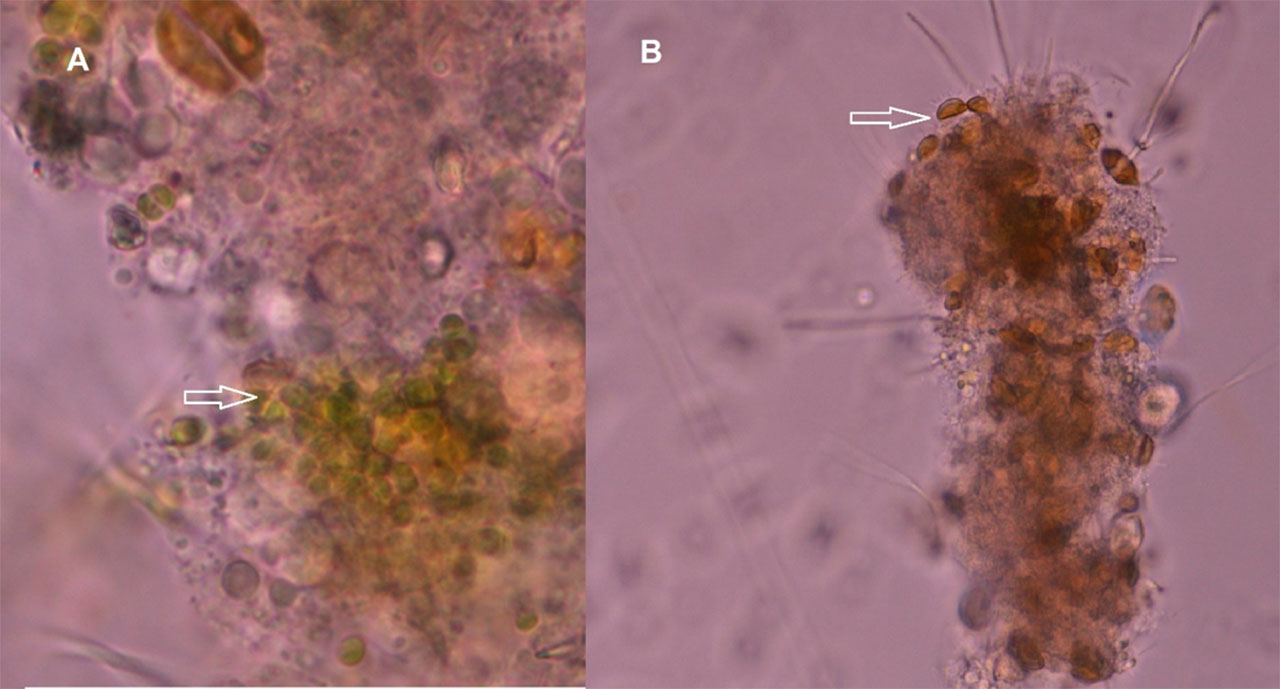
Como conclusión, la producción del camarón con los recursos locales es una alternativa para obtener alimento en esta zona costera árida. Inducir la formación del biofloc con el crecimiento de cepas de Schizochytrium sp., Navicula sp., Grammatophora sp. y bacterias probióticas locales previamente seleccionadas, mejora la calidad del agua proporcionando más oxígeno, beneficia al organismo cultivado mejorando la dieta y fortaleciendo su sistema inmune, lo cual influye en su crecimiento, salud y sobrevivencia. Todo esto permite que se alcancen los parámetros zootécnicos adecuados para el desempeño del cultivo que espera el acuicultor.
Bibliografía
- Basheer, Sajid & Huo, Shuhao & Zhu, Feifei & Qian, Jingya & Xu, Ling & Cui, Fengjie & Zou, Bin. (2020). Microalgae in Human Health and Medicine. DOI:10.1007/978-981-15-0169-2_5
- Borowitzka, M.A., 2018. Microalgae in medicine and human health: A historical perspective. Microalgae Health Dis. Prev. (pp. 195-210). Academic Press. DOI:10.1016/B978-0-12-811405-6.00009-8
- Flores-Valenzuela, E., Miranda-Baeza, A., Rivas-Vega, M. E., Miranda-Arizmendi, V., Beltrán-Ramírez, O., & Emerenciano, M. G. C. (2021). Water quality and productive response of Litopenaeus vannamei reared in biofloc with addition of commercial strains of nitrifying bacteria and Lactobacillus rhamnosus. Aquaculture, 542. https://doi.org/10.1016/j.aquaculture.2021.736869
- González-Meza, Georgia & Herrera-Castro, Karla & Casillas-Hernández, Ramón & Renteria, Ana & Gortáres-Moroyoqui, Pablo & Gil-Núñez, Juan & Ibarra-Gamez, Jose & Ulloa-Mercado, Gabriela. (2022). Dietary supplementation effect of three microalgae on Penaeus vannamei growth, biochemical composition, and resistance to Vibrio parahaemolyticus (AHPND). Latin American Journal of Aquatic Research. 50. 88-98. DOI: 10.3856/vol50-issue1-fulltext-2773.
- Jiménez-Ordaz, Francisco & Cadena-Roa, Marco & Pacheco-Vega, Juan & Rojas, Maurilia & Tovar-Ramı́rez, Dariel & Arce-Amezquita, Pablo. (2021). Microalgae and probiotic bacteria as biofloc inducers in a hyper-intensive Pacific white shrimp (Penaeus vannamei) culture. Latin American Journal of Aquatic Research. 49. 2021. DOI: 10.3856/vol49-issue1-fulltext-2442.
- Kaya, Doğukan & Genc, Ercument & Genc, M. Ayce & Aktaş, Mevlüt & Eroldogan, Tufan & Güroy, Derya. (2020). Biofloc technology in recirculating aquaculture system as a culture model for green tiger shrimp, Penaeus semisulcatus: Effects of different feeding rates and stocking densities. Aquaculture. 528. DOI: 10.1016/j.aquaculture.2020.735526.
- Khan, Mohd & Rai, Anshuman & Ahirwar, Ankesh & Sirotiya, Vandana & Mourya, Megha & Mishra, Sudhanshu & Schoefs, Benoît & Marchand, Justine & Bhatia, Shashi & Varjani, Sunita & Vinayak, Vandana. (2021). Diatom microalgae as smart nanocontainers for biosensing wastewater pollutants: Recent trends and innovations. Bioengineered. 12. DOI: 10.1080/21655979.2021.1996748.
- Khanjani, Mohammad Hossein & Mohammadi, Alireza & Emerenciano, Maurício. (2022). Microorganisms in biofloc aquaculture system. Aquaculture Reports. 26. DOI: 101300. 10.1016/j.aqrep.2022.101300.
- Luo, G., Xu, J., & Meng, H. (2020). Nitrate accumulation in biofloc aquaculture systems. Aquaculture. Elsevier B.V. https://doi.org/10.1016/j.aquaculture.2019.734675
- Mengstie, Kelemu. (2023). Review on Microalgae Potential Innovative Biotechnological Applications. Biosciences Biotechnology Research Asia. 20. https://www.researchgate.net/publication/369762113.
- Pacheco-Vega, Juan & Cadena, Marco & Ascencio, Felipe & Rangel-Dávalos, Carlos & Rojas, Maurilia. (2015). Assessment of endemic microalgae as potential food for Artemia franciscana culture. Latin american journal of aquatic research. 43. 23-32. DOI: 10.3856/vol43-issue1-fulltext-3.
- Ponnusamy, Ruby & Athithan, Saminathan & Ahilan, B. & Cbt, Rajagopalsamy & Sugumar, G. (2023). Influence of biofloc meal on the growth performance of pacific white shrimp, litopenaeus vannamei. Biochem. Cell. Arch. https://www.researchgate.net/publication/370155567
- Ramana, K., Xavier, J. and Sharma, R., (2017). Recent trends in pharmaceutical biotechnology. Pharm Biotechnol Curr Res. 1(1), p.5.
- Rizwan, M., Mujtaba, G., Memon, S.A., Lee, K. and Rashid, N., (2018). Exploring the potential of microalgae for new biotechnology applications and beyond: a review. Renewable Sustainable Energy Rev. 92, pp.394-404. 21.
- Serra, Fabiane & Gaona, Carlos & Furtado, Plínio & Poersch, Luís & Wasielesky, Wilson. (2015). Use of different carbon sources for the biofloc system adopted during the nursery and grow-out culture of Litopenaeus vannamei. Aquaculture International. 23. DOI: 10.1007/s10499-015-9887-6.
- Sun, Lina & Ren, Lujing & Zhuang, Xiaoyan & Ji, Xiao-Jun & Yan, Jiacheng & Huang, He. (2014). Differential effects of nutrient limitations on biochemical constituents and docosahexaenoic acid production of Schizochytrium sp. Bioresource Technology. 159. 199–206. DOI: 10.1016/j.biortech.2014.02.106.
- Valencia-Castañeda, G., Frías-Espericueta, M. G., Vanegas-Pérez, R. C., Chávez-Sánchez, M. C., & Páez-Osuna, F. (2019). Toxicity of ammonia, nitrite and nitrate to Litopenaeus vannamei juveniles in low-salinity water in single and ternary exposure experiments and their environmental implications. Environmental Toxicology and Pharmacology, 70. https://doi.org/10.1016/j.etap.2019.05.002
- Wei, Yan Fang & Liao, Shao-An & Wang, An-li. (2016). The effect of different carbon sources on the nutritional composition, microbial community and structure of bioflocs. Aquaculture. 465. DOI: 10.1016/j.aquaculture.2016.08.040.
- Xu, Wu-Jie & Xu, Yu & Su, Haochang & Hu, Xiaojuan & Xu, Yunna & Li, Zhuojia & Wen, Guoliang & Cao, Yucheng. (2020). Production performance, inorganic nitrogen control and bacterial community characteristics in a controlled biofloc-based system for indoor and outdoor super-intensive culture of Litopenaeus vannamei. Aquaculture. 531. 735749. DOI: 10.1016/j.aquaculture.2020.735749.