Nanotecnología aplicada a plantas y su toxicidad: óxido de titanio
En la actualidad, los desafíos de la producción alimentaria determinados por el incremento poblacional marcan la tendencia del futuro. En las próximas décadas la población mundial superará los ocho mil millones de habitantes, provocando una gran complejidad en el ramo alimentario. Por lo tanto, es necesario aumentar la producción de alimentos, disminuir las pérdidas de insumos y buscar la sostenibilidad ambiental, para lo que las tecnologías emergentes ofrecen soluciones innovadoras.
Un ejemplo es la nanotecnología, que de acuerdo con la Agencia de Protección Ambiental de Estados Unidos (2007), se define como la manipulación y el control de la materia en dimensiones de aproximadamente 1 a 100 nanómetros, abarcando la ciencia, así como la tecnología a nanoescala, donde las propiedades físicas, químicas y biológicas de los materiales cambian de manera fundamental a sus contrapartes macroscópicas. Los materiales a nivel nanométrico poseen una nueva y amplia gama de aplicación, que puede contribuir a afrontar los retos globales formulados en los proyectos de sostenibilidad.
La nanotecnología ofrece un campo holístico entre disciplinas científicas, debido a que la manipulación estructural de materiales, así como la composición de éstos en tamaño nanométrico, promete grandes avances en varios sectores incluyendo el agrícola. Los nanomateriales (NM’s), en especial los de base inorgánica han sido propuestos para su uso en la agricultura, ya que de acuerdo con varias investigaciones traerá beneficios como una agricultura sostenible y precisa con innovaciones como: a) la producción de NP’s para liberar ingredientes activos para el tratamiento de enfermedades en las plantas, aminorando los efectos sobre el ambiente, o bien, ellas mismas como nutrimentos; b) el uso de biosensores que permitan la detección segura y temprana de microorganismos fitopatógenos, al igual que el de contaminantes orgánicos e inorgánicos que ponen en peligro la salud de los cultivos, así como la de los consumidores finales; c) el uso de materiales nanoestructurados (MN’s) para el tratamiento de las aguas de riego para disminuir o eliminar posibles componentes tóxicos para los cultivos, entre otros (Baker et al., 2017).
Nanotecnología en la agricultura
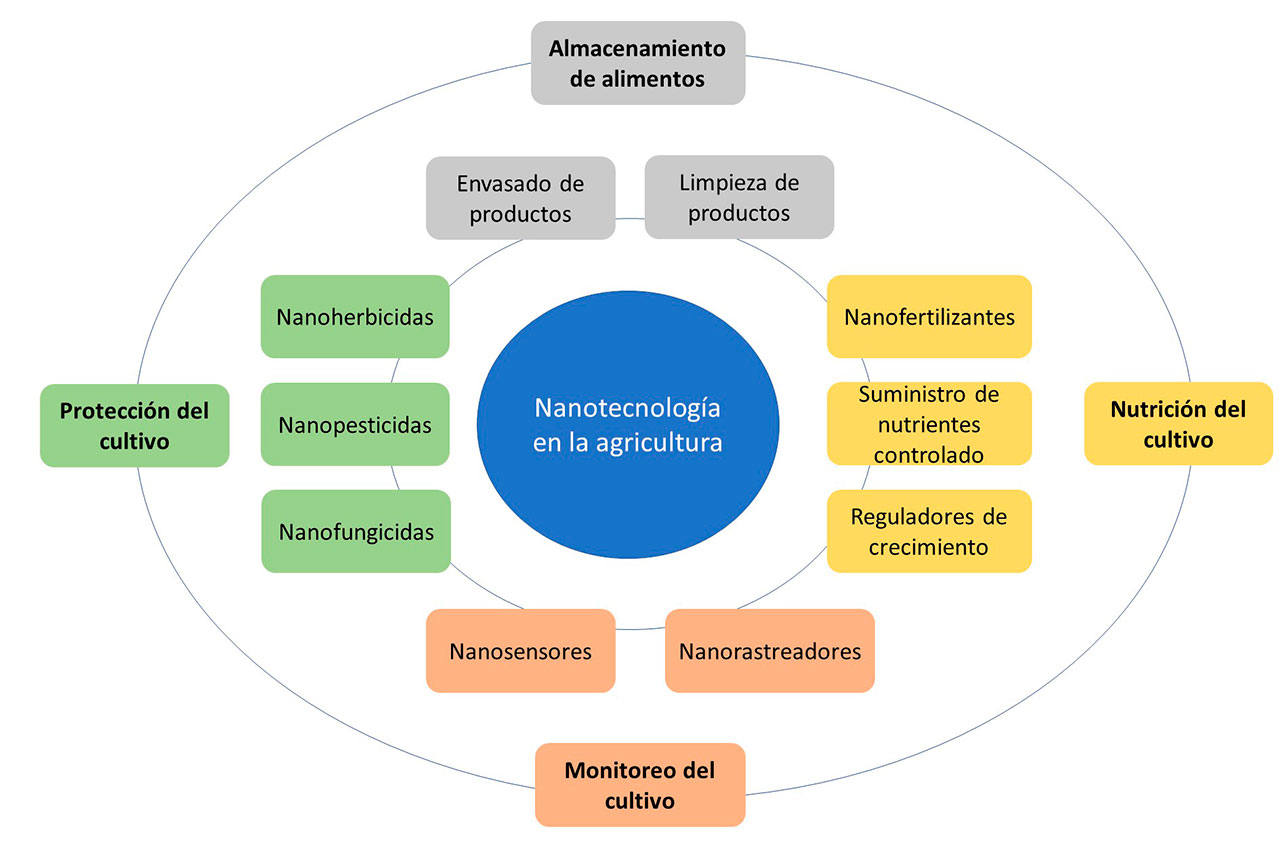
El uso de la nanotecnología en el sector agrícola es algo que en años recientes se ha investigado intensivamente. Además, al inicio de este siglo diversas instituciones en el mundo han realizado inversiones considerables, así como proyectos importantes para el desarrollo de MN’s dirigidos al sector agrícola. Se podría decir que la investigación nanotecnológica enfocada al sector agrario se ha vuelto necesaria, incluso como factor clave para el desarrollo sostenible, por su potencial para revolucionar el sistema alimenticio (Figura 1). Para hablar de una agricultura sostenible es necesario que se responda adecuadamente a las necesidades de los cultivos, para generar un sistema en el que se obtenga el máximo rendimiento con los recursos disponibles.
Entre las principales aplicaciones que se busca modernizar con los NM’s en la agricultura se encuentran: los materiales mejoradores del suelo, purificadores de agua, sensores, herbicidas, bactericidas, fungicidas, pesticidas y nutrimentos (Worrall et al., 2018), siendo los nano-pesticidas (NPP’s) así como los nano-nutrientes (NNT’s) los nuevos agroquímicos de gran relevancia. Los NPP’s por su tamaño, morfología y carga eléctrica, pueden ingresar fácilmente a los patógenos para actuar de manera eficiente con diferentes modos de acción en un amplio espectro de organismos macro y microscópicos. Por su parte, a los NNT’s, debido a sus características fisicoquímicas, se les facilita penetrar directamente en las células del cultivo y llevar a cabo la actividad deseada, como el aumento de la captación de agua, la biomasa de la raíz, el número de hojas, el periodo de floración, el índice de clorofila y por lo tanto, el rendimiento de los cultivos (Worrall et al., 2018). Por ello se ha propuesto el uso de NP’s disponibles en el mercado para que actúen como NPP’s y NNT’s. Tal es el caso del óxido de titanio del cual existe bastante información.
Óxido de titanio
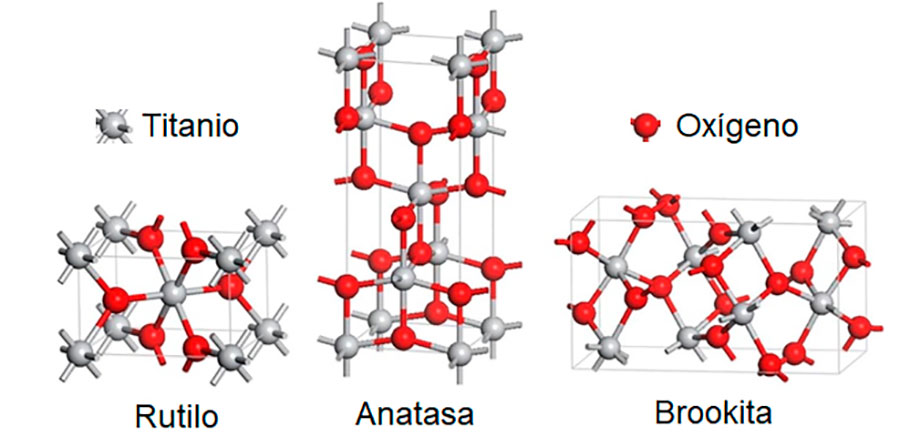
Las NP’s de TiO2 son de las más producidas por su gran variedad de aplicaciones, que van desde pigmentos, hasta aditivos alimentarios y productos de cuidado personal. Ello se debe a su costo de producción relativamente bajo y estabilidad en un amplio rango de condiciones. El TiO2 se encuentra de manera polimórfica en tres fases cristalinas: la fase de rutilo es la más estable, mientras que la anatasa y la brookita son formas de transición a rutilo (Figura 2); sin embargo, la disponibilidad comercial es mayor para la fase anatasa y rutilo, ya que la brookita es difícil de fabricar en la industria (Luttrell. et al., 2014). Cabe señalar que las tres fases cristalinas se ensamblan como octaedros, donde seis aniones de oxígeno son compartidos por tres cationes de Ti4+, de ahí la fórmula Ti3O6, que es equivalente a TiO2. Mientras se expanden en un espacio tridimensional, estas unidades octaédricas se organizan de manera diferente para cada polimorfo, lo que conduce a distintos patrones de cristalinidad, por lo que difieren en forma, estructura, densidad e índice de refracción.
La producción del TiO2 inició a principios del siglo veinte y tan solo en el 2012 la producción total mundial superó las 6.6 millones de toneladas métricas (Tsang et al., 2018). La amplia variedad de aplicaciones, así como su industrialización ha llevado a la distribución generalizada de NM’s de TiO2 en el ambiente, con diferentes efectos sobre los organismos vivos, lo que ha resultado de gran interés en el sector agrícola para su posible implementación, ya que el titanio es además un elemento benéfico para el desarrollo de las plantas, por lo que las NP’s de TiO2 podrían potenciar el desarrollo de los cultivos.
Efecto de las NP’s de TiO2 sobre las plantas
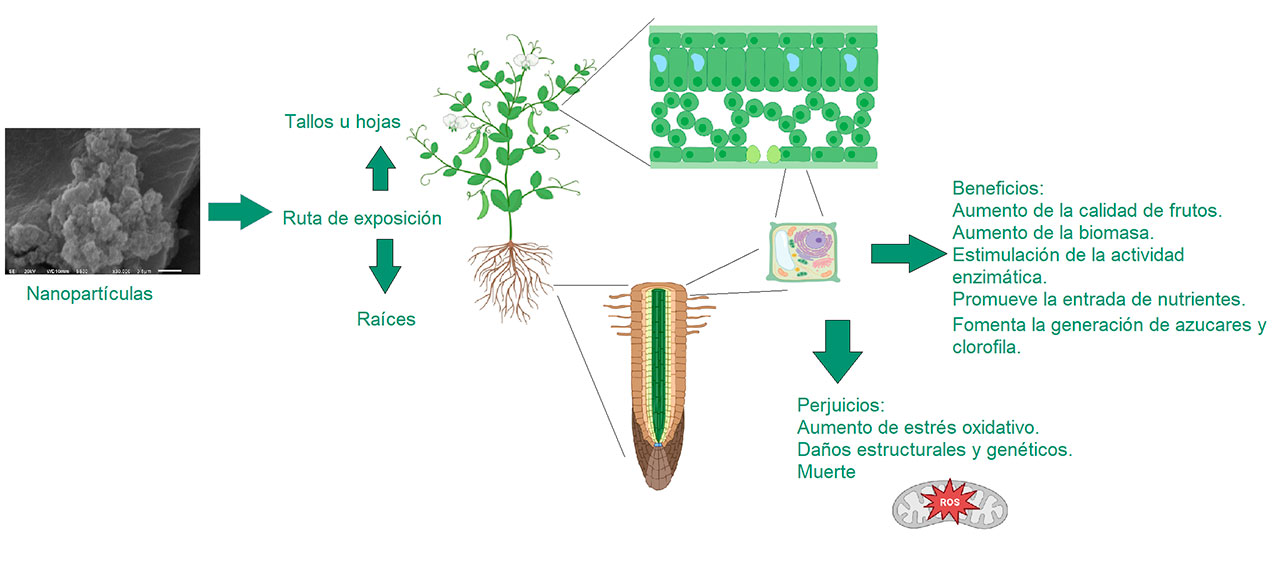
En la actualidad no existen estudios concluyentes relacionados con las NP’s de TiO2 en las plantas, a causa de variaciones en las metodologías experimentales, los organismos estudiados, así como las diferentes características fisicoquímicas de las NP’s utilizadas, generando incertidumbre sobre el empleo de las NP’s de TiO2. Sin embargo, los resultados reportados son relevantes, ya que muestran las posibles rutas metabólicas que interactúan (Figura 3). Con independencia del andamiaje metabólico y mecanismos específicos de las plantas, las NP’s indistintamente se absorben a través de las hojas o raíces para translocarse a lugares específicos de acción dentro de las células. Posibles efectos propuestos del titanio se relacionan con la absorción de hierro y magnesio por la planta; asimismo participa en reacciones de óxido reducción con estados de oxidación de Ti4+ y/o Ti3+, al igual que la estimulación de reacciones enzimáticas. No obstante, existen resultados que tienen contrastes significativos entre sí, ya que no se han dilucidado por completo los mecanismos de toxicidad vinculados con estas NP’s. Tal es el caso de Shull et al. (2019) que descubrieron una posible ruta de acción perjudicial de las NP’s en Arabidopsis thaliana que está vinculada con la autofagia de los cloroplastos inducida predominantemente por el estrés oxidativo.
En otras palabras, se forma una estructura de doble membrana alrededor de un organelo celular denominado autofagosoma; posteriormente la membrana externa de ésta se fusiona con la vacuola central, se deposita la carga celular rodeada con la membrana interna o cuerpo autofágico, para luego ser degradado por enzimas (proteasas vacuolares) dañando la actividad fotosintética general de la planta. No obstante, lo anterior contrasta con lo mencionado por Rafique et al. (2018) ya que ellos reportaron que en Triticum aestivum L, si bien muestra un aumento en la cantidad de superóxidos generados, así como mayor formación de micronúcleos causados por el estrés oxidativo, la formación de clorofila aumenta considerablemente al igual que la absorción de fósforo, longitud de raíces y tallo, mostrando que las NP’s pueden interaccionar con algunos parámetros fisiológicos de la planta de manera benéfica, debido a que podrían ingresar al cloroplasto y aumentar el transporte de electrones sin provocar su degradación como sugiere Shull et al. (2019). Sin embargo, por la complejidad de las rutas metabólicas y diferencias fisiológicas no es posible descartar ninguna de las posibilidades, sino plantearse nuevas maneras de análisis.
Por otra parte, también se han realizado estudios sobre la herencia genética de plantas tratadas con estos NM’s. Tan et al. (2018) reportaron en Ocimum basilicum un aumento significativo en la conductividad de las estomas, tras una exposición secuencial comparada con las que nunca habían sido expuestas. Asimismo, esta exposición reiterada ocasionó una disminución en clorofila b y total, pero un aumento en azúcares reductores, además de un incremento en la translocación de Ti a otros tejidos de la planta, aumentando la presencia de otros elementos en la raíz como calcio y zinc. Las consecuencias fisiológicas que provocaron todos estos cambios aún son desconocidas, lo cual conlleva a más interrogantes, sugiriendo que la respuesta de las plantas a la exposición continua depende del material y la dosis. Además de los factores mencionados, todavía existen otras incertidumbres, pues se desconocen los efectos de la exposición a las NP’s de TiO2 en los seres humanos por contacto directo o como residuo en los alimentos de plantas tratadas.
Efecto de las NP’s de TiO2 en humanos
Hay gran desconfianza en el uso de NM’s de titanio debido a que se han encontrado diferencias en la cinética y dinámica toxicológica, exclusivas de cada material, dadas por sus propiedades fisicoquímicas, que finalmente pueden provocar toxicidad. Esto es importante, ya que ocurren procesos de internalización de NM´s hacia los mamíferos a través de los alimentos. Estos procesos se desconocen en gran medida, pues cambian dependiendo de cada célula, así como de las propiedades físicas como el tamaño de partícula, su forma, aglomeración y carga superficial.
Además, una vez que las NP’s entran en las células, su destino se determina por varios factores, incluyendo la eficacia de la defensa antioxidante, la eficiencia de los sistemas de reparación del ADN, la propensión apoptótica al igual que los mecanismos de señalización celular, haciendo aún más complejo todo el proceso. Asimismo, las NP’s de TiO2 pueden presentar incluso diferentes efectos sobre la salud humana, tanto benéficos como perjudiciales, pues al ser de tamaño tan pequeño entran para alojarse en órganos importantes como el cerebro, hígado, riñones y pulmones para permanecer por tiempo indefinido (Elsaesser y Howard, 2012).
En años recientes se ha observado la necesidad de un enfoque rígido para la clasificación de los NM’s, requiriéndose datos más específicos sobre estos para abordar las necesidades reglamentarias, tener en cuenta las especificidades de los NM’s y evaluar su seguridad (Rauscher et al., 2017). Hoy en día se desarrollan técnicas, directrices y metodologías de evaluación; sin embargo, se requiere más investigación con relevancia específica para cuestiones reglamentarias, en particular, con una adecuada descripción de materiales nanoestructurados, la aplicación de etiquetado de productos que contengan NP’s y protocolos de seguridad de NM’s (Rauscher et al., 2017).
Existe descontento e incertidumbre en diversas instituciones y países. El más reciente de ellos fue Francia, donde la agencia de salud y seguridad menciona que no existen pruebas suficientes para garantizar la seguridad de los NM’s a base de titanio (USDA, 2019). Una de las causas es que diversos estudios mostraban afecciones sobre el uso de las NP’s, como el desarrollo de daño pre-tumoral en el colon de ratas alimentadas con estos NM’s (USDA, 2019). Conjuntamente, Tucci et al. (2013) reportó que en células como los queratinocitos que aparentemente no mostraban alteraciones, se encontraron cambios importantes en sus metabolismos.
Asimismo, Wright et al. (2017), reportaron en esa misma línea celular que las NP’s de TiO2 provocaban aumento en la apoptosis, pero no favorecían la angiogénesis y la transformación maligna de las células, por lo que los estudios se vuelven inconsistentes y no son concluyentes, ya que se involucran otros factores como la integridad de las células (mayor eficacia en el tejido dañado) y las características genéticas de las células expuestas a las NP’s. Debido a estas y otras contradicciones en los análisis realizados, Francia decidió prohibir el uso de NP’s de TiO2 en todos los productos alimenticios a partir del primero de enero del 2020 (USDA, 2019). Este suceso generó controversia, por lo que la Comisión Europea formuló una modificación en la regularización del uso de este NM’s; de igual manera, otras organizaciones se pronunciaron sobre el uso de este material, como Agir pour l’Environnement (Actuar por el medio ambiente) (USDA, 2019; EU, 2019).
Por lo tanto, debido a la incertidumbre en la aplicación de los NM’s por parte de los fabricantes y del gobierno, es una obligación del sector académico generar los instrumentos necesarios para garantizar el empleo seguro de esta nueva tecnología, y de no ser el caso, restringir su uso, para lo cual es de suma importancia tomar en cuenta los ámbitos sociales, económicos, ambientales y éticos.
Para finalizar, si bien es imprescindible desarrollar tecnologías innovadoras como los NM’s que aseguren la salud y nutrición de los cultivos ya que, indudablemente contribuirán a mejorar la calidad de vida del consumidor y productores, también es imperante que se conozcan de forma integral los riesgos que pueden generar estos materiales sobre organismos vivos, y más aun, en sistemas complejos como lo sería toda una cadena alimenticia. Por tanto, es pertinente la adopción del principio precautorio, como el caso de Francia para no implementar su uso hasta no estar completamente seguros de los beneficios o perjuicios, por lo que es importante la investigación extensiva de las NP’s TiO2, debido a que la información existente no es suficiente para utilizarlas directamente en el sector agroalimentario de forma completamente segura.
Referencias
Baker, S., Volova, T., Prudnikova, S. V., Satish, S. y Prasad, M. N. N. (2017). Nanoagroparticles emerging trends and future prospect in modern agriculture system. Environmental Toxicology Pharmacology, 53, 10-17. DOI: 10.1016/j.etap.2017.04.012.
Elsaesser, A. y Howard, C. V. (2012). Toxicology of nanoparticles. Advanced Drug Delivery Reviews, 64 (2), 129–137. DOI: 10.1016/j.addr.2011.09.001.
European Commission Official Journal of the European Union. Commission Regulation (EU) 2019/1857 of 6 November 2019 amending Annex VI to Regulation (EC) No 1223/2009 of the European Parliament and of the Council on cosmetic products. Brussels, Belgium. 2019. link.
Luttrell, T., Halpegamage, S., Tao, J., Kramer, A., Sutter, E. y Batzill, M. (2014). Why is anatase a better photocatalyst than rutile? – Model studies on epitaxial TiO2 films. Scientific Reports, 4 (4043), 1-8. DOI: 10.1038/srep04043.
Rafique, R., Zahra, Z., Virk, N., Shahid, M., Pinelli, E., Park, T. J., Kallerhoff, J. y Arshada, M. Dose-dependent physiological responses of Triticum aestivum L. to soil applied TiO2 nanoparticles: Alterations in chlorophyll content, H2O2 production, and genotoxicity. Agriculture, Ecosystems and Environment, 255, 95–101. DOI: 10.1016/j.agee.2017.12.010.
Rauscher, H., Rasmussen, K. y Sokull‐Klüttgen, B. (2017). Regulatory Aspects of Nanomaterials in the EU. Chemie Ingenieur Technik, 89, 225:231. DOI: 10.1002/cite.201600076.
Shull, T. E., Kurepa, J. y Smalle, J. A. (2019). Anatase TiO2 Nanoparticles Induce Autophagy and Chloroplast Degradation in Thale Cress (Arabidopsis thaliana). Environmental Science & Technology, 53 (16), 9522-9532. DOI: 10.1021/acs.est.9b01648.
Tan, W., Du, W., Darrouzet-Nardi, A. J., Hernandez-Viezcas, J. A., Ye, Y., Peralta-Videa, J. R. y Gardea-Torresdey, J. L. (2018). Effects of the exposure of TiO2 nanoparticles on basil (Ocimum basilicum) for two generations. Science of the Total Environment, 636, 240–248. DOI: 10.1016/j.scitotenv.2018.04.263.
Tsang, M. P., Philippot, G., Aymonier, C., Sonnemann, G. (2018). Supercritical Fluid Flow Synthesis to Support Sustainable Production of Engineered Nanomaterials: Case Study of Titanium Dioxide. ACS Sustainable Chemistry & Engineering, 6 (4), 5142-5151. DOI: 10.1021/acssuschemeng.7b04800.
Tucci, P., Porta, G., Agostini, M., Dinsdale, D., Iavicoli, I., Cain, K., Finazzi-Agró, A., Melino, G. y Willis, A. (2013). Metabolic effects of TiO2 nanoparticles, a common component of sunscreens and cosmetics, on human keratinocytes. Cell Death & Disease, 4 (e549), 1-11. DOI: 10.1038/cddis.2013.76.
United States Department of Agriculture (USDA) Foreign Agricultural Service. France bans Titanium Dioxide in food products by January 2020. GAIN Report Number FR1917, Paris, France, 2019. Disponible en el link.
US Environmental Protection Agency (EPA). Nanotechnology White Paper. Report EPA 100/B-07/001, Washington, DC, USA; 2007. link.
Worrall, E. A., Hamid, A., Mody, K. T., Mitter, N. y Pappu, H. R. Nanotechnology for Plant Disease Management. Agronomy, 8 (12), 285-309. DOI: 10.3390/agronomy8120285.
Wright, C., Iyer, A. K. V., Wang, L., Wu, N., Yakisich, J. S., Rojanasakul, Y y Neelam, A. (2017). Effects of titanium dioxide nanoparticles on human keratinocytes. Drug and Chemical Toxicology, 40 (1), 90-100. DOI: 10.1080/01480545.2016.1185111.