Nuevas evidencias experimentales sobre los beneficios de la lactancia: Estudio de los subtipos de la IgA en el calostro
El nacimiento es un proceso complejo que implica cambios fisiológicos muy importantes tanto para la madre como para el recién nacido. El niño debe hacer frente a las condiciones del medio ambiente del exterior, tales como temperatura, humedad, luz, etc., e iniciar la interacción con una gran cantidad de antígenos propios de la alimentación, la respiración, los patógenos y los microorganismos de la microbiota (Marchant, 2017).
Hoy sabemos que el sistema inmunológico del recién nacido es capaz de responder y establecer una respuesta frente a los microorganismos patógenos (Kollmann, 2017). Sin embargo, su experiencia inmunológica aún es incipiente para, por un lado, identificar y montar tolerancia frente a los antígenos de la microbiota, y por el otro, diferenciar entre los microorganismos dañinos. Esto genera una ventana de susceptibilidad importante y requiere de la protección contra las bacterias potencialmente patógenas que se pueden establecer en el intestino y el tracto respiratorio alto (Kollmann, 2017).
Diversos estudios han demostrado los impactos positivos asociados con una adecuada lactancia materna (Rajani, 2018). Proveer a los recién nacidos de leche materna como alimento exclusivo no sólo ayuda a la prevención contra infecciones; también se ha comprobado la disminución en el riesgo de sufrir enfermedades alérgicas como la rinitis y el asma. Así mismo, se ha visto su papel protector en enfermedades crónico degenerativas como la obesidad, la hipertensión, la diabetes e incluso algunos tipos de cáncer. Por otro lado, no alimentar al recién nacido con leche materna exclusiva aumenta el riesgo de mortalidad durante el primer año de vida. En países de primer mundo, se calcula que más de 900 muertes súbitas de lactante al año podrían evitarse si el 90% de ellos se alimentara con leche materna exclusiva durante los primeros seis meses de vida (Briana, 2017).
Por lo anterior, el bebé debe recibir de su madre los factores necesarios para un adecuado desarrollo de su sistema inmunológico; durante el embarazo, por la vía transplacentaria y después del nacimiento, a través de la lactancia. La lactancia se divide en tres etapas: en los primeros tres días posparto se produce el calostro, desde el cuarto día hasta el décimo, una leche de transición y la leche materna madura se produce desde la segunda semana hasta el fin de la lactancia (Ballard, 2013).
Mientras que la leche materna es rica en factores relacionados con la alimentación del niño, el calostro es una fuente de factores que contribuyen a la defensa del recién nacido (Godhia, 2013). El factor, que se encuentra en mayor concentración y se considera de los más importantes, es la IgA materna (Hurley, 2011). En general, la IgA es la inmunoglobulina que más se produce en el cuerpo y se relaciona con la protección de los epitelios de barrera. La IgA presenta dos subtipos: la IgA1 y la IgA2, con características moleculares bien descritas y con una distribución anatómica muy definida (Woof & Russell M, 2017) (Figura 1).
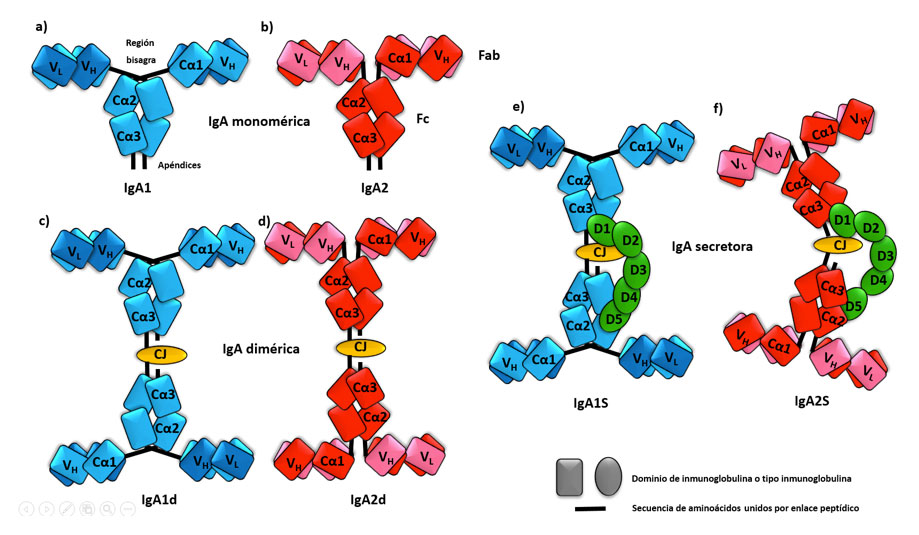
El origen de esta IgA materna viene de, principalmente, las células plasmáticas productoras de IgA generadas como respuesta a una infección en los sitios inductores de la respuesta inmunológica como son la piel, el tracto gastrointestinal y las vías respiratorias altas. Estos sitios anatómicos están en constante interacción con millones de microorganismos de la microbiota, los patógenos y los antígenos del medio ambiente (Brandtzaeg, 2013) a las cuales la madre está expuesta durante las infecciones.
Durante el embarazo, a través de la regulación hormonal, los precursores de las células plasmáticas IgA1+ (α4β1+) o IgA2+ (α4β7+) pueden migrar desde los sitios inductores a la glándula mamaria y residir en la periferia de los acinos mamarios hasta el momento de la lactancia (Pakkanen , 2010). La IgA materna es producida localmente por las células plasmáticas en los acinos mamarios y transportada al calostro y la leche por medio de la transcitosis. La IgA materna en el recién nacido jugará un papel importante en su protección, a través de la exclusión inmunológica y el mantenimiento de la homeostasis (Bunker & Bendelac, 2018).
Se podría esperar que esta experiencia inmunológica que la madre ha acumulado participaría de forma importante en la protección del recién nacido mediante la transferencia materna de la IgA presente en el calostro y la leche. Sin embargo, los estudios epidemiológicos que han evaluado el efecto de esta susceptibilidad en los niveles de IgA de calostro, no encuentran diferencias entre mujeres sanas y mujeres con episodios infecciosos durante el embarazo, o con resultados variables, dependiendo del tipo de vacuna o antígeno (Healy, 2012). Ladjeva y col. (Ladjeva, 1989) demostraron variaciones en la distribución de las subclases de la IgA1 y la IgA2 en 18 muestras de calostro, y analizaron la reactividad de la IgA contra polisacáridos y proteínas. Tanto la IgA1 como la IgA2 reconocieron al lipopolisacárido, pero la especificidad para las proteínas se encontró predominantemente dentro de la IgA1.
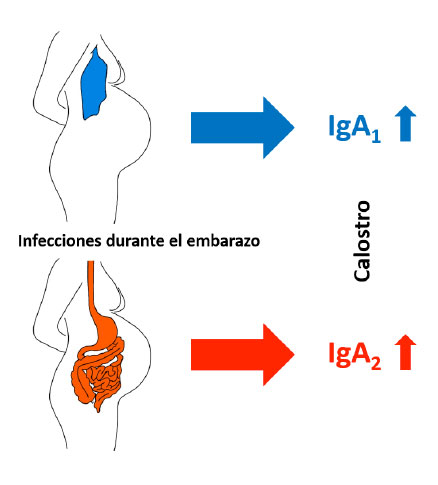
Ya que la mayoría de estos trabajos se ha limitado a la determinación de los niveles de IgA total, sin hacer la diferenciación entre la IgA1 y la IgA2 (Maertens, 2014), en nuestro laboratorio nos dimos a la tarea de cuantificar los niveles de inmunoglobulinas en el calostro de 900 madres mexicanas, mediante la técnica de ELISA cuantitativa, con énfasis en los niveles de la IgA1 y la IgA2. Los resultados indicaron que existe una correlación entre los niveles más altos de la IgA1 en el calostro de mujeres que cursaron un mayor número de infecciones en el tracto respiratorio y en la piel. En contraste, la IgA2 se encontró elevada en el calostro de mujeres que cursaron un mayor número de infecciones en el tracto gastrointestinal durante el embarazo (Sánchez-Salguero, 2019) (Figura 2).
En conclusión, la presencia de infecciones durante el embarazo aumenta los niveles de la IgA en el calostro. Este incremento es dependiente del sitio de inducción de la respuesta, siendo distinto entre la mucosa respiratoria, donde predomina en el calostro la respuesta por la IgA1 y la mucosa digestiva, donde el incremento observado es con la IgA2. Estos datos proveen evidencias para entender el efecto de las inmunizaciones e infecciones durante el embarazo que una mujer clínicamente sana puede presentar de manera normal. Esto nos da una idea de los posibles efectos que tendría en la protección del recién nacido y del papel individual de los subtipos de IgA en la transferencia materna.
Referencias
- Ballard, O. (2013). Human milk composition, nutrients and bioactive factors. Pediatr Clin North Am., 60, 49-74.
- Brandtzaeg, P. (2013). Secretory IgA: designed for anti-microbial defense. Front Immunol., 6(4), 222.Briana, D. (2017). Novel bioactive substances in human colostrum: could they play a role in postnatal adaptation?. The journal of maternal fetal & neonatal medicine., 30(5).Bunker, J., & Bendelac, A. (2018). IgA responses to Microbiota. Immunity, 49(2), 211-224.
- Godhia, M. (2013). Colostrum – its composition, benefits as a nutraceutical – a review. Curr Res Nutr Food Sci., 137-47.
- Healy, C. (2012). Vaccines in pregnant women and research initiatives. Clin Obstret Gynecol., 55(2), 474-86.
- Hurley, W. (2011). Perspectives on immunoglobulins in colostrum and milk. Nutrients., 3(4), 442-74.
- Kollmann, T. (2017). Protecting the newborn and young infant from infectious diseases: lessons from immune ontogeny. 46, 350-63.
- Ladjeva, I. (1989). IgA subclasses of human colostral antibodies specific for microbial and food antigens. Clin Exp Immunol., 78(1), 85-90.
- Maertens, K. (2014). Breastfeeding after maternal immunisation during pregnancy: providing immunological protection to the newborn: a review. Vaccine., 32, 1786-92.
- Marchant, A. (2017). Maternal immunisation: collaborating with mother nature. The lancet infectious diseases., 17(7), 197-208.
- Pakkanen , S. (2010). Expression of homing receptors on IgA1 and IgA2 plasmablasts in blood reflects differential distribution of IgA1 and IgA2 in various body fluids. Clin Vaccine Immunol., 17(3), 393-401.
- Rajani, P. (2018). Immunologically active components in human milk and development of atopic disease, with emphasis on food allergy, in the pediatric population. Front Pediatr., 6(218).
- Sánchez-Salguero, E. (2019). Infectious episodes during pregnancy, at particular mucosal sites, increase specific IgA1 or IgA2 subtype levels in human colostrum. Maternal health, neonatology and perinatology., 5(9), 1-8.
- Sánchez-Salguero, E., & Santos-Argumedo , L. (2018). [Human microbiota association with immunoglobulin A and its participation in immune response]. Rev Alerg Mex, 65(3), 264-278.
- Woof, J., & Russell M. (2017). Structure and function relationships in IgA. Mucosal immunology., 4(6), 590-7.
Erick Sánchez-Salguero, 1 Héctor Guzmán-Aquino, 1, 2 Leopoldo Santos-Argumedo 1*
1 Departmento de Biomedicina Molecular, Centro de Investigación y de Estudios Avanzados del IPN (CINVESTAV), CDMX, México.
2 Centro Interdiciplinario de Ciencias de la Salud, Unidad Milpa Alta (CICSUMA), Instituto Politécnico Nacional (IPN), CDMX, México.
*Correspondencia: lesantos@cinvestav.mx Investigador titular 3E y Jefe del Departamento de Biomedicina Molecular. CINVESTAV-IPN.