Un medicamento nuevo y eficaz (Simnotrelvir) para tratar COVID-19
El pasado 18 de enero de 2024, la prestigiada revista The New England Journal of Medicine, publicó un artículo titulado “Simnotrelvir oral para pacientes adultos con COVID-19 leve a moderado”. Los resultados reportados en este artículo corresponden a ensayos clínicos de Fase II-III, realizados en la población china y, ofrecen una nueva perspectiva para las personas de bajos recursos que buscan alivio contra la COVID-19. La administración del Simnotrelvir en las personas infectadas por COVID-19, demostró que tiene la capacidad de acelerar el proceso de recuperación de la enfermedad leve a moderada en aproximadamente 1.5 días. El medicamento Simnotrelvir (también conocido como SSD8432 o SIM0417) se ha introducido en el mercado de China con la marca XIANNUOXINTM. El medicamento se combinó con Ritonavir, para retrasar su degradación y así, tratar a los pacientes adultos que presentan casos leves a moderados de COVID-19 [1].
El estudio clínico reveló que el Simnotrelvir, cuando se ingiere en comprimidos orales, presenta un pronto inicio de acción, aliviando rápidamente los síntomas de COVID-19, como son la fiebre, tos y rinorrea.
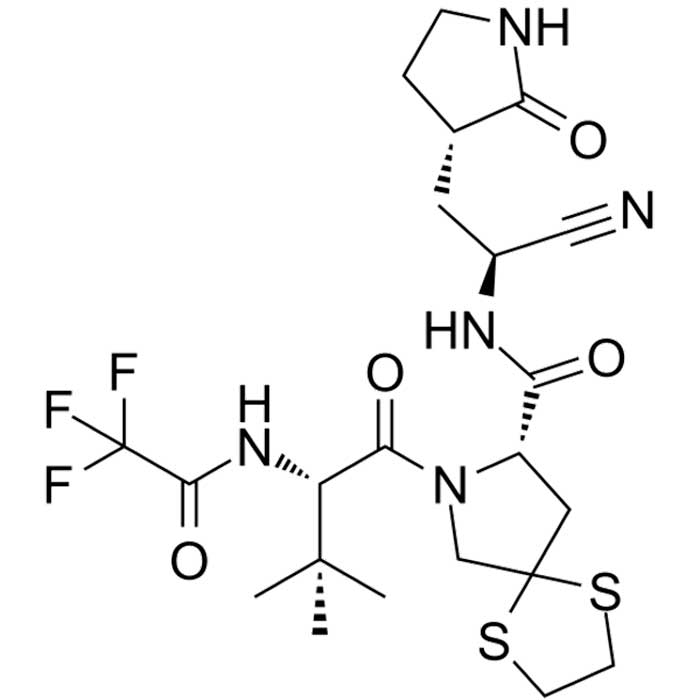
El Simnotrelvir es un medicamento oral que tiene actividad contra el coronavirus 2 del síndrome respiratorio agudo grave (SARS-CoV-2); es inhibidor de la proteasa viral 3CLPro, parecida a la 3-quimotripsina, y ha mostrado ser eficaz en un ensayo clínico de fase II-III.
Durante las etapas iniciales de la pandemia de COVID-19, los medicamentos antivirales se evaluaron principalmente en personas que tenían mayor riesgo de experimentar síntomas graves de COVID-19. En la actualidad, la Organización Mundial de la Salud aconseja que los medicamentos antivirales como Paxlovid, que se usa ampliamente para tratar el COVID-19 en Estados Unidos y otros países, solo deben administrarse a personas en categorías de alto riesgo. Como se esperaba, el SARS-CoV-2 se ha convertido en un virus respiratorio común entre la población. En el estudio mencionado, los investigadores combinaron sinérgicamente al Simnotrelvir con el Ritonavir, un componente del Paxlovid para inhibir la degradación enzimática de Simnotrelvir y mejorar el tiempo efectivo de acción terapéutica. Los investigadores realizaron ensayos en más de 600 individuos, con una edad media de 35 años. Aproximadamente la mitad de ellos tenían al menos un factor de riesgo, como la obesidad, lo cual podría conducir a que progresaran a una enfermedad grave. De forma notable, ninguno de los participantes experimentó casos graves de COVID-19.
Al quinto día después de iniciado el tratamiento, los niveles de SARS-CoV-2 en los pacientes que recibieron el Simnotrelvir disminuyeron aproximadamente 30 veces más que en los que no recibieron la droga y sólo tomaron un placebo.
El Simnotrelvir presenta algunos inconvenientes que se parecen mucho a los que tiene el otro medicamento estaunidense (Paxlovid), y se refiere a que ambos son de un desagradable sabor, además de la incompatibilidad con una variedad de medicamentos de uso común. En los ensayos clínicos, los investigadores solicitaron que los participantes comenzaran el tratamiento dentro de los tres días posteriores a la aparición de los síntomas, para asegurarse de la eficacia del nuevo medicamento.
El concepto que permitió el desarrollo del nuevo fármaco
Todos los coronavirus poseen componentes similares, los cuales pueden representar blancos potenciales para emplearse en el desarrollo de diversas intervenciones terapéuticas. Algunas de esas moléculas son: la glicoproteína de la espícula, la RNA polimerasa dependiente de RNA (RdRp) y la proteasa similar a 3-Quimiotripsina (3CLpro). Las enzimas 3CLpro y proteasa parecida a papaína (PLpro), son responsables de dividir a dos poliproteínas virales (pp1a y pp1ab) que se forman cuando los ribosomas del huésped traducen el RNA viral. Este proceso proteolítico, produce proteínas no estructurales cruciales para la replicación viral. Existen 11 sitios de corte para la enzima 3CLpro dentro de las poliproteínas virales. Por lo tanto, 3CLpro se conoce comúnmente como la proteasa principal (Mpro, por sus siglas en inglés). La enzima 3CLpro del coronavirus, puede identificar sustratos específicos adyacentes a la glutamina [(Leu-Gln) ↓ (Ser, Ala, Asn, Gly)]. y cortarlos. Esta capacidad hace diferente a la proteasa 3CLpro del coronavirus y de las otras proteasas humanas similares, ya que sirve como un mecanismo único para reducir las consecuencias negativas que pudiera tener la inhibición global de todas las 3CLpro. A diferencia de la glicoproteína de la espícula, que es altamente cambiante y susceptible a las mutaciones, la estructura de la proteasa 3CLpro, en especial la cavidad de unión al sustrato, permanece conservada y sin cambios entre varios coronavirus patógenos, incluidos el SARS-CoV-1, el coronavirus del síndrome respiratorio de Oriente Medio (MERS-CoV) y el SARS-CoV-2 y todas sus variantes de preocupación (VDP) [2].
El modelaje molecular
Sobre la base de las estructuras cristalinas y las características específicas de unión de diferentes potenciales inhibidores con la proteasa 3CLpro del SARS-CoV-2, se llevó a cabo un proceso para optimizar la capacidad de unión de un nuevo inhibidor a la proteasa y visualizar al candidato ideal, mediante la sustitución de diferentes grupos sustituyentes en sitios específicos del compuesto Boceprevir.
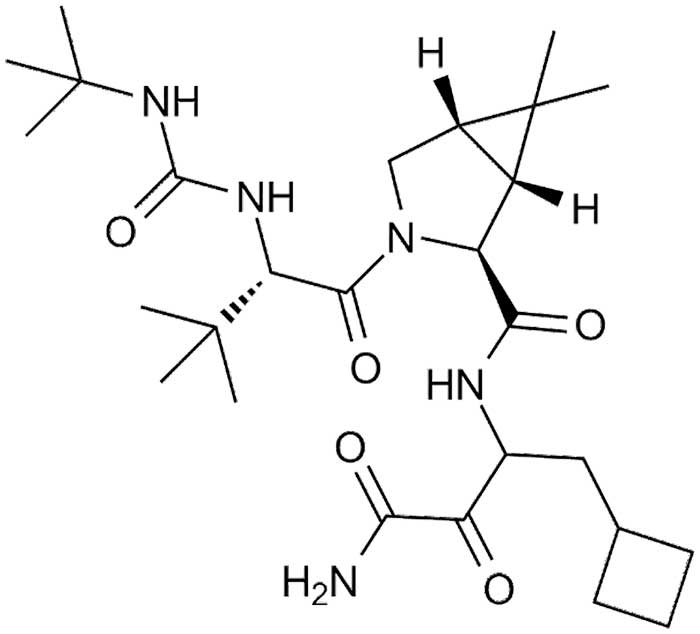
Estas modificaciones mejoraron la eficacia del compuesto contra la proteasa 3CLpro del SARS-CoV-2. El Simnotrelvir presentó su potente actividad antiviral en ensayos enzimáticos y celulares, a través de un mecanismo de acción de unión covalente a la proteasa. Este nuevo compuesto reveló una fuerte afinidad de unión a la enzima 3CLpro del SARS-CoV-2 y demostró ser inhibidor covalente específico para esta proteasa. Además, el Simnotrelvir tiene una estructura que le permite administrarse por vía oral, ya que se absorbe bien en el intestino y ejerce su acción un inhibidor de la proteasa similar a la 3-quimotripsina (3CLpro) del SARS-CoV-2 en las células infectadas por el virus. El compuesto fue sometido con éxito a evaluación preclínica, acelerando el camino para los subsecuentes ensayos clínicos y la aprobación condicionada para su uso en humanos por las autoridades sanitarias de China. El Simnotrelvir, combinado con ritonavir, para el tratamiento de la COVID-19, demostró una potencia significativa como inhibidor de la proteasa 3CLpro del SARS-CoV-2, y también es capaz de inhibir a proteasas similares en otros coronavirus. El Simnotrelvir exhibe una fuerte afinidad por la proteasa de los coronavirus y no muestra actividad inhibitoria en las proteasas similares de otros organismos, incluido el humano. Tiene un efecto inhibidor de amplio alcance sobre el SARS-CoV-2 y otros CoV 3CLpros. El compuesto inhibe eficazmente la replicación del SARS-CoV-2 y sus variantes, tanto en células como en los modelos animales de ratón. La forma específica en que se une el Simnotrelvir y sus características termodinámicas se han identificado con precisión. El Simnotrelvir es seguro y demuestra concentraciones plasmáticas orales significativas cuando se administra solo o junto con el ritonavir, lo que proporciona una potente eficacia antiviral en organismos vivos. Estas ventajas permiten que el Simnotrelvir se haya sometido con éxito a las evaluaciones preclínicas y clínicas. Los estudios preclínicos de Simnotrelvir mostraron una mayor eficacia antiviral, comparado con otro compuesto como el nirmatrelvir, otro inhibidor de la proteasa 3CLpro, que se usa en la actualidad para el tratamiento de COVID-19. Este resultado enfatiza el potencial del Simnotrelvir como candidato para el desarrollo de una nueva terapia contra la COVID-19. Sobre la base de estos hallazgos, se llevó a cabo la investigación inicial de Simnotrelvir en humanos para evaluar su seguridad, tolerabilidad y farmacocinética. Esta evaluación implicó la administración de dosis únicas y múltiples de Simnotrelvir solo o en combinación con ritonavir [3]. El desarrollo del Simnotrelvir, junto con ritonavir, y su uso como terapia oral, no solo proporciona un enfoque de tratamiento efectivo y duradero para la COVID-19 y otras infecciones por coronavirus, sino que también amplía la implementación clínica y la importancia de los inhibidores peptidomiméticos covalentes específicos de las proteasas virales.
El nuevo compuesto muestra características farmacocinéticas y de seguridad favorables en ratas y monos machos y hembras; además, mostró ser muy efectivo al ser usado en una terapia oral en un modelo de ratón macho de infección por SARS-CoV-2 Delta. En esos estudios disminuyó drásticamente la carga viral pulmonar y lo erradicó por completo del cerebro. La identificación de Simnotrelvir subraya el valor del diseño basado en la estructura de potentes inhibidores de la proteasa para desarrollar una terapia usando molécula pequeñas que se dirijan eficazmente a las proteínas de los coronavirus humanos.
Primeros resultados: Ensayo clínico Fase I
El 30 de septiembre de 2023, el European Journal of Pharmaceutical Sciences publicó “Un primer estudio de fase 1 en humanos de Simnotrelvir, un inhibidor de la proteasa similar a 3CL para el tratamiento de COVID-19, en sujetos adultos sanos” [4].
Este ensayo clínico evaluó la seguridad, tolerabilidad y farmacocinética de diferentes dosis de Simnotrelvir solo o combinado con ritonavir (Simnotrelvir o Simnotrelvir/ritonavir) en sujetos sanos, así como el efecto alimentario (ClinicalTrials.gov Identificador: NCT05339646). Los resultados del estudio mostraron que Simnotrelvir tenía buena tolerancia y baja incidencia de efectos adversos (EAs), similar a los perfiles de seguridad de otro compuesto, el nirmatrelvir. Todos los EAs, fueron leves y no se observaron efectos adversos graves.
Además, no se encontró alguna tendencia entre estos EA asociados con los niveles sanguíneos o las distintas dosis de Simnotrelvir probadas. Tanto el Simnotrelvir como el Nirmatrelvir son los sustratos de la enzima CYP3A. Por lo tanto, se planteó la posibilidad de usar los compuestos en combinación con el inhibidor de la enzima CYP3A, el Ritonavir, el cual actuaría como potenciador farmacocinético, al evitar su degradación. La administración concomitante del Ritonavir aumentó el área bajo la curva (AUC) en estado estacionario del Simnotrelvir en 9.4 veces después de múltiples dosis, similar a la de nirmatrelvir [5]. Esto se debió a que tanto el Simnotrelvir como el Nirmatrelvir fueron metabolizados principalmente por el CYP3A (86,7 % para el Simnotrelvir y 99 % para el Nirmatrelvir). Además, el Simnotrelvir y el Nirmatrelvir fueron sustratos del transportador de eflujo P-gp, y el Ritonavir puede aumentar aún más sus exposiciones al inhibir también al transportador P-gp.
El Simnotrelvir se absorbió rápidamente después de la administración oral, solo o en combinación con ritonavir. Su farmacocinética mostró linealidad en el rango de dosis entre 250 a 750 mg cuando se administró conjuntamente con Ritonavir y un aumento inferior a la dosis proporcional, si los niveles de dosis excedieron los rangos anteriores. La incidencia global de eventos adversos (EAs) fue del 22.2% (17/72) y del 6.3% (1/16) en los grupos de intervención y placebo, respectivamente. El aclaramiento aparente de Simnotrelvir fue de 135-369 L/h con Simnotrelvir solo y disminuyó significativamente a 19.5-29.8 L/h con la combinación Simnotrelvir/Ritonavir. Todos los resultados farmacocinéticos anteriores proporcionaron las bases para seleccionar y optimizar la cantidad y el intervalo de dosis en las investigaciones clínicas posteriores. Los alimentos aumentaron significativamente la exposición plasmática al Simnotrelvir, y la influencia sobre la farmacocinética fue comparable entre una dieta alta en grasas y una dieta regular. Esta observación sugiere que el estado alimentario debe considerarse cuidadosamente en el futuro tratamiento clínico tardío del Simnotrelvir.
Conclusión
El Simnotrelvir, un compuesto que inhibe la enzima 3CLpro, demuestra una excelente seguridad, tolerabilidad y características farmacocinéticas favorables en el ensayo clínico de FII-III publicado por el grupo de investigación chino. Estos hallazgos sugieren que Simnotrelvir tiene un gran potencial para controlar la COVID-19. Todos los niveles de dosis administrados a los sujetos en los diferentes estudios fueron bien tolerados y no se alcanzó la dosis máxima de tolerancia. El Ritonavir tiene la capacidad de aumentar sustancialmente la concentración de Simnotrelvir en el torrente sanguíneo, ya que éste es un sustrato de la enzima CYP3A4. El consumo de alimentos, bien se trate de una dieta normal o alta en grasas, también puede aumentar la exposición plasmática al Simnotrelvir. Los datos farmacocinéticos confirmaron que la combinación de Simnotrelvir/Ritonavir, con una dosis de 750 mg/100 mg dos veces al día sin alimentos, es el régimen de tratamiento recomendado para tratar a los pacientes con COVID-19.
La vacunación y ahora este potente antiviral nos puede hacer pensar que la COVID-19 pronto será considerada como una enfermedad catarral más.
Referencias
- Cao B, Wang Y, Lu H, Huang C, Yang Y, Shang L, Chen Z, Jiang R, Liu Y, Lin L, Peng P, Wang F, Gong F, Hu H, Cheng C, Yao X, Ye X, Zhou H, Shen Y, Liu C, Wang C, Yi Z, Hu B, Xu J, Gu X, Shen J, Xu Y, Zhang L, Fan J, Tang R, Wang C. Simnotrelvir oral para pacientes adultos con Covid-19 leve a moderado. N Engl J Med. 18 de enero de 2024; 390(3):230-241. doi: 10.1056/NEJMoa2301425. PMID: 38231624.
- Xiong M, Su H, Zhao W, Xie H, Shao Q, Xu Y. Lo que nos dice la proteasa similar a 3C del coronavirus: desde la estructura, la selectividad del sustrato hasta el diseño del inhibidor. Med Res Rev. 2021 Jul; 41(4):1965-1998. DOI: 10.1002/med.21783. Epub 18 de enero de 2021. PMID: 33460213; PMCID: PMC8014231.
- Singh RSP, Toussi SS, Hackman F, Chan PL, Rao R, Allen R, Van Eyck L, Pawlak S, Kadar EP, Clark F, Shi H, Anderson AS, Binks M, Menon S, Nucci G, Bergman A. Estudio aleatorizado innovador de fase I y selección de regímenes de dosificación para acelerar e informar el ensayo pivotal COVID-19 de nirmatrelvir. Clin Pharmacol Ther. Julio de 2022; 112(1):101-111. DOI: 10.1002/cpt.2603. Epub 4 de mayo de 2022. PMID: 35388471; PMCID: PMC9087011.
- Jiang X, Su H, Shang W, Zhou F, Zhang Y, Zhao W, Zhang Q, Xie H, Jiang L, Nie T, Yang F, Xiong M, Huang X, Li M, Chen P, Peng S, Xiao G, Jiang H, Tang R, Zhang L, Shen J, Xu Y. Desarrollo basado en la estructura y evaluación preclínica del inhibidor de la proteasa similar a 3C del SARS-CoV-2 Simnotrelvir. Nat Commun. 13 de octubre de 2023; 14(1):6463. DOI: 10.1038/s41467-023-42102-y. PMID: 37833261; PMCID: PMC10575921.
- Yang XM, Yang Y, Yao BF, Ye PP, Xu Y, Peng SP, Yang YM, Shu P, Li PJ, Li S, Hu HL, Li Q, Song LL, Chen KG, Zhou HY, Zhang YH, Zhao FR, Tang BH, Zhang W, Zhang XF, Fu SM, Hao GX, Zheng Y, Shen JS, Xu YC, Jiang XR, Zhang LK, Tang RH, Zhao W. Primer estudio de fase 1 en humanos de Simnotrelvir, un inhibidor de la proteasa similar a 3CL para el tratamiento de la COVID-19, en sujetos adultos sanos. Eur J Pharm Sci. 1 de diciembre de 2023;191:106598. doi: 10.1016/j.ejps.2023.106598. Epub 30 de septiembre de 2023. PMID: 37783378.
Foto de portada de cottonbro studio