Los mamíferos tenemos mecanismos de protección muy eficientes ante estresores internos y externos. Uno de ellos es la inflamación; otro, la ansiedad, una emoción de defensa. Ambos se vinculan estrechamente.
Blindaje inmunológico
En la práctica clínica se ha descrito la respuesta inflamatoria como aguda o crónica en función de su duración y de la presencia de cinco signos (rubor, calor, dolor, edema e impotencia funcional). Una respuesta aguda implica corta duración, la generación de edemas y la movilización de un tipo de células sanguíneas de defensa llamadas leucocitos, entre ellos los neutrófilos. Por su parte, la inflamación crónica dura más tiempo, los vasos sanguíneos se dilatan, se acumula excesivamente tejido conectivo en un órgano (fibrosis) como consecuencia de un proceso reparativo o reactivo y se observa daño en el tejido.
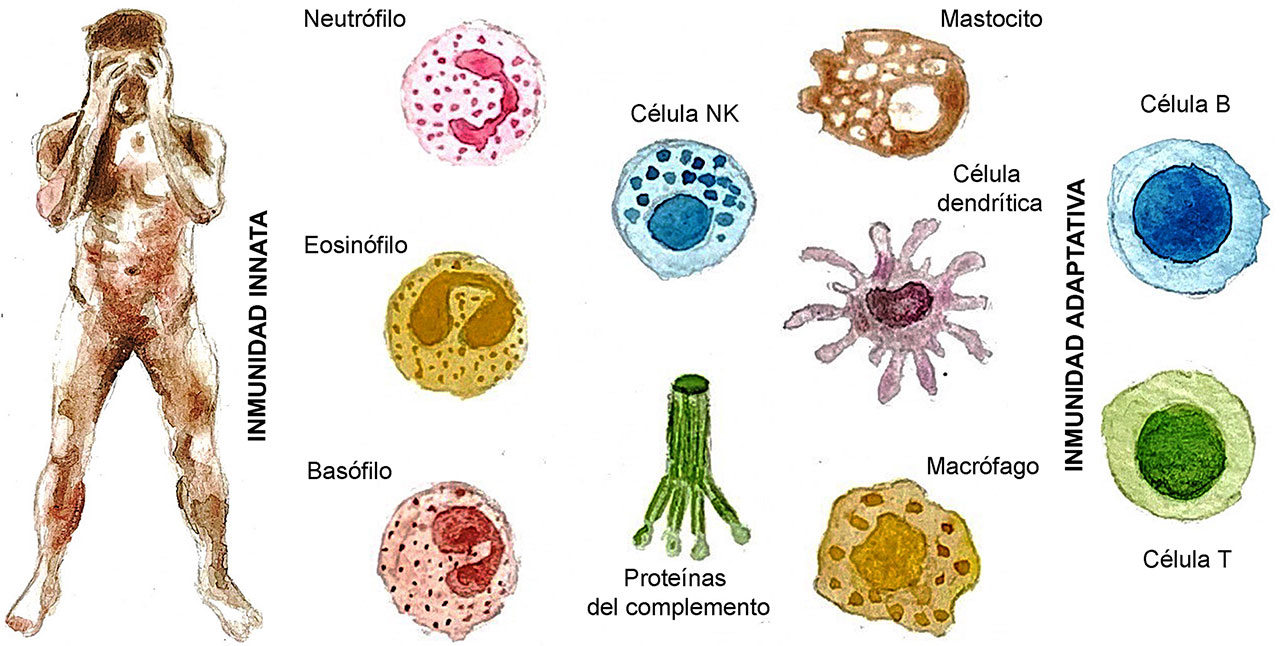
La inflamación es una respuesta inmunológica. El sistema inmune innato es la primera línea de defensa, al encargarse de la identificación y eliminación de agentes infecciosos o patógenos (antígenos) que pueden producir inflamación. Este trabajo es complejo porque las células sanguíneas como los neutrófilos, eosinófilos, basófilos, monocitos, células T, células B, células natural killer y macrófagos, deben ser capaces de diferenciar entre los componentes propios del organismo y los agentes infecciosos para evitar un ataque hacia las propias células del individuo, como sucede con las enfermedades autoinmunes.
Los actores y sus estrategias de acción
La respuesta inmunológica se pone en marcha cuando un agente extraño atraviesa las barreras que le pone el cuerpo humano, tanto físicas (piel), biológicas (microbiota intestinal), y químicas (lisozimas, lactoperoxidasas y otras moléculas). Primero ocurre que el agente externo invasor es reconocido en el interior por los receptores de reconocimiento de patrones (PPRs), los cuales identifican características específicas de los antígenos y moléculas producidas cuando hay daño del tejido, llamadas patrones moleculares asociados a patógenos (PAMPs); patrones moleculares asociados a daño (PMAD); patrones moleculares asociados a microorganismos (PMAM), y proteínas intracelulares liberadas por tejido muerto denominadas alarminas. En conjunto, estas acciones se interpretan como “señales de peligro”.
Dentro de los PPRs se encuentran los receptores tipo “toll” (TLRs), los cuales detectan PAMPs favoreciendo la activación de la siguiente etapa de la respuesta inmune innata. Los TLRs son receptores abundantes en los vertebrados que forman seis subfamilias (TLR-1/2/6/10, TLR-3, TLR-4, TLR-5, TLR-7/8/9 y TLR-11/12/13/ 21/22/23) cuya diversidad refleja un amplio espectro para el reconocimiento de antígenos. Una vez activado el TLR en cuestión, se produce una “tormenta” de proteínas citocinas pro o anti-inflamatorias y de otras más, que se encargan de regular la inflamación (Collado, et al., 2008). Ante esto, la inmunidad innata transita hacia la inmunidad adaptativa, la cual es altamente específica, favorece la producción de anticuerpos y promueve la memoria inmunológica (Herrero, 2010).
Un traje a la medida
La inmunidad adaptativa funciona primordialmente a través de las células sanguíneas llamadas linfocitos B y T que tienen en su membrana celular distintos receptores capaces de reconocer antígenos específicos. Esta inmunidad posee tres características que la diferencian de la innata. Primero, posee alta especificidad para distinguir entre múltiples antígenos; tiene memoria inmunológica que facilita la identificación y defensa exitosa ante un patógeno recurrente; y finalmente, se caracteriza por su insensibilidad inmunitaria para tolerar los antígenos producidos dentro del huésped, evitando con ello un ataque hacia el propio sistema.
Hasta este punto hemos mencionado la inflamación activada por patógenos, pero no todo proceso inflamatorio proviene de una infección. La inflamación también se puede presentar como parte de la respuesta ante una enfermedad neurológica (Figura 1).
Un caso complejo. La ansiedad
La ansiedad es una emoción básica, que todos hemos experimentado en algún momento. Se caracteriza por los componentes cognitivo-subjetivo, fisiológico-adaptativo y conductual-expresivo. Un ejemplo de esto ocurre cuando a los estudiantes se les informa que se les aplicará un examen difícil. En estas circunstancias la ansiedad comienza con una respuesta fisiológica-adaptativa que libera cortisol y adrenalina debido a la activación del eje hipotálamo-hipófisis-glándulas suprarrenales (HHA). Luego se pone en marcha todo el organismo, generando así el componente conductual-expresivo, desplegando una conducta enfocada en prepararse adecuadamente para esa evaluación, logrando así la adaptación. Sin embargo, la ansiedad puede llegar a ser mal-adaptativa o patológica cuando falla el componente cognitivo y se sobreestima el peligro, repercutiendo en una respuesta fisiológica anómala y en conductas que impiden la correcta adaptación al medio.
Existen trastornos de ansiedad descritos por la Asociación Psiquiátrica Americana (APA, 2013) que se diferencian por el estímulo que los desencadena y cuyos signos y síntomas varían en función de la edad infantil o adulta (Puga-Olguín, et al., 2020).
En la ansiedad ocurre la recepción de los estímulos que son captados a través de los sistemas sensoriales (olfativo, gustativo, auditivo, visual y somatosensorial) y son procesados por núcleos cerebrales como la amígdala, ubicada en las profundidades del lóbulo temporal, para asignar valencia emocional a esos estímulos medioambientales como placenteros o amenazantes. Esta información activa al eje HHA, y en paralelo, a la corteza prefrontal encargada de la toma de decisiones, de la evaluación del costo beneficio y de la regulación emocional, la cual junto con el hipocampo, facilita la consolidación de las memorias emocionales que establecen las estrategias cognitivas y conductuales para enfrentar adecuadamente a los estímulos estresores. La amígdala tiene un rol primordial en los trastornos de ansiedad porque está asociada a una disminución de la neurotransmisión inhibitoria mediada por el ácido gamma-aminobutírico (GABA), y a un aumento de la neurotransmisión excitatoria mediada por el glutamato. Por ello, los principales fármacos que reducen los síntomas de ansiedad (ansiolíticos) son las benzodiacepinas, que actúan sobre el receptor GABAA, aumentando los niveles de GABA cerebral.
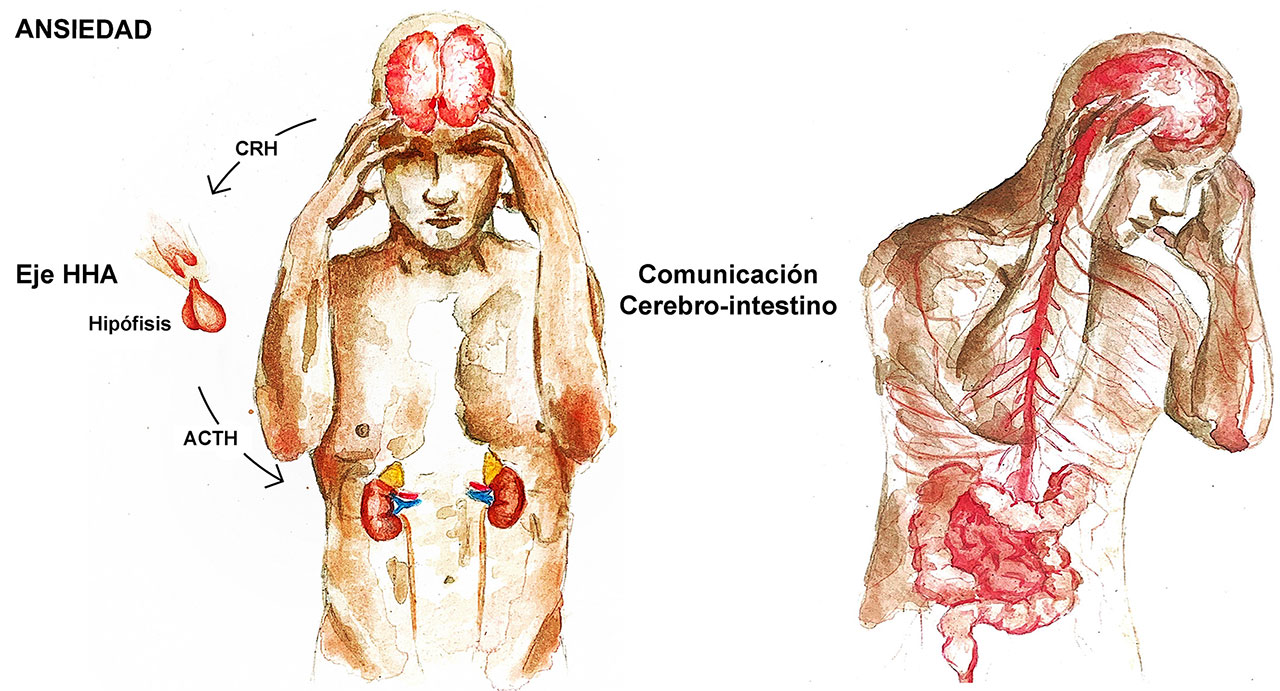
Para explicar el complejo proceso de instauración y de progresión de la ansiedad, los investigadores y especialistas clínicos han centrado su atención en varias “piezas del rompecabezas” como son 1) las alteraciones del eje HHA y la comunicación del cerebro con órganos periféricos (Figura 2), 2) la capacidad del cerebro para remodelar sus circuitos y funciones con base en la experiencia (neuroplasticidad), 3) la generación de nuevas neuronas (neurogénesis), 4) la respuesta inflamatoria, y 5) el estrés oxidativo, entendido como el desequilibrio entre la producción de especies reactivas de oxígeno (moléculas oxidantes) y la capacidad anti-oxidante del sistema. Ante la complejidad y diversidad de los elementos involucrados, puede vislumbrarse la asociación entre la inflamación y la ansiedad.
Los puentes entre la inflamación y la ansiedad
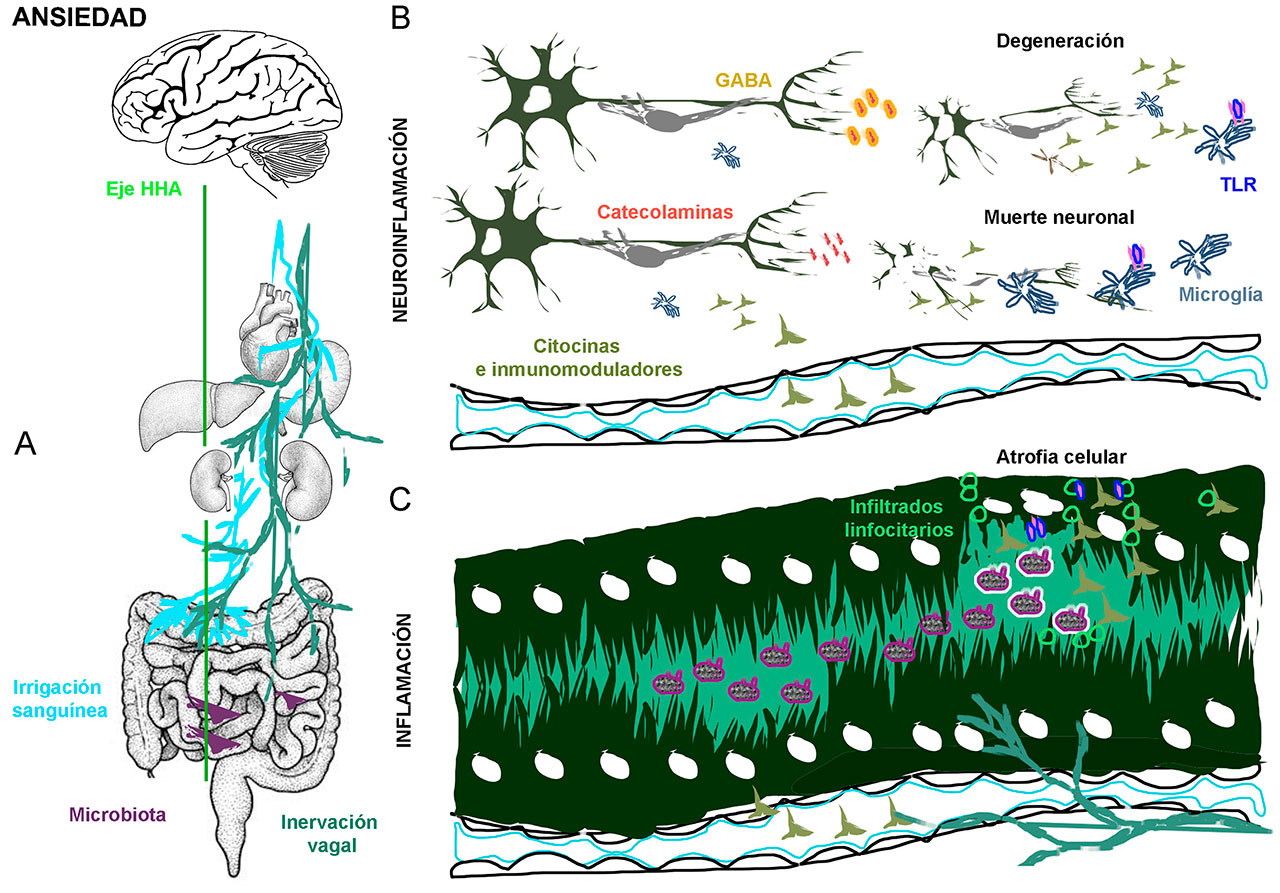
Una afección ocurrida en el entorno periférico incide en los circuitos neuronales de la ansiedad gracias a los “puentes de comunicación” entre ellos. Uno de éstos es el nervio vago, y otro, por sorprendente que parezca, lo constituye el microbioma, entendido como el conjunto de microorganismos que interactúan fisiológicamente con su entorno; está constituido principalmente por bacterias residentes en el tracto gastrointestinal capaces de producir citocinas pro-inflamatorias, principalmente las interleucinas 1, 6 y 12 (IL-1, IL-6 e IL-12) y el factor de necrosis tumoral alfa (TNF-α), lo que destaca su relación con el sistema inmunológico. El puente para que las citocinas producidas en el microbioma intestinal interactúen con componentes celulares del sistema nervioso es precisamente el nervio neumogástrico llamado “vago”, identificado como el décimo de los 12 pares craneales; se origina en el bulbo raquídeo, inerva la faringe, el esófago, la laringe, la tráquea, los bronquios, el corazón, el estómago, el páncreas, el hígado y los intestinos (delgado y grueso), de aquí que se considere que la circulación sanguínea y los órganos circunventriculares funcionan también como elementos de comunicación del eje intestino-cerebro. Por ello, cuando hay alteración en el microbioma intestinal, aumenta la producción de citocinas pro-inflamatorias, generando así un proceso inflamatorio crónico que alcanza el cerebro.
En el cerebro, la señal de que se instaura un proceso inflamatorio es detectada por los guardianes del sistema nervioso central, es decir, por las células gliales a través de los receptores TLR-4. Las células gliales como la astroglía y la microglía reaccionan rápidamente con la producción de citocinas pro-inflamatorias como la IL-1, IL-6, IL-12 y TNF-α, conocida como respuesta neurotóxica, propiciando un proceso neuroinflamatorio crónico que comienza por afectar estructuras cerebrales involucradas en la ansiedad y ejes funcionales.
Uno de los principales sistemas afectados en la neuroinflamación es el HHA que tiene a su cargo la modulación de las respuestas de estrés. Una desregulación de éste, conlleva efectos nocivos por estrés crónico como la ansiedad, que terminan por agotar los niveles de neurotransmisores como dopamina, serotonina y noradrenalina, además de reducir la neuroplasticidad, la neurogénesis y la capacidad del sistema inmune de neutralizar patógenos (Figura 3).
Retomando el dilema
¿Qué fue primero la inflamación o la ansiedad? La respuesta es compleja, porque todo “depende” de cada caso; por ejemplo, podemos desarrollar un trastorno de ansiedad por un estímulo medioambiental como resultado de un proceso de aprendizaje que culmine en la afectación de nuestras defensas o bien, derivado de un proceso interno inflamatorio crónico, como es el caso del síndrome neurológico post-COVID-19.
Ante este panorama, los investigadores deben explorar tratamientos basados en el reforzamiento de la capacidad antioxidante, así como en el control de la respuesta inflamatoria como un blanco terapéutico en el tratamiento de los trastornos de ansiedad.
Referencias
American Psychiatric Association-APA. (2013). Manual Diagnóstico y Estadístico de los Trastornos Mentales (5ta ed.). Madrid. España: Editorial Médica Panamericana.
Collado, V. M., Porras, R., Cutuli, M. T., & Gómez-Lucía, E. (2008). El sistema inmune innato I: sus mecanismos. Revista Complutense de Ciencias Veterinarias, 2(1), 1-16.
Herrero, M. J. (2010). ABC de los «Toll-like receptors»: relación con el desarrollo y progresión de enfermedades autoinmunes. Seminarios de la Fundación Española de Reumatología, 11(4), 135-143.
Peirce, J. M., & Alviña, K. (2019). The role of inflammation and the gut microbiome in depression and anxiety. Journal of neuroscience research, 97(10), 1223-1241.
Puga-Olguín, A. et al. (2020). Trastornos de ansiedad. En Herrera-Meza, G., Molina-Jiménez, T., Tamariz-Rodríguez, A., & A. Puga-Olguín (Eds.), Trastornos Neurofuncionales: Perspectivas Neurobiológicas y de Atención, Universidad de Xalapa. México, 139-164.
[elfsight_social_share_buttons id=”1″]