El cáncer en general es una de las enfermedades con mayor incidencia en el mundo; hasta el 2012 se presentaron 14 millones de casos nuevos y 8.2 millones de defunciones por esta causa, así como 32.6 millones de personas sobrevivientes a la enfermedad.1 El cáncer de mama ocupa el primer lugar en incidencia de las neoplasias malignas en mujeres, y en nuestro país representa la primera causa de muerte.2 El grupo de edad más afectado es el de mujeres entre 40 y 59 años de edad. La tasa más alta se ubica en 2016, con 16 defunciones por cada 100,000 mujeres de 20 años y más.3
El cáncer de mama, al igual que otros tipos de cáncer, se origina por mutaciones en el material genético de las células, las cuales crecen de forma anormal y desordenada, con la capacidad de diseminarse a regiones altamente irrigadas (pulmón, cerebro, etcétera.). Es una enfermedad multifactorial que involucra agentes endocrinos, reproductivos (nuliparidad, primera gestación después de los 30 años de edad, historial hormonal), ambientales (alcoholismo, uso de anticonceptivos, terapia de reemplazo hormonal, exposición a radiación ionizante) y factores de estilo de vida (obesidad, dieta hipercalórica y sedentarismo). La causa de riesgo más importante relacionada con el estilo de vida es la obesidad. En nuestro país se presenta en un elevado porcentaje y es serio problema de salud. Las mujeres obesas tienen un riesgo mayor de padecer cáncer de mama después de la menopausia, en comparación con mujeres no obesas; esto parece tener su explicación en los altos niveles de estrógenos circulantes. Asimismo, las mujeres con antecedentes de cáncer mamario que desarrollan obesidad tienen mayor riesgo de una recaída tumoral.4
La mortalidad de esta enfermedad difiere entre países desarrollados y aquellos en desarrollo, donde ocurre la mayoría de los decesos, ya que en el 90% de los casos el diagnóstico se realiza en etapas avanzadas, debido a la falta de acceso a servicios de salud y a la poca sensibilización para la detección precoz.5
La mayoría de los tumores mamarios surge a partir de células epiteliales (carcinomas) y se clasifican de acuerdo con la integridad de la membrana basal, es decir, si han penetrado o no dicha membrana limitante, por lo que aquellos que están dentro se denominan carcinomas in situ, mientras que aquellos los que se han extendido más allá, se denominan carcinomas invasivos o infiltrantes. Las lesiones in situ o pre-invasivas son subdivididas a su vez en carcinoma ductal in situ (DCIS) y carcinoma lobulillar in situ (LCIS). La ubicación más frecuente de los tumores dentro de la mama es el cuadrante superior externo, seguido por la porción central. La variedad más frecuente es el carcinoma ductal infiltrante (cerca del 80%), y el segundo es el lobular infiltrante (aproximadamente 15%); el resto está formado por otras neoplasias como tumores filoides, sarcomas y linfomas.6 .
Los tumores mamarios se pueden clasificar, además, con base en sus distintas características, como la presencia de receptores hormonales y la expresión de receptores de factores de crecimiento, como el epidermal humano 2 (Her-2/neu); estas características repercuten en el pronóstico y decisiones terapéuticas. Aproximadamente el 16% de los casos son triple negativo, es decir, las células cancerosas carecen de receptores de estrógeno (ER-), receptores de progesterona (PR-) y receptores Her-2/neu.). Alrededor del 65 % de los tumores detectados poseen receptores hormonales positivos y finalmente 21 % son positivos para la expresión de Her-2/neu.7
El tratamiento se determina con base en las características particulares del tumor e incluyen: a) tratamiento local (resección quirúrgica y radioterapia), cuya finalidad es eliminar el tumor local o regional reduciendo al mínimo el riesgo de una recurrencia y b) tratamiento general o sistémico (quimioterapia, tratamiento hormonal y tratamientos dirigidos), aplicado cuando las células tumorales se detectan en la sangre o en la médula ósea, con la finalidad de reducir el riesgo de metástasis y muerte.8
En el país 47.5 % de los casos detectados se encuentra en etapas avanzadas, donde el tumor ha metastatizado, requiriendo así de terapias sistémicas, primordialmente quimioterapia, la cual se lleva a cabo en intervalos que permiten la recuperación de los efectos adversos más frecuentes como la mielosupresión. Sin embargo, esto favorece también la recuperación de las células cancerosas, las cuales pueden tornarse quimiorresistentes. A pesar de las diferentes opciones terapéuticas disponibles, en nuestro país prevalece la necesidad de encontrar tratamientos sistémicos más eficaces, así como la introducción de tratamientos novedosos que incrementen los beneficios y reduzcan los efectos adversos.9
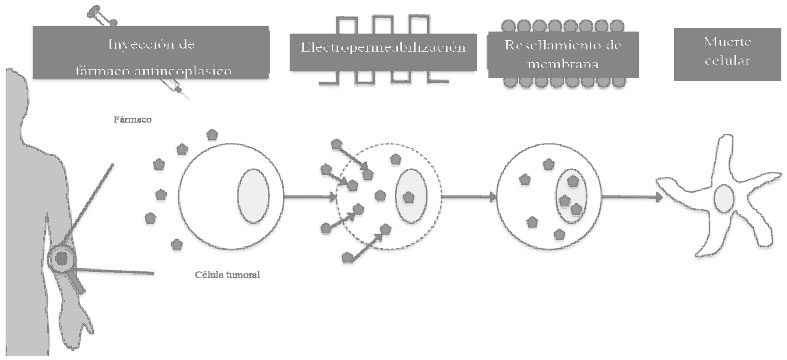
Una de las estrategias en investigación consiste en la optimización de la entrega de agentes antineoplásicos al interior de las células cancerosas. Este método se denomina Electroquimioterapia (EQT), y consiste en la formación de poros o canales en la superficie celular de interés como respuesta a la exposición a un campo electromagnético en presencia de fármacos antitumorales, favoreciendo así la entrada masiva de los mismos [Fig. 1].10 Una de las principales ventajas de este método es que estos fármacos se utilizan en bajas concentraciones si se les compara con las utilizadas en la quimioterapia convencional. La EQT se ha establecido en varios países europeos como un tratamiento local oncológico de uso tanto humano como veterinario, con un rango de respuesta alentador (84.1 %). Sin embargo, sólo se ha logrado su aplicación en metástasis cutáneas derivadas de tumores no mamarios y únicamente con fines paliativos, reduciendo principalmente el sangrado, la ulceración y el dolor.11
Dada la alta efectividad de la electroquimioterapia en el tratamiento de tumores cutáneos y subcutáneos sin importar el origen histológico, en el laboratorio se llevaron a cabo estrategias experimentales in vitro para el establecimiento de protocolos de electroporación en células de origen mamario para que permitan su translación al modelo in vivo y que sirvan como base para futuras pruebas clínicas [Fig. 2]. La determinación de umbrales de electroporación específicos es un elemento importante, ya que cada tejido posee características particulares que determinan la respuesta ante diferentes estímulos, y como se ha mencionado, el cáncer de mama es un padecimiento heterogéneo en el que las células cancerosas pueden poseer múltiples receptores, así como carecer de ellos.12
La EQT, aplicada en tumores primarios de localización profunda, podría representar una terapia curativa, adyuvante y neoadyuvante, dependiendo de las características tumorales. Es decir, en el caso de tumores con buena respuesta al fármaco, la EQT resultaría un tratamiento curativo al potenciar el efecto farmacológico del agente antineoplásico, evitando las sesiones repetidas de aplicación de quimioterapia. Mientras que en aquellos casos donde es necesario aplicar sesiones de quimioterapia debido al gran tamaño tumoral, la EQT podría ser aplicada de forma adyuvante, es decir, posterior a una sesión convencional, acortando al mismo tiempo el número de éstas. Finalmente, en los casos donde se cuenta con terapias dirigidas específicamente a ciertos blancos presentes en los tumores, la EQT podría aplicarse de forma neoadyuvante, es decir, previo al tratamiento dirigido, con la finalidad de eliminar la mayor parte de células cancerosas y eliminar las posibles remanentes a través de las terapias blanco.
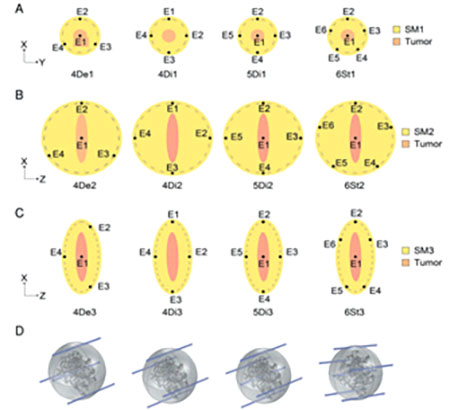
Actualmente prevalece la necesidad de ajustes tecnológicos que posibiliten la aplicación adecuada de la EQT dirigida a tumores mamarios. Uno de los principales ajustes, en desarrollo, es el diseño de electrodos de alcance profundo, así como el planteamiento de nuevas configuraciones de arreglos en los electrodos que aseguren una mayor y eficiente cobertura del tejido tumoral, así como de un margen de seguridad determinado [Fig.3].13
Los diferentes arreglos de electrodos están dirigidos a las variadas formas tumorales que pueden encontrarse en una mama real, con la finalidad de asegurar una cobertura casi total del área a tratar. Se han determinado 3 principales arreglos de electrodos que permitirán tratar tumoraciones de entre 1 y 5 cm3, es decir un rango de tamaño mayor al considerado actualmente para el tratamiento de tumoraciones cutáneas mediante esta técnica. Como puede observarse en la Figura 3, la inserción de un máximo de 5 agujas resulta un procedimiento mínimamente invasivo cuando se compara con las técnicas quirúrgicas disponibles actualmente, donde se realiza la remoción completa de la mama (mastectomía radical). Por lo tanto, esta terapia representa una alternativa atractiva para la preservación de la integridad corporal de las pacientes afectadas, ya que resultaría en la evasión tanto de la resección quirúrgica como de efectos adversos, dando una mayor esperanza en aquellos casos donde las opciones con tratamientos tradicionales no ofrezcan una ventaja significativa.
Referencias
- Cancer fact sheets: all cancers excluding non-melanoma skin cancer. Gcoiarcfr. 2017. Available at: http://gco.iarc.fr/today/data/pdf/fact-sheets/cancers/cancer-fact-sheets-29.pdf. Accessed December 12, 2017.
- Cáncer. Organización Mundial de la Salud. Available at: http://www.who.int/mediacentre/factsheets/fs297/es/. Accessed December 17, 2017.
- Cáncer de la Mujer (SICAM) Cáncer de Mama – datos.gob.mx/busca. 2017. Available at: https://datos.gob.mx/busca/dataset/cancer-de-la-mujer-sicam-cancer-de-mama. Accessed December 20, 2017
- Guía de Práctica Clínica. Diagnóstico y tratamiento del cáncer de mama en segundo y tercer nivel de atención, México Secretaría de Salud, 2009. Disponible en: http://www.cenetec.salud.gob.mx/descargas/gpc/CatalogoMaestro/232_IMSS_09_Ca_Mama_2oN/EyR_IMSS_232_09.pdf.
- Tice, J., O’Meara, E., Weaver, D., Vachon, C., Ballard-Barbash, R. and Kerlikowske, K. 2013. Benign Breast Disease, Mammographic Breast Density, and the Risk of Breast Cancer. JNCI: Journal of the National Cancer Institute, 105(14), pp.1043-1049.
- Lakhani SR, Ellis IO, Schnitt SJ et al., eds (2012). WHO Classification of tumours of the breast, 4th ed. Lyon: IARC.
- Consenso de Cáncer Mamario – México. Consenso de Cáncer Mamario – México. http://consensocancermamario.com/. Accessed January 9, 2018.
- Group E. EBCTCG: Early Breast Cancer Trialists’ Collaborative Group. Effects of chemotherapy and hormonal therapy for early breast cancer on recurrence and 15-year survival: an overview of the randomised trials. The Lancet, (2005). 365(9472): 1687-1717.
- Loibl, S., Denkert, C. and von Minckwitz, G. (2015). Neoadjuvant treatment of breast cancer – Clinical and research perspective. The Breast, 24: S73-S77.
- Miklavčič D, Serša G, Brecelj E et al. Electrochemotherapy: technological advancements for efficient electroporation-based treatment of internal tumors. Medical & Biological Engineering & Computing. 2012; 50(12):1213-1225. doi:10.1007/s11517-012-0991-8.
- Ricotti F, Giuliodori K, Cataldi I et al. Electrochemotherapy: an effective local treatment of cutaneous and subcutaneous melanoma metastases. Dermatologic Therapy. 2013; 27(3):148-152. doi:10.1111/dth.12098.
- Vera-Tizatl CE, Talamás-Rohana P, Vera-Hernández A, Leija-Salas L, Rodríguez-Cuevas SA, Chávez-Munguía B, Vera-Tizatl AL. Cell morphology impact on the set-up of electroporation protocols for in-suspension and adhered breast cancer cells. Electromagn Biol Med. 2020 Oct 1;39(4):323-339. doi: 10.1080/15368378.2020.1799387..
- Vera-Tizatl, A., Vera-Tizatl, C., Vera-Hernández, A., Leija-Salas, L., Rodríguez, S., Miklavčič, D., & Kos, B. (2018). Computational Feasibility Analysis of Electrochemotherapy with Novel Needle-Electrode Arrays for the Treatment of Invasive Breast Ductal Carcinoma. Technology In Cancer Research & Treatment, 17, 153303381879493. doi: 10.1177/1533033818794939.