Uso de la espectroscopía Raman para el diagnóstico de la enfermedad de Parkinson
Según las estadísticas de la Organización Mundial de la Salud (OMS), en la actualidad existen más de 50 millones de personas en el mundo que padecen alguna enfermedad neurodegenerativa (EN) y se estima que para 2030 habrá 78 millones (Condor et al., 2019). Una de las EN de mayor frecuencia es la enfermedad de Parkinson (EP), en la cual algunas células nerviosas llamadas neuronas se mueren progresivamente en determinadas zonas del cerebro, ocasionando disminución del neurotransmisor conocido como dopamina, induciendo actividad cerebral anormal con síntomas motores como rigidez muscular, lentitud en los movimientos (bradicinesia), temblores, alteración de la postura, el equilibrio y la coordinación, dificultad para hablar y masticar, así como síntomas no motores como demencia, depresión, ansiedad, insomnio y trastornos del sueño (Weintraub et al., 2022). Se desconoce cuál es la causa de la EP, aunque existen varios factores que pueden aumentar el riesgo de padecerla, como variaciones genéticas, exposición a toxinas o ciertos factores ambientales.
En trabajos de investigación realizados post-mortem, se han observado la presencia de cuerpos de Lewy dentro de las neuronas; estos depósitos sirven como marcadores de la enfermedad y podrían ser responsables de muerte neuronal (Rodríguez- Leyva et al., 2014; Apetri et al., 2006). Dentro de los cuerpos de Lewy se acumula la proteína alfa sinucleína (αsyn). La αsyn se encuentra en condiciones normales en regiones del cerebelo de todas las personas, cerebro, líquido cefalorraquídeo y sangre (EI- Agnaf et al., 2003) pero en la EP esta proteína sufre cambios en su estructura, llamada alfa-sinucleína patológica (αsyn-p), que se acumula dentro de los cuerpos de Lewy y que posteriormente se asocian con la muerte de las neuronas (Rodríguez- Leyva et al., 2014) (Figura 1).
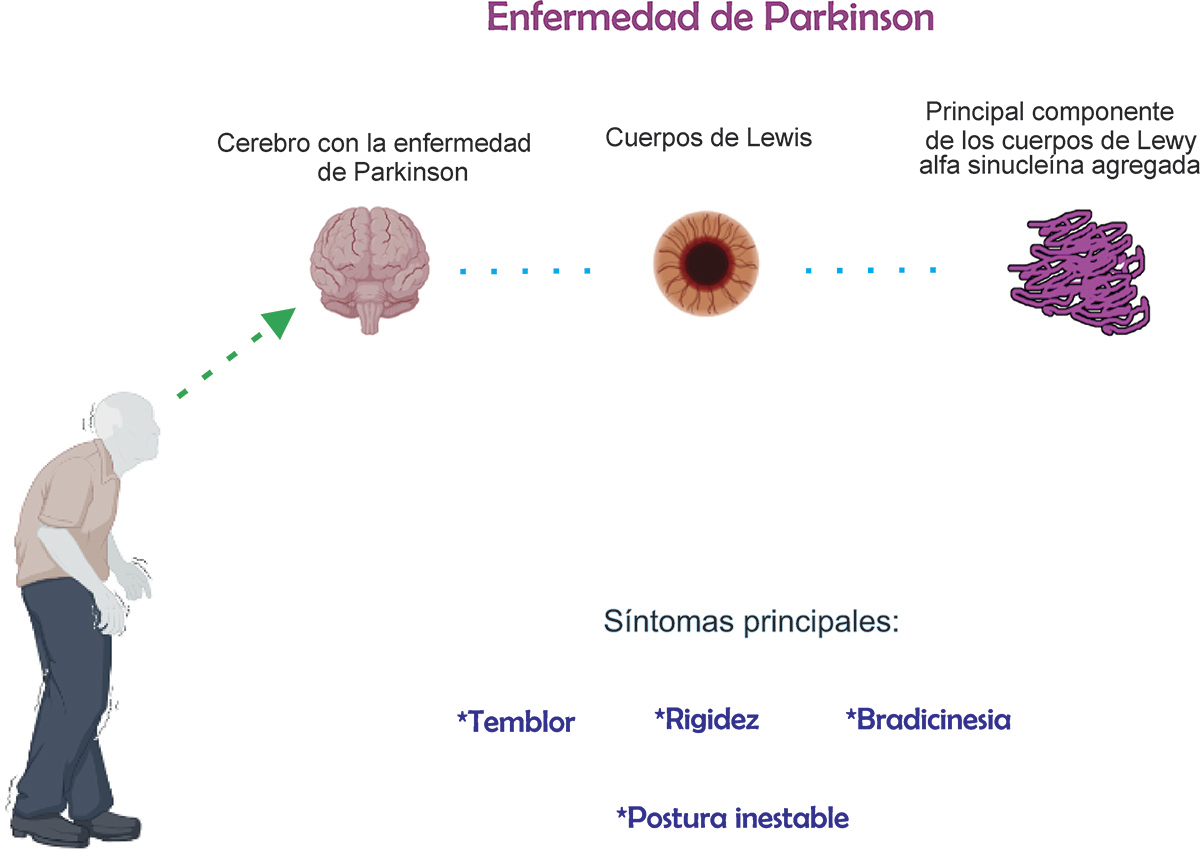
En la actualidad, el diagnóstico de la EP se basa en estudios de imagenología y criterios clínicos. Es frecuente que el diagnóstico se realice en etapas avanzadas de la enfermedad cuando los síntomas motores y no motores son evidentes. La detección tardía se debe a la complejidad para realizar procedimientos que adviertan los cambios microscópicos que se dan en el cerebro (Weintraub et al., 2022), por lo que se han buscado nuevos métodos para el hallazgo temprano de la EP basados en la identificación de marcadores biológicos como las proteínas αsyn y αsyn-p, las cuales pueden encontrarse acumuladas en la sangre y piel de las personas afectadas. En esos tejidos se puede observar una mayor cantidad de estas proteínas en comparación con las personas sanas (Rodríguez- Leyva et al., 2014; EI- Agnaf et al., 2003). Los métodos para determinar marcadores patológicos convencionales tienen la desventaja de ser invasivos, requiriendo de la preparación extenuante de las muestras, alargando los tiempos de espera de un diagnóstico.
Como alternativa a estos métodos, se han propuesto técnicas ópticas capaces de diferenciar un tejido sano de uno enfermo, ayudando al diagnóstico de enfermedades. Estas herramientas tienen muchas ventajas; son mínimamente invasivas y no requieren una preparación previa del tejido o biofluido que se analizará. Una de ellas es la espectroscopía Raman (ER), la cual ha sido utilizada en el diagnóstico de gran variedad de enfermedades como diabetes mellitus, fibrosis hepática, dermatitis atópica y cáncer, entre otras, a través de tejidos como uñas, sangre, hígado y piel (Bonifacio et al., 2015).
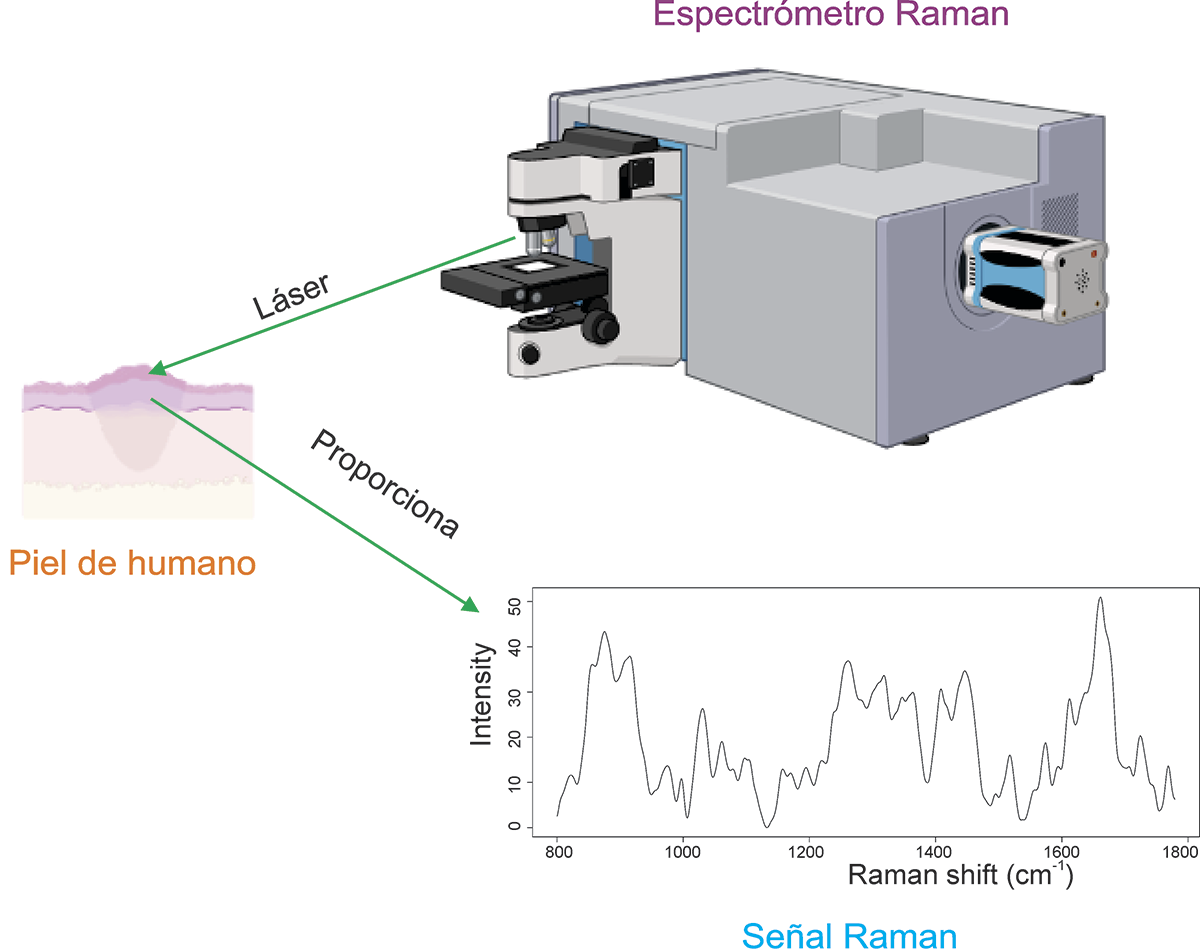
La ER se basa en colocar un láser sobre material biológico como sangre, orina, tejido in vivo, o una biopsia. La luz que interactúa hace vibrar las moléculas, dando como resultado una señal (o espectro) Raman, que contiene información única de la composición química del segmento analizado, una especie de “huella molecular” (Bonifacio et al., 2015) (Figura 2).
Este grupo de investigación ha empleado la ER como método para identificar diferencias en la composición química en la piel de personas sanas y con EP. El objetivo es analizar biopsias de piel de individuos mayores de 65 años, con y sin la enfermedad, para identificar cambios en la señal Raman asociados con la presencia de αsyn y αsyn-p.
Una vez obtenido el espectro Raman de la piel, se determinan los picos característicos que indican la presencia de biomoléculas que integran la muestra (Condor et al., 2019; Bonifacio et al., 2015). Debido a que la piel humana de forma natural contiene gran cantidad de proteínas, es fundamental contar con los espectros de las proteínas puras a identificar.
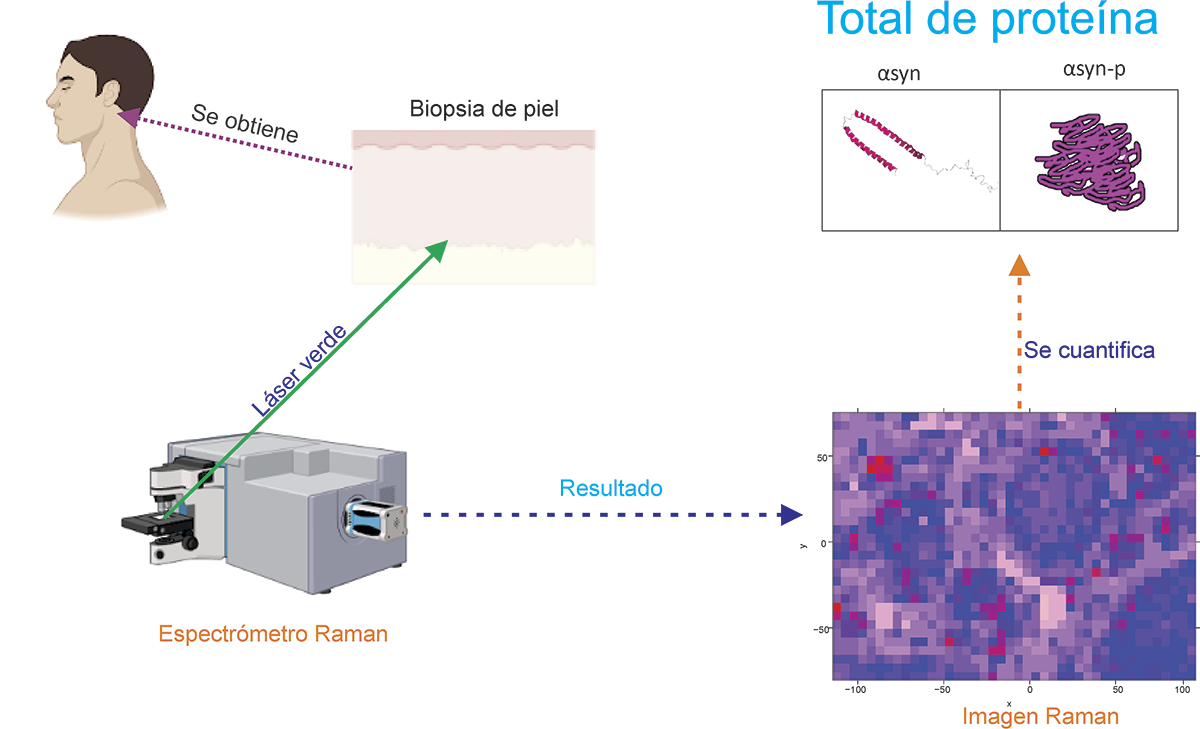
Por otra parte, es posible realizar imágenes a través de espectros Raman, técnica que se conoce como mapeo Raman (Bonifacio et al., 2010). En éste, se toman espectros en diferentes puntos sobre el material analizado para reconstruir una imagen con información molecular de una zona específica, en este caso, en la biopsia de piel.
El principal componente a identificar en la imagen es la presencia de las proteínas αsyn y αsyn-p (Figura 3), de tal manera que muestre aquellas zonas de la piel que tienen cambios asociados con la EP, así como las áreas donde no hay la proteína patológica o modificada. Como resultado se esperaría que la imagen de la biopsia de piel de alguien con la EP tuviera gran cantidad de αsyn-p, localizada en ciertas áreas específicas a diferencia de un individuo sano, ayudando al diagnóstico de la enfermedad. Este procedimiento es de gran utilidad ya que no es necesario someter las biopsias a procesos con empleo de tinciones, reactivos de alto costo, que en ocasiones son difíciles de adquirir por parte de un laboratorio de análisis. Este método eventualmente abarcará un amplio campo en la biología siendo posible obtener imágenes de tejidos afectados de diversas enfermedades.
La espectroscopía Raman muestra hallazgos muy significativos, y en el futuro puede emplearse como complemento para el diagnóstico de la EP, usando biopsias de piel para localizar acumulaciones de la proteína alfa sinucleína patológica.
Referencias
- Apetri M. M., Maiti N. C., Zargorski M. G., et al. “Secondary structure of α-Synuclein oligomers: Characterization by Raman and Atomic Force Microscopy”. Journal of Molecular Biology. 2006;355(1):63–71.
- Bonifacio A., Beleites, Vittur F., Marsich E., Semeraro S., Paolotti S.. and Sergo V., “Chemical imaging of articular cartilage sections with Raman mapping, employing uni- and multi-variate methods for data analysis”. Analyst. 135(12). 2010. 3193-3204.
- Bonifacio A., Cervo S., and Sergo V., “Label-free surface-enhanced Raman spectroscopy of biofluids: fundamental aspects and diagnostic applications”, Analytical and bioanalytical chemistry. 407(27). 2015., 8265-77.
- Condor I. R., Atencio-Paulino J. I., Contreras-Cordova C. R. “Clinical epidemiological characteristics of parkinson’s disease in a national hospital of the Peruvian highlands”. Revista de la Facultad de Medicina Humana. October 2019;19(4):14-21.
- El-Agnaf, O.M., Salem, S.A., Paleologou, K.E., Cooper, L.J., et al. “Alpha-Synuclein Implicated in Parkinson’s Disease is Present in Extracellular Biological Fluids, Including Human Plasma”. The Federation of American Societies for Experimental Biology Journal. 2003. 17(13): 1-16.
- Rodríguez-Leyva I, Calderón-Garcidueñas AL, Jiménez-Capdeville ME, et al. “α-Synuclein inclusions in the skin of Parkinson’s disease and parkinsonism”. Annals of Clinical and Traslational Neurology. 2014;1(7):471–8.
- Weintraub D., Aarsland D., Ray Chaudhuri K., Dobkin R. D., Leentjens A., Rodriguez-Violante M., Schrag A. “The neuropsychiatry of Parkinson’s disease: advances and challenges”. The Lancet Neurology. 21(1). 2022. Pages 89-102.