Resistencia a antibióticos: problema global que requiere acción urgente.
Las infecciones bacterianas ocurren cuando las bacterias se multiplican dentro del ser humano y llegan a provocar efectos adversos, como diarrea, fiebre, e incluso la muerte. Los antibióticos se utilizan para combatir a las bacterias que causan diferentes infecciones, pues inhiben procesos esenciales en las bacterias, como la división celular y proliferación. Sin embargo, el uso generalizado de antibióticos ha creado una presión de selección sobre las bacterias patógenas, que ha dado lugar al desarrollo y amplificación de mecanismos de resistencia. Esto significa que los antibióticos que se usan para combatir infecciones están perdiendo su efectividad, lo que crea desafíos significativos para la salud pública, al dificultar los tratamientos existentes.
En 2019, se estimó que la resistencia antimicrobiana (RAM) fue responsable de 1.2 millones de decesos en el mundo. Las predicciones para 2050 indican que los decesos podrían aumentar a 10 millones de personas cada año. Ante la preocupación creciente por la carencia de tratamientos efectivos contra las infecciones bacterianas, surge la pregunta: ¿Qué es y cómo ocurre la RAM y por qué es un problema tan grave? ¿Qué acciones se están implementando para abordar este desafío?
En este artículo, además de encontrar respuestas a estas preguntas, se exponen las estrategias de combate desde la perspectiva de “Una Salud”, la cual tiene como objetivo lograr un equilibrio sostenible y optimizar la salud de las personas, los animales y los ecosistemas, así como el impacto económico de la RAM, y cómo herramientas innovadoras como la inteligencia artificial, pueden contribuir a enfrentar el problema.
¿Qué es y cómo ocurre la RAM y por qué es un problema?
La RAM se refiere a la capacidad de una célula bacteriana para sobrevivir y multiplicarse aun en presencia de un antibiótico. Esta capacidad de resistir ocurre cuando una bacteria posee o adquiere lo que se conoce como mecanismos de resistencia que le permiten evadir o eliminar al antibiótico. Estos mecanismos de resistencia generalmente están codificados en el material genético de la bacteria.
El problema se vuelve más complicado pues los genes responsables de la resistencia pueden transferirse fácilmente entre bacterias. Esto ocurre por la rápida división de las bacterias o cuando una bacteria libera o transfiere material genético a células vecinas que lo adoptan como propio. Este proceso facilita la rápida propagación de la resistencia. Podemos imaginar algo así como un incendio forestal en un mundo sin bomberos: una vez que comienza, se propaga rápidamente, sin control, y destruye todo a su paso.
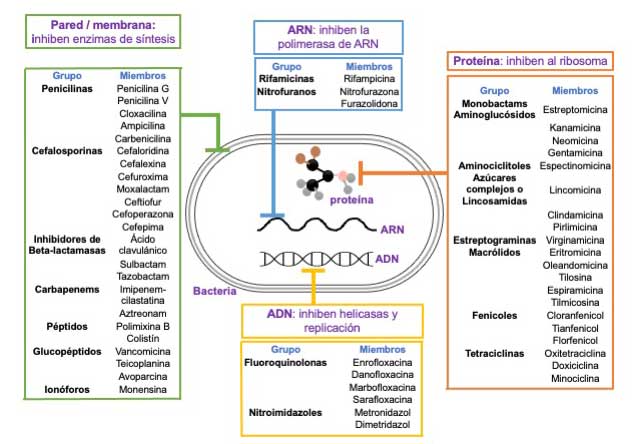
Para entender mejor la resistencia, primero exploraremos los principales instrumentos de acción de los antibióticos (Figura 1) y, posteriormente, los procesos de resistencia en las bacterias (Figura 2). Los antibióticos tienen como blanco procesos esenciales para la sobrevivencia de las bacterias, como son la síntesis de sus componentes de pared celular, de proteínas o la replicación de su ADN. ¿Qué sabemos de cada uno de estos?
Mecanismos de acción de los antibióticos
- Antibióticos que inhiben la formación de la pared celular.
La pared celular bacteriana es responsable de la presión osmótica y de la forma de la bacteria (bacilos o cocos), el intercambio de nutrientes, entre otras funciones. El peptidoglicano es el principal componente de la pared, y su síntesis requiere de diversas reacciones enzimáticas. Las enzimas transpeptidasa y carboxipeptidasa producen el peptidoglicano al unir las moléculas N-acetil glucosamina con ácido N-acetil murámico, y son clasificadas dentro de las proteínas de unión a penicilina o PBPs, por sus siglas en inglés.
Los antibióticos que contienen un anillo beta-lactámico, como las penicilinas, se unen a las enzimas PBPs e inhiben su actividad, lo que impide la formación de la envoltura celular. Otros antibióticos, como la vancomicina, se unen a los extremos de los precursores de la pared celular, N-acetil glucosamina y ácido N-acetil murámico, impidiendo que se enlacen entre sí para formar el peptidoglicano, componente esencial de la pared celular bacteriana.
El contar con antibióticos que inhiben la síntesis de pared celular en bacterias es de particular importancia en el tratamiento de infecciones causadas por bacterias, pero ¿qué ocurre cuando se desarrolla resitencia, no a uno, sino a varios antibióticos, como es el caso en Staphylococcus aureus, resistente a meticilina (MRSA)? MRSA es una cepa que ha desarrollado resistencia a múltiples antibióticos beta-lactámicos, incluidos aquellos basados en penicilinas, lo que la convierte en un desafío considerable en entornos clínicos, especialmente en el tratamiento de infecciones de la piel, tracto respiratorio, intoxicaciones alimentarias y otras infecciones graves.
- Antibióticos que inhiben la síntesis de ARN y proteínas.
La síntesis de proteínas comienza con el proceso de transcripción, mediante el cual la enzima ARN polimerasa copia un fragmento de ADN en ARN. La información en la molécula de ARN es posteriormente utilizada para la sintesis de proteínas por el ribosoma. Antibióticos como los aminoglucósidos, macrólidos, lincosamidas, tetraciclinas y cloranfenicol inhiben la síntesis de proteínas al interferir con las subunidades del ribosoma. Las rifamicinas inhiben la transcripción al bloquear la ARN polimerasa, siendo cruciales en el tratamiento de infecciones como la tuberculosis, causada por Mycobacterium tuberculosis. Sin embargo, algunas cepas de M. tuberculosis presentan resistencia a la rifampicina, lo que constituye un grave problema de salud pública.
- Antibióticos que inhiben la replicación del ADN
La replicación del ADN asegura la reproducción de las bacterias. Los antibióticos de la familia de las fluoroquinolonas (por ejemplo, ciprofloxacina) inhiben la enzima girasa, lo que bloquea la replicación del ADN e impide la división celular. Las bacterias resistentes a las fluoroquinolonas son un desafío en los entornos hospitalarios. Pseudomonas aeruginosa, que puede causar infecciones en el tracto respiratorio, las vías urinarias, heridas y quemaduras, es un ejemplo notable de resistencia a las fluoroquinolonas, como la ciprofloxacina, lo que constituye un desafío considerable.
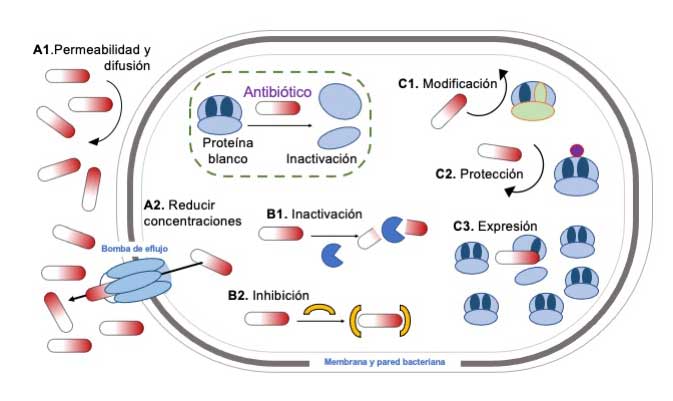
Mecanismos bacterianos de resistencia a los antibióticos
La resistencia bacteriana a los antibióticos representa una amenaza creciente para la salud global, capaz de revertir décadas de avances médicos. El estudio de los mecanismos de resistencia a los antibióticos es crucial para desarrollar nuevas estrategias terapéuticas y definir políticas más efectivas de uso de antibióticos. Son tres las principales estrategias de resistencia en las bacterias y las tres pueden existir de manera simultánea en una misma bacteria para uno o más antibióticos.
A continuación, describimos estas estrategias (Figura 2). Se trata de expulsar cuanto antes o impedir la entrada del antibiótico (A), de inactivar al antibiótico (B), y de impedir que actúe sobre su blanco (C).
- Mecanismos para la reducción de la concentración intracelular del antibiótico.
La composición de la membrana y pared celular, como el contenido de peptidoglucanos, fosfolípidos y porinas regula la entrada de los antibióticos, es decir su permeabilidad y difusión (Figura 2‑A1). Además, la bacteria tiene sistemas proteínicos de secreción, llamadas bombas de eflujo, que expulsan sustancias tóxicas fuera de la célula. De esta manera, cuando el antibiótico entra en la célula, la bacteria activa las bombas de eflujo, excretando el antibiótico y reduciendo su concentración intracelular (Figura 2‑A2). Esto resulta en una baja actividad del antibiótico, ya que no puede alcanzar sus moléculas blanco, lo que permite que algunas bacterias sobrevivan y se sigan multiplicando.
- Mecanismos bacterianos para inactivar o inhibir el antibiótico
El mecanismo de inactivación, mediado por enzimas, es considerado más eficiente que los sistemas de secreción, ya que el antibiótico puede ser degradado (Figura 2‑B1). Si el antibiótico es inactivado la eficiencia de un tratamiento será impactanda negativamente. Las bacterias han desarrollado enzimas como las beta-lactamasas que inactivan antibióticos del grupo de los beta-lactámicos al romper el anillo beta-lactámico. Esta resistencia es particularmente preocupante, ya que todos los antibióticos del grupo de los lactámicos contiene dicho anillo, incluso algunos de última generación.
Otro ejemplo de inhibición (Figura 2‑B2) consiste en la adición de un grupo químico al antibiótico, impidiendo que éste interactúe con su blanco. Un ejemplo es la resistencia a las rifampicinas, que pueden ser bloqueadas por las enzimas ADP-ribosiltransferasa y fosfotransferasas, que catalizan la adición de un grupo ADP-ribosa o fosfato al antibiótico, respectivamente. Esto impide que el antibiótico se asocie con la ARN-polimerasa, permitiendo así la transcripción y la división bacteriana.
- Alteración, modificación, protección, mimetización, y expresión del propio blanco de acción del antibiótico
La alteración y modificación del blanco ocurren por mutaciones que resultan en la alteración de una proteína blanco del antibiótico y a la adición de grupos químicos, haciendo ineficiente la unión del antibiótico con su blanco (Figura 2‑C1). Las mutaciones han dirigido gran parte de la divergencia natural en el planeta. Este fenómeno estocástico es común en una población bacteriana en crecimiento, y cuando ocurre en presencia del antibiótico, la célula mutada es seleccionada y la resistencia se establece. Un ejemplo clásico es la resistencia de la proteína de unión a penicilina 3 (PBP-3). Esta enzima es clave durante la elongación bacteriana por su rol en la síntesis de la pared celular. Los antibióticos beta-lactámicos inhiben eficientemente esta enzima. Sin embargo, en presencia de concentraciones sub-inhibitorias del antibiótico, pueden surgir variantes de PBP-3 con una inserción de cuatro aminoácidos. Este cambio induce una alteración conformacional que evita la unión del antibiótico, como ocurre con el antibiótico aztreonam.
La mimetización, por otra parte, implica que la bacteria adquiere un gen alternativo que codifica una proteína similar, pero que no es inhibida por el antibiótico. Un ejemplo histórico fue descrito en la década de 1960 para la bacteria Staphylococcus aureus, una bacteria del microbioma humano que, bajo ciertas condiciones, puede convertirse en patógeno oportunista, causando infecciones respiratorias graves e incluso la muerte. S. aureus posee cuatro genes que codifican diferentes PBPs (proteínas de unión a penicilina), algunas de las cuales ya mostraban resistencia a las penicilinas disponibles en esa época, permitiéndole seguir sintetizando su pared celular.
Para combatir la resistencia a algunas penicilinas, en los años 50 se introdujo la meticilina, una penicilina semi-sintética. Sin embargo, en pocos años surgieron cepas de S. aureus resistentes a meticilina. Al principio se sospechó de mutaciones similares a las mencionadas anteriormente, pero luego se descubrió que estas bacterias habían adquirido un nuevo gen, denominado mecA, que codificaba una variante de PBP llamada PBP-2a. Esta enzima, flanqueada por elementos genéticos móviles, fue incorporada mediante transferencia horizontal desde otra especie. PBP-2a imita la función de las PBPs originales pero no puede ser inhibida por los beta-lactámicos, confiriendo así una resistencia efectiva.
La protección ocurre por adición de un grupo químico (Figura 2‑C2). Algo similar pasa en diversos blancos, como lípidos o enzimas. Un ejemplo es la resistencia a estreptomicina, que inhibe la traducción de proteínas; este antibiótico es ignorado dentro de la célula al adicionarse un grupo metilo al ribosoma.
Otro mecanismo de resistencia es aquella “mediada por expresión”, que se refiere a que la bacteria aumenta la concentración de la proteína blanco, por ejemplo, en vez de producir 10 proteínas produce 100, con lo que el antibiótico se ve limitado y solo se une e inhibe a una fracción de las proteínas, por lo que la función celular se mantiene (Figura 2‑C3).
Una Salud: acción para atender la RAM
Como se ha descrito, la RAM ocurre debido a diferentes mecanismos genéticos bacterianos. La presión selectiva de los antibióticos impulsa la evolución de las bacterias sobrevivientes a bacterias resistentes, e incluso multi-resistentes, a través de los diferentes mecanismos de resistencia que pueden desarrollar. En México aún existen prácticas que contribuyen a generar resistencia, como la automedicación y la falta de control en la venta de antibióticos. ¿Quién no ha escuchado frases como: “¿Fuiste con el doctor que sí receta antibióticos?”, “¡Ya me siento bien! Ya no me terminaré el antibiótico” o “Me sobraron pastillas, ¡las tiraré a la basura!”. Estas acciones derivan en la exposición de bacterias a concentraciones de antibióticos que ejercen presión, y conducen a la aparición de variantes resistentes. Por ejemplo, cuando se administra un antibiótico a alguien que no lo necesita, aún las bacterias benéficas del cuerpo humano pueden desarrollar resistencia. Esta resistencia puede ser transferida después al patógeno cuando se adquiere una infección.
Ante esta situación, la Organización Mundial de la Salud, junto con gobiernos como recientemente el de México, trabajan en implementar un enfoque holístico de salud llamado “Una Salud”. Esta visión integral reconoce que la salud de los seres humanos, los animales domésticos y silvestres, las plantas y el medio ambiente (incluidos los ecosistemas), están íntimamente relacionados y son interdependientes. Por lo tanto, para abordar la salud de estos sistemas, el concepto integra y unifica la eficacia gubernamental, la comunicación, la colaboración y la coordinación, con el objetivo de lograr un equilibrio sostenible y optimizar la salud de las personas, los animales y los ecosistemas.
“Una Salud” además de atender la RAM, también atiende enfermedades relacionadas con estos sistemas, como las enfermedades zoonóticas y tropicales. Además, incluye temas como la seguridad alimentaria y la salud ambiental. Esta capacidad de atención es posible gracias a que el concepto también incluye la investigación, la tecnología y los servicios de laboratorio para comprender mejor las enfermedades y buscar soluciones.
Con este conjunto de acciones, se pretende disminuir la presión selectiva y con ello la velocidad con la que se fijan las mutaciones que originan la RAM o mitigar sus efectos adversos. Por ejemplo, en China, el gobierno prohibió el uso de un antibiótico (colistina) usado como promotor de crecimiento en plantas de interés agronómico. Como resultado, en solo dos años, la presencia del gen de resistencia a colistina (mcr-1) en la bacteria Escherichia coli, presente en cerdos, humanos y muestras ambientales, disminuyó del 45% al 19% (Pitt & Gunn, 2024).
También dentro de las estrategias de combate, se incluye la investigación científica que permite comprender el origen, la emergencia, la diseminación y la evolución de los genes de resistencia. Además, es necesario implementar una vigilancia epidemiológica que monitoree las variantes resistentes en hospitales, el medio ambiente y los animales.
A nivel gubernamental, se aplican diversas estrategias, como el control de la prescripción de antibióticos, la regulación de su uso en la agricultura y la ganadería, así como la realización de campañas de concientización, entre otras. La eficacia de estas acciones requiere un esfuerzo conjunto, ya que solo mediante un enfoque colaborativo en la lucha contra la resistencia a los antibióticos puede protegerse la salud global y preservar la eficacia de estos medicamentos para las generaciones futuras.
Conclusiones y perspectivas
Los antibióticos combaten las infecciones al impedir la sobrevivencia y reproducción de las bacterias. Es importante recalcar que un antibiótico mata indiscriminadamente a las bacterias patógenas y a las benéficas. Sin embargo, las bacterias pueden desarrollar múltiples mecanismos de resistencia simultáneamente, creando un problema de multi‑resistencia. El uso racional de antibióticos y su administración solo cuando sea necesario es una medida inicial crucial.
El conocimiento de la diversidad de mecanismos de RAM ha generado desafíos económicos, especialmente en el sector farmacéutico. Encontrar un antibiótico funcional puede ser factible, pero la rápida aparición de resistencia puede hacerlo menos rentable. La inteligencia artificial se perfila como una herramienta clave para reducir costos mediante predicciones funcionales precisas que permitan identificar nuevos antibióticos.
Otra estrategia para combatir la RAM es el uso de bacteriófagos, virus que infectan a bacterias. Buscar alternativas que complementen a los antibióticos existentes es esencial. Finalmente, el estudio de las interacciones entre comunidades de bacterias ante la presencia de un antibiótico es de suma importancia para entender como la RAM ocurre en la naturaleza y por qué algunas bacterias se vuelven más resistentes que otras, tal vez descubriendo las señales entre las bacterias de las comunidades para mediar esta resistencia. Es también importante buscar intervenciones inmediatas para identificar al patógeno y saber si está siendo efectivo un tratamiento. Tal vez utilizar a una bacteria para antagonizar de manera específica a otra. En conclusión, buscar nuevas estrategias diferentes a solo hacer explotar la bomba de antibiótico en la comunidad a fin de combatir la RAM de forma más estratégica.
Referencias
D’Costa, V. M., McGrann, K. M., Hughes, D. W., & Wright, G. D. (2006). Sampling the antibiotic resistome. Science (New York, N.Y.), 311(5759), 374–377. https://doi.org/10.1126/science.1120800
Darby, E. M., Trampari, E., Siasat, P., Gaya, M. S., Alav, I., Webber, M. A., & Blair, J. M. A. (2023). Molecular mechanisms of antibiotic resistance revisited. Nature reviews. Microbiology, 21(5), 280–295. https://doi.org/10.1038/s41579-022-00820-y
Errecalde, J. O. (2004). Uso de antimicrobianos en animales de consumo. https://www.sidalc.net/search/Record/dig-fao-it-20.500.14283-Y5468S/Description
Kapoor, G., Saigal, S., & Elongavan, A. (2017). Action and resistance mechanisms of antibiotics: A guide for clinicians. Journal of anaesthesiology, clinical pharmacology, 33(3), 300–305. https://doi.org/10.4103/joacp.JOACP_349_15
Kim, D. W., & Cha, C. J. (2021). Antibiotic resistome from the One-Health perspective: understanding and controlling antimicrobial resistance transmission. Experimental & molecular medicine, 53(3), 301–309. https://doi.org/10.1038/s12276-021-00569-z
Pitt, S. J., & Gunn, A. (2024). The one health concept. British Journal of Biomedical Science, 81, 12366.
*Foto de portada creada con la ayuda de ChatGPT













