El viaje de la sanación y la esperanza
En la primera línea de la cita de Angelina Jolie se lee: “El cáncer sigue siendo una palabra que infunde miedo en los corazones de las personas, produciendo una profunda sensación de impotencia…”
El cáncer es una enfermedad compleja y progresivamente agresiva, que avanza por distintas etapas como la resistencia a la apoptosis, el crecimiento descontrolado, las alteraciones de la señalización, la invasión, la metástasis y la angiogénesis. Inicialmente localizada, puede extenderse a áreas distantes, complicando el tratamiento.
De acuerdo con GLOBOCAN 2022, los nuevos casos de cáncer superaron los 19.9 millones en el mundo con 9.6 millones de decesos; es la tercera causa de decesos en México, y la OMS proyecta hasta 30 millones de fallecimientos anuales relacionados con el cáncer en 2030. Los factores que contribuyen a esta enfermedad incluyen la contaminación, la radiación, el estilo de vida, la dieta y las infecciones, especialmente en las regiones en desarrollo, que pueden causar mutaciones del ADN y promover neoplasias malignas impulsadas por oncogenes (Bray et al., 2020).
Los tratamientos estándar contra el cáncer, como la quimioterapia, la cirugía y la radiación, a menudo están limitados por la falta de especificidad y su toxicidad. Los avances en medicina se enfocan en maximizar la eficacia de los fármacos y minimizar los efectos secundarios, con el objetivo de lograr una alta concentración de éstos en los sitios tumorales, sin afectar al tejido sano. La nanotecnología es prometedora en este sentido, ya que podría reducir la dosis necesaria de fármacos y aumentar la concentración terapéutica específicamente en los sitios de cáncer.
Como lo define la Iniciativa Nacional de Nanotecnología de Estados Unidos, la nanotecnología es el estudio de materiales a escala nanométrica (1-100 nm), aprovechando propiedades únicas para mejorar aplicaciones en el ámbito de la salud. Desde la década de 1980, este campo ha avanzado rápidamente y se están desarrollando activamente terapias y diagnósticos basados en la nanotecnología utilizando diferentes tipos de nanopartículas (Figura 1), lo que implica un gran potencial para transformar el tratamiento y el diagnóstico del cáncer.
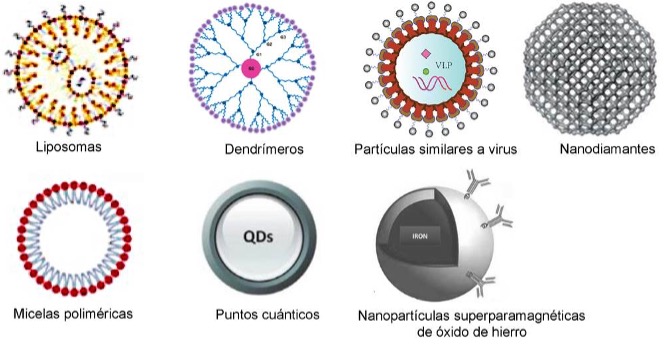
Dentro de los nanomateriales se encuentran:
Los liposomas: Vesículas esféricas compuestas por bicapas fosfolipídicas que pueden encapsular tanto fármacos hidrófilos en su núcleo acuoso como fármacos hidrófobos dentro de la bicapa lipídica, transportadores que permiten una mejor biodisponibilidad, una circulación prolongada y una menor toxicidad inespecífica de los fármacos que acarrean (Abbasi et al., 2022). Su superficie también puede modificarse con ligandos para lograr una acción dirigida activa sobre las células cancerosas (Nsairat et al., 2022), y varias formulaciones liposomales, como el Doxil®, han recibido aprobación clínica.
Los dendrímeros: Macromoléculas altamente ramificadas con una alta densidad de grupos funcionales superficiales, lo que permite la conjugación de múltiples moléculas de fármacos, agentes de imagen o ligandos de acción dirigida. Pueden diseñarse para responder a factores ambientales como el pH o las enzimas (Sherje et al., 2018).
Las micelas poliméricas: Estructuras formadas por autoensamblaje de copolímeros anfifílicos en entornos acuosos. Presentan un núcleo hidrófobo como reservorio de fármacos poco solubles en agua, y una capa hidrófila que proporciona estabilidad en la circulación (Bawankar et al., 2025).
Las partículas similares a virus (VLP): Estructuras derivadas de las proteínas de la cápside viral que imitan la morfología de los virus. Permiten pesentar varios antígenos o ligandos que estimulan respuestas inmunitarias robustas (Chen and Lai, 2012).
Los nanodiamantes: Nanopartículas basadas en carbono con un núcleo cristalino similar al diamante y una gran área superficial, ideales para adsorber y administrar diversos fármacos. Sus propiedades únicas incluyen una alta biocompatibilidad, estabilidad química y la capacidad de superar la resistencia a múltiples fármacos al evadir a los canales transportadores de eliminación (multidrug resistance proteins; MDRP). Los nanodiamantes pueden mejorar la retención de fármacos dentro de las células tumorales y han demostrado su capacidad para actuar sobre orgánulos intracelulares, como las mitocondrias, contribuyendo a la apoptosis de las células cancerosas con mínima toxicidad sistémica (Chauhan et al., 2020; Priyadarshni et al., 2024).
Las nanopartículas superparamagnéticas de óxido de hierro (SPION): Partículas de óxido de hierro que exhiben magnetismo únicamente en presencia de un campo magnético externo, por lo que pueden ser guiadas a los tumores mediante campos magnéticos. También funcionan como agentes de contraste en la resonancia magnética en el diagnóstico y tratamiento simultáneos del cáncer (Teranósticos) (Wahajuddin et al., 2012).
Los puntos cuánticos (QD): Nanocristales semiconductores fluorescentes con un diámetro típico de entre 2 y 10 nm que presentan propiedades ópticas únicas que se ajustan a su tamaño debido al confinamiento cuántico. Su amplio espectro de excitación, estrechas bandas de emisión, alta fotoestabilidad y excepcional brillo los hacen superiores a los fluoróforos orgánicos. Los QD pueden funcionalizarse con ligandos como péptidos, anticuerpos o aptámeros para dirigirse a células específicas. Además, su compatibilidad con modelos in vitro e in vivo permite aplicaciones diagnósticas y terapéuticas avanzadas, como la cirugía guiada por imagen y la terapia fotodinámica (Reshma and Mohanan, 2019).
El tiro con arco de precisión: cómo la nanotecnología ataca a las células cancerosas
Las propiedades distintivas de las nanopartículas, sus estructuras, formas y tamaños diversos permiten aumentar la capacidad de administrar compuestos hidrófobos, la focalización en tejidos y la ampliación del tiempo de circulación del fármaco en el organismo. También mejoran la penetración y la retención del fármaco en los sitios tumorales, ayudan a superar la resistencia celular a los fármacos, aumentan la seguridad y la tolerabilidad de los tratamientos.
En la terapia contra el cáncer, la nanotecnología ha ganado atención por su potencial para mejorar la administración dirigida de fármacos y superar las limitaciones de la quimioterapia tradicional (Resistencia a los fármacos, Vascularización deficiente, Presión intersticial elevada).
Los objetivos principales de la nanotecnología en la administración de fármacos son: garantizar una orientación precisa, minimizar la toxicidad, mantener los efectos terapéuticos y mejorar la estabilidad, la seguridad y la compatibilidad de los fármacos. Las consideraciones clave a la hora de elegir nanopartículas como sistemas de administración incluyen la captación del fármaco, los mecanismos de liberación, la estabilidad, la biocompatibilidad, la biodistribución y el modo de acción.
Un faro de esperanza: historias de éxito y aplicaciones en el tratamiento del cáncer
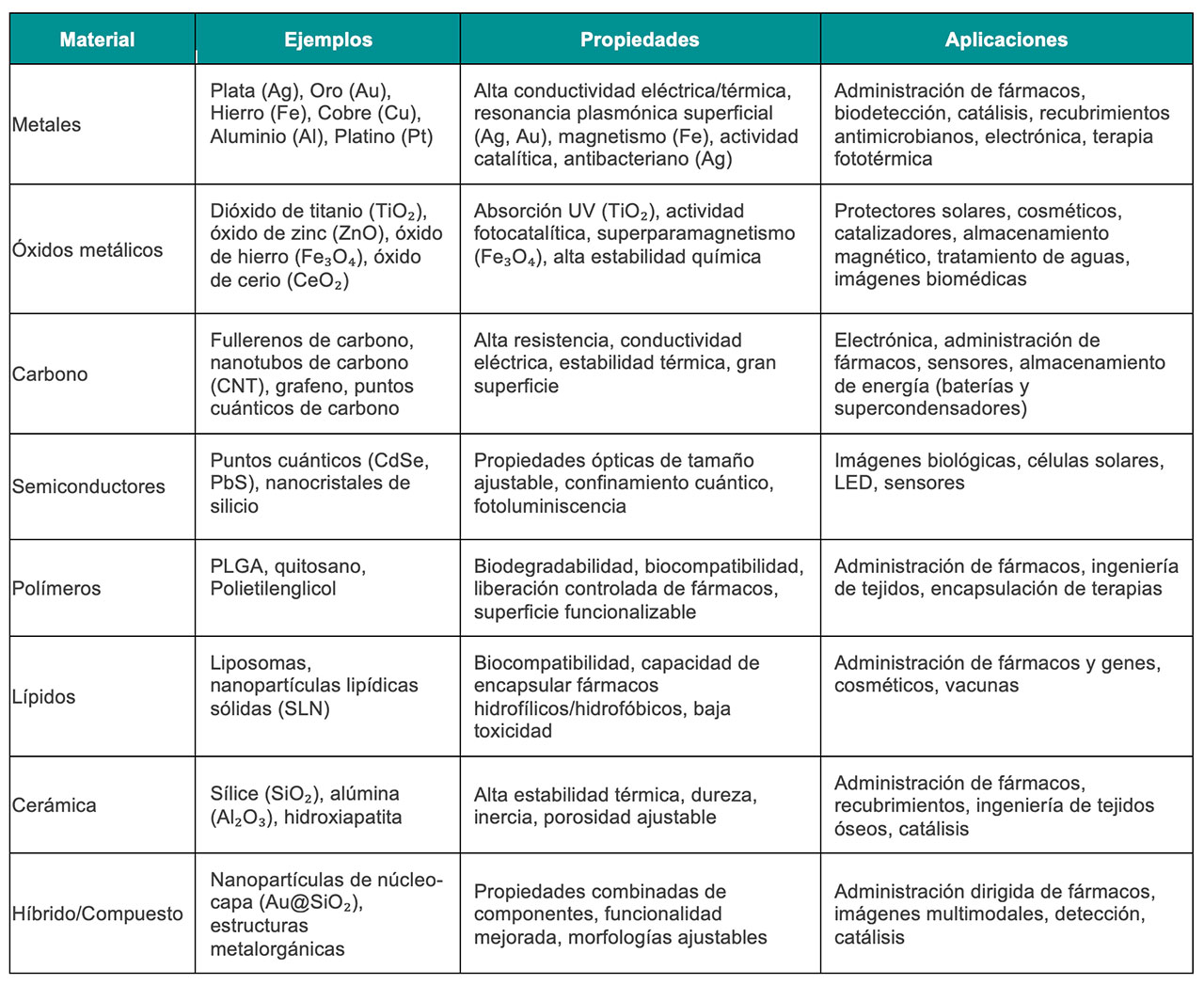
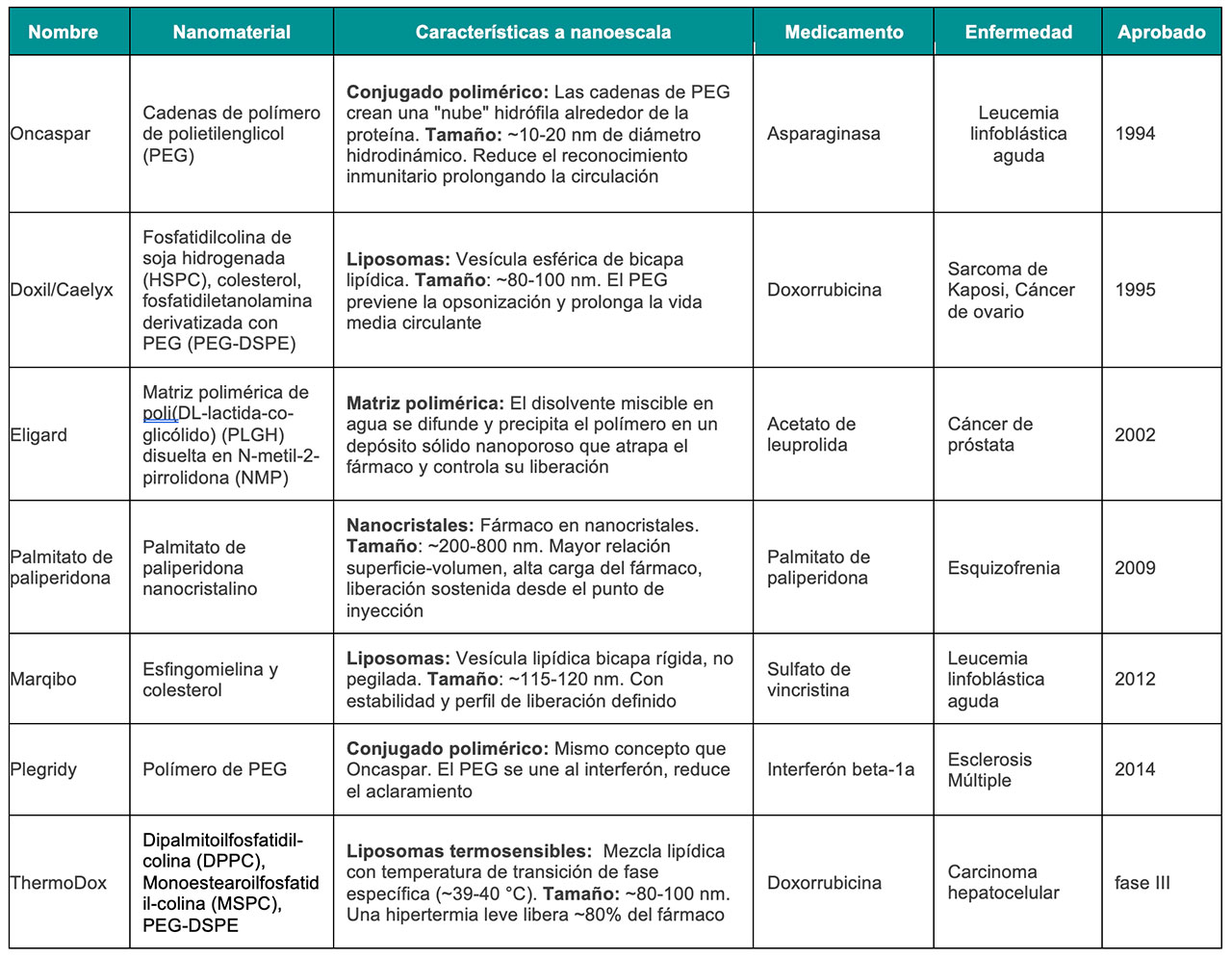
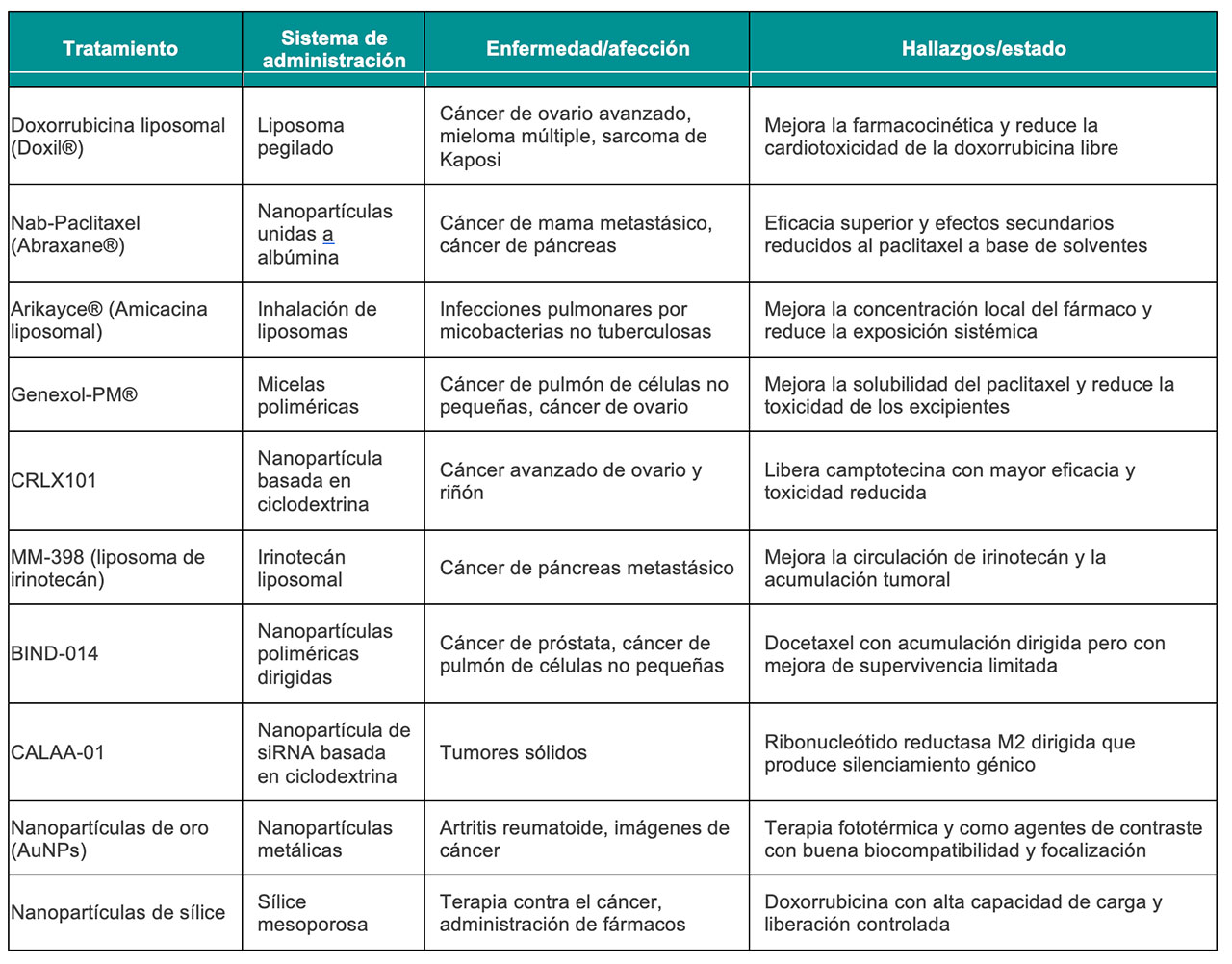
Se ha utilizado una amplia gama de nanomateriales para desarrollar diversas nanoformulaciones, como se resume en la Tabla 1. Sin embargo, solo un número limitado de estas formulaciones han obtenido la aprobación de la Food and Drug Administration (FDA) de Estados Unidos de América para ser utilizadas como tratamiento de diversas enfermedades (Tabla 2).
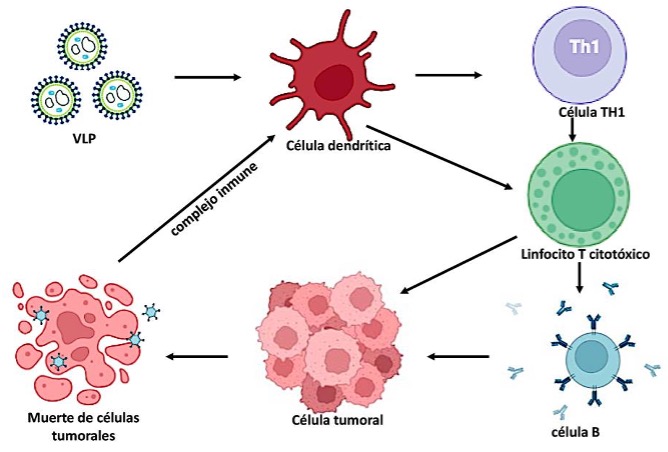
La tecnología más reciente se basa en utilizar nanopartículas virales que aprovechan los mecanismos celulares del huésped para autoensamblarse y pueden adaptarse para lograr una administración precisa de medicamentos. Las modificaciones como la PEGilación, mejoran la estabilidad y prolongan la circulación de las VLP. Un ejemplo de éstas son las VLP derivadas del virus del mosaico del caupí que no contienen material genético dañino y son seguras (Steinmetz, 2010). Al introducir las VLP directamente en los tumores se puede activar al sistema inmunológico para combatir a las células cancerosas sin la necesidad de medicamentos incorporados, lo que proporciona un enfoque no tóxico para impedir la propagación del tumor mediante la activación del sistema inmune del individuo. Esto se logra cuando las VLP introducidas en el microambiente tumoral, se reconocen y se internalizan por las células dendríticas (CD; células presentadoras de antígenos), a través de receptores de reconocimiento de patrones (RRP) del tipo Toll (TLR) (Figura 2). Una vez activadas, las CD maduras procesan las VLP y presentan sus epítopos a los linfocitos T cooperadores (Th1). Los linfocitos Th1 secretan interferón-γ e interleucina 2, que favorecen la activación y expansión de los linfocitos T citotóxicos, que son las principales células efectoras responsables de la lisis y muerte de las células tumorales. También promueven la activación y diferenciación de los linfocitos B a células plasmáticas que producen anticuerpos específicos contra el tumor, contribuyendo así a la respuesta inmunitaria humoral y a la citotoxicidad celular dependiente de anticuerpos (Zepeda-Cervantes et al., 2020; Kim et al., 2023).
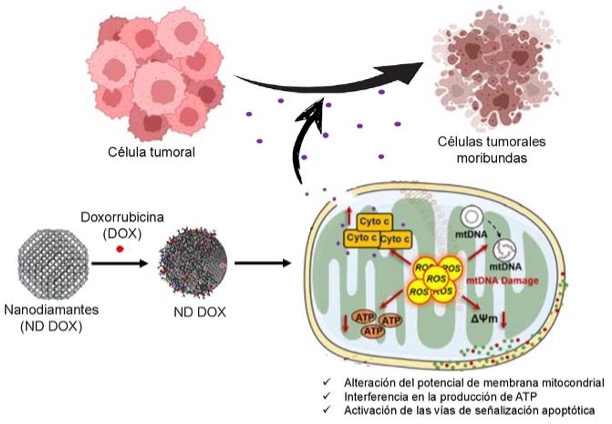
Los nanodiamantes son nanopartículas ultrapequeñas basadas en carbono con una gran superficie y abundantes grupos funcionales (como grupos carboxilo, hidroxilo y cetona) que permiten acarrear agentes quimioterapéuticos mediante adsorción física o unión covalente. Esto facilita la carga estable y eficiente de fármacos hidrófobos que, de otro modo, presentan baja solubilidad o estabilidad sistémica, como la doxorrubicina.
Una vez administrados los nanodiamantes cargados con un fármaco, éstos alcanzan el microambiente tumoral y las células cancerosas los endocitan (Figura 3). Los nanodiamantes pueden acumularse en las mitocondrias y alteran el potencial de membrana mitocondrial e interfieren con la producción de ATP. Esto provoca el agotamiento energético, la activación de las vías de señalización apoptóticas y, en última instancia, la muerte de las células tumorales (Benson and Amini, 2020; Chan et al., 2017).
A pesar de estos avances, es importante seguir realizando esfuerzos para mejorar la eficacia de la quimioterapia y, al mismo tiempo, minimizar sus efectos adversos. En colaboración con el Departamento de Física del campus Zacatenco, la Unidad Monterrey del CINVESTAV y otras instituciones de investigación, se desarrollan SPIONs conjugadas con ácido 6-pentadecil salicílico (6SA) y formulaciones de nanogotas y polímeros. Estas formulaciones están diseñadas para administrar 6SA (agente natural con actividad antineoplásica) en modelos animales de tumores de mama y de colon, logrando amplificar los efectos antineoplásicos y antimetastásicos del 6SA.
Guiados por la luz: mecanismos de la nanotecnología en la administración de fármacos
La administración de fármacos utilizando la nanotecnología se basa en dos mecanismos principales para llegar al tejido tumoral: la focalización pasiva y la activa (Figura 4).
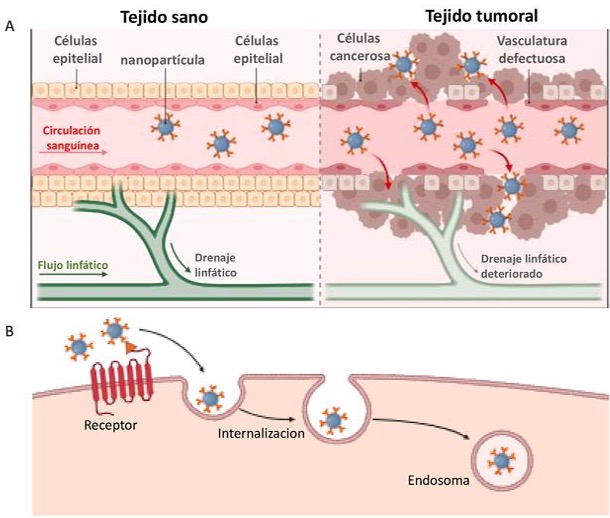
Como se ve en la figura 4, la focalización pasiva aprovecha las características estructurales y funcionales anormales de la vascularización tumoral, un fenómeno conocido como efecto de Permeabilidad y Retención Mejoradas (EPR). A diferencia de los vasos sanguíneos normales, la vascularización tumoral suele ser desorganizada, irregular y presenta uniones endoteliales más anchas (normalmente de 100 a 800 nm), lo que resulta en una mayor permeabilidad vascular y extravasación de nanopartículas, generalmente menores a 200 nm, al microambiente tumoral. Además, los tumores suelen carecer de un drenaje linfático eficiente, lo que dificulta la eliminación del líquido intersticial y las macromoléculas, permitiendo que las nanopartículas se retengan durante períodos prolongados en el intersticio tumoral (Figura 4A).
Esta acumulación pasiva se potencia aún más cuando las nanopartículas se diseñan para permanecer tiempos prolongados en circulación. Una de las estrategias más eficaces para lograrlo es la modificación de la superficie con polietilenglicol (PEG), un polímero hidrófilo que crea una barrera estérica alrededor de la nanopartícula, reduciendo la opsonización por las proteínas plasmáticas y el reconocimiento por el sistema fagocítico mononuclear (SFM) (también conocido como sistema reticuloendotelial). Como resultado, las nanopartículas pegiladas, como los liposomas (p. ej., Doxil), las micelas poliméricas y las nanopartículas superparamagnéticas de óxido de hierro (SPIONs), presentan una circulación sistémica significativamente prolongada, lo que aumenta la probabilidad de acumulación tumoral a través de múltiples pasos en el torrente sanguíneo.
Cabe destacar que el efecto EPR es más pronunciado en tumores sólidos con una vascularización de rápida proliferación, pero su magnitud puede variar según el tipo y ubicación del tumor y la fisiología individual del paciente. Las regiones hipóxicas y necróticas dentro de los tumores también influyen en la distribución de las nanopartículas, y los gradientes de presión intratumoral pueden afectar la profundidad de penetración. Para abordar estas limitaciones, los investigadores están desarrollando sistemas sensibles a estímulos (p. ej., nanopartículas sensibles al pH, la temperatura o a algunas enzimas) para mejorar la eficacia terapéutica de los nanotransportadores de focalización pasiva.
En general, la focalización pasiva mediante el efecto EPR proporciona una vía de administración no invasiva y selectiva hacia el tumor, lo que permite aumentar la concentración terapéutica de agentes anticancerígenos en el sitio del tumor, a la vez que minimiza la exposición sistémica y la toxicidad asociada al antineoplásico. Sin embargo, la heterogeneidad del efecto EPR en tumores clínicos requiere el desarrollo de estrategias complementarias, como la focalización activa o los estímulos externos, para mejorar la eficiencia de la administración y los resultados terapéuticos.
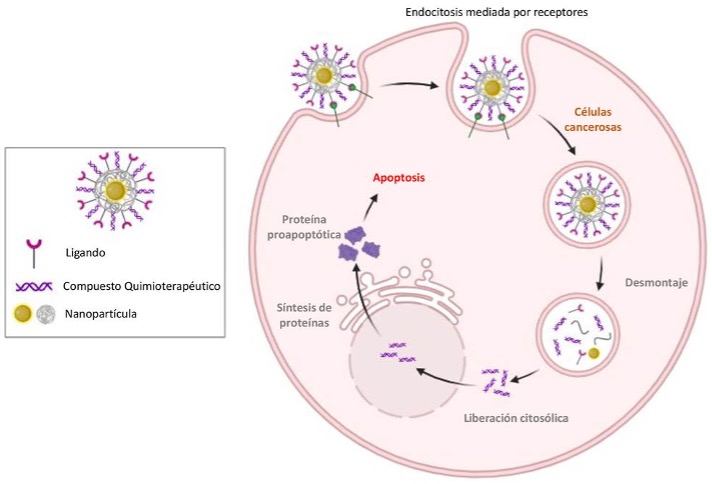
A diferencia de la focalización pasiva, la focalización activa implica la modificación deliberada de las superficies de las nanopartículas con ligandos biológicamente específicos que permiten el reconocimiento y la unión precisos a marcadores moleculares sobreexpresados en las células cancerosas (Figura 4B). Estos ligandos pueden incluir anticuerpos monoclonales, péptidos, aptámeros o moléculas pequeñas como el ácido fólico, que se seleccionan por su alta afinidad por receptores específicos asociados a tumores. Entre los receptores diana comúnmente se encuentran los receptores de folato, los receptores de transferrina y los receptores del factor de crecimiento epidérmico (EGFR), cada uno de los cuales se sabe que aumenta su expresión en diversas neoplasias malignas, como el cáncer de mama, el cáncer de ovario y el cáncer cerebral.
Una vez que las nanopartículas funcionalizadas con ligando alcanzan el microambiente tumoral, la unión ligando-receptor desencadena la endocitosis mediada por receptor, un proceso mediante el cual la nanopartícula se internaliza en la célula cancerosa a través de vías de tráfico vesicular (Figura 5). Esta mayor captación celular no solo mejora la biodisponibilidad intracelular de la carga terapéutica, sino que también ayuda a eludir los mecanismos de resistencia a múltiples fármacos (MDR) al facilitar la acumulación del compuesto en las células tumorales. Este mecanismo garantiza la selectividad espacial y molecular, reduciendo así la toxicidad sistémica y mejorando la eficacia terapéutica. Como se ilustra en la Figura 5, las nanopartículas pueden estar cubiertas con anticuerpos de superficie que actúan como moléculas diana y confieren especificidad hacia las células tumorales. Estos anticuerpos imitan las interacciones ligando-receptor, lo que permite que las nanopartículas se dirijan activamente al tejido canceroso sin afectar a las células sanas (Adetuyi and Vega, 2024).
Entre estas plataformas nanotransportadoras las SPIONs representan una herramienta multifuncional en la nanomedicina oncológica. Gracias a su comportamiento superparamagnético, las SPIONs pueden guiarse a tejidos específicos mediante un campo magnético externo, una estrategia conocida como focalización magnética. Esta estrategia aumenta la acumulación local de las nanopartículas en el sitio del tumor, lo que incrementa el potencial terapéutico y reduce los efectos no deseados potenciales de los fármacos.
Además, las SPIONs pueden diseñarse simultáneamente para usarse en la focalización activa mediada por ligando, mediante la conjugación de sus superficies con anticuerpos o péptidos, y para administrar fármacos, mediante la encapsulación o unión de agentes citotóxicos. Esto da como resultado una estrategia de doble focalización, que combina la acumulación pasiva mediante el efecto EPR con la internalización activa mediada por el receptor, sinergizando la precisión de la administración y la eficacia terapéutica.
Por otro lado, las SPIONs poseen capacidades inherentes para usar como agentes de contraste en resonancia magnética (RM) ponderados en T2. En esta técnica de imagen, se resaltan las diferencias en el tiempo de relajación transversal (T2) de los tejidos, y los SPION inducen una reducción en las señales de T2 que aparecen como regiones hipointensas (oscurecidas). Esta capacidad permitiendo el seguimiento en tiempo real de la distribución y acumulación de nanopartículas en el organismo. Esto posiciona a las SPIONs a la vanguardia de la teranóstica, un campo que combina terapia y diagnóstico en una única plataforma, con un enfoque de última generación, aprovechando tanto la especificidad biológica de la focalización activa como el potencial de control físico de la focalización magnética, a la vez que permiten la terapia guiada por imagen para lograr un tratamiento oncológico integral y preciso.
El futuro de la medicina de precisión: superando los desafíos
La nanotecnología surge como una herramienta revolucionaria en el diagnóstico y tratamiento del cáncer, ofreciendo ventajas únicas que podrían mejorar drásticamente las terapias convencionales como el tratamiento fototérmico. Si bien hay un progreso considerable en este campo, solo unos pocos tratamientos basados en la nanotecnología han avanzado hasta la etapa de ensayos clínicos como se muestra en la tabla 3, lo que acentúa los desafíos que implica trasladar estas innovaciones de la investigación a las aplicaciones en el mundo real.
El camino hacia la integración de la nanotecnología en las prácticas terapéuticas está plagado de obstáculos, en particular para garantizar resultados consistentes y reproducibles, un requisito clave para cualquier aplicación clínica.
Una de las principales preocupaciones en la implementación de la terapia basada en la nanotecnología es la confiabilidad de estas intervenciones a escala nanométrica. Para superar estos retos, los esfuerzos de investigación continuos y colaborativos son fundamentales, especialmente cuando se traduce el éxito del laboratorio en herramientas de diagnóstico confiables.
Otra barrera importante en la adopción generalizada de estas nuevas terapias es la toxicidad de las nanopartículas. La seguridad de las nanopartículas varía según sus características físicas y químicas, como el tamaño, la forma, la carga, la composición de la superficie y los ligandos específicos del objetivo. Antes de su uso clínico, es imprescindible examinar a fondo la biodistribución, la biodegradabilidad, la farmacocinética y la toxicocinética de las nanopartículas para minimizar los posibles riesgos y garantizar resultados terapéuticos seguros.
De cara al futuro, la traducción de la nanotecnología de la investigación de laboratorio en herramientas clínicas efectivas, requiere más estudios controlados a largo plazo para comprender y superar completamente sus limitaciones. Hacer realidad el potencial clínico de la nanotecnología para utilizarse en la administración dirigida de fármacos requiere un enfoque multidisciplinario, que combine conocimientos de campos como la oncología, la ciencia de los materiales, la farmacología y la toxicología. Es fundamental realizar esfuerzos de investigación sólidos y exhaustivos para abordar estas limitaciones y permitir la aplicación confiable de la nanotecnología en el tratamiento contra el cáncer.
Conclusión: flechas guía, esperanza renovada
La nanotecnología ha demostrado ser muy prometedora en el avance del diagnóstico y el tratamiento contra el cáncer, ofreciendo una mayor sensibilidad, especificidad y capacidades multifuncionales que están más allá del alcance de los métodos tradicionales. Al permitir la administración dirigida de fármacos, la nanotecnología tiene potencial para desarrollar terapias contra el cáncer más personalizadas y efectivas, mejorando significativamente la calidad de vida de los pacientes. Es necesario abordar desafíos como la toxicidad, la reproducibilidad y los obstáculos regulatorios antes de que estas innovaciones puedan adoptarse ampliamente en los entornos clínicos. La investigación continua y la colaboración multidisciplinaria también son esenciales para superar estas barreras, lo que, en última instancia, permitirá que la nanotecnología alcance su potencial de revolucionar el tratamiento contra el cáncer.
Referencia
Abbasi, H., Kouchak, M., Mirveis, Z., Hajipour, F., Khodarahmi, M., Rahbar, N., Handali, S. (2023). What we need to know about liposomes as drug nanocarriers: An updated review. Adv Pharm Bull, 13(1), 7-23. doi: 10.34172/apb.2023.009
Adetuyi, BO., and Vega, L (2024). Advances in nanocarrier-mediated drug delivery: precision strategies for targeted therapies and improved treatment outcomes. Interdisciplinary Cancer Research, Springer International Publishing. Doi:10.1007/16833_2024_239
Bawankar, D., Atram, S., Mandve, V., Bhonde, A., Puri, A. (2025). Polymeric micelles: A review. Asian J Pharm Res Dev, 13(3), 120-130. doi: 10.22270/ajprd.v13i3.1565
Benson, V., Amini, A. (2020). Why nanodiamond carriers manage to overcome drug resistance in cancer. Cancer Drug Resist, 3(4), 854-866. doi: 10.20517/cdr.2020.52
Bray, F., Ferlay, J., Soerjomataram, I., Siegel, R., Torre, L., and Jemal, A (2020). Erratum: Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer Journal for Clinicians, 70(4), 313.
Chan, MS., Liu, LS., Leung, HM., and Lo, PK. (2017). Cancer-cell-specific mitochondria-targeted drug delivery by dual-ligand-functionalized nanodiamonds circumvent drug resistance. ACS Applied Materials & Interfaces, 9(13), 11780–11789. Doi:10.1021/acsami.6b15954
Chauhan, S., Jain, N., Nagaich, U. (2020). Nanodiamonds with powerful ability for drug delivery and biomedical applications: Recent updates on in vivo study and patents. J Pharm Anal, 10(1), 1-12. doi: 10.1016/j.jpha.2019.09.003
Chehelgerdi, M., Chehelgerdi, M., Allela, O.Q.B., Pecho, R.D.C., Jayasankar, N., Rao, D.P., Thamaraikani, T., Vasanthan, M., Viktor, P., Lakshmaiya, N., Saadh, M.J., Amajd, A., Abo-Zaid, M.A., Castillo-Acobo, R.Y., Ismail, A.H., Amin, A.H., Akhavan-Sigari, R. (2023). Progressing nanotechnology to improve targeted cancer treatment: Overcoming hurdles in its clinical implementation. Mol Cancer, 22(1), 169. doi: 10.1186/s12943-023-01865-0
Chen, Q., Lai, H. (2013). Plant-derived virus-like particles as vaccines. Hum Vaccin Immunother, 9(1), 26-49. doi: 10.4161/hv.22218
Kim, KR., Lee, AS., Kim, SM., Heo, HR., Kim, CS (2023). Virus-like nanoparticles as a theranostic platform for cancer. Front Bioeng Biotechnol, 12(10),1106767. doi: 10.3389/fbioe.2022.1106767.
Li, Y., Zhu, X., Zhang H, Lu, Y., Zeng, T., Liu, H., Li, T., Wang, T., Tang, L (2023). Nanodiamond in cancer theranostics. Nano TransMed, 2(1), e9130019. https://doi.org/10.26599/NTM.2023.9130019
Nsairat, H., Khater, D., Sayed, U., Odeh, F., Al Bawab, A., Alshaer, W. (2022). Liposomes: Structure, composition, types, and clinical applications. Heliyon, 8(5), e09394. doi: 10.1016/j.heliyon.2022.e09394
Priyadarshni, N., Singh, R., Mishra, M.K. (2024). Nanodiamonds: Next generation nano-theranostics for cancer therapy. Cancer Lett, 587, 216710. doi: 10.1016/j.canlet.2024.216710
Reshma, V.G., Mohanan, P.V. (2019). Quantum dots: Applications and safety consequences. J Lumin, 205, 287-298. doi: 10.1016/j.jlumin.2018.09.015
Sherje, A.P., Jadhav, M., Dravyakar, B.R., Kadam, D. (2018). Dendrimers: A versatile nanocarrier for drug delivery and targeting. Int J Pharm, 548(1), 707-720. doi: 10.1016/j.ijpharm.2018.07.030
Steinmetz, N.F. (2010). Viral nanoparticles as platforms for next-generation therapeutics and imaging devices. Nanomedicine, 6(5), 634-641. doi: 10.1016/j.nano.2010.04.005
Wahajuddin, Arora, S. (2012). Superparamagnetic iron oxide nanoparticles: Magnetic nanoplatforms as drug carriers. Int J Nanomedicine, 7, 3445-3471. doi: 10.2147/IJN.S30320
Zepeda-Cervantes, J., Ramírez-Jarquín, J.O., Vaca, L. (2020). Interaction between virus-like particles (VLPs) and pattern recognition receptors (PRRs) from dendritic cells (DCs): Toward better engineering of VLPs. Front Immunol, 11, 1100. doi: 10.3389/fimmu.2020.01100
*Foto de portada creada con Chat GPT