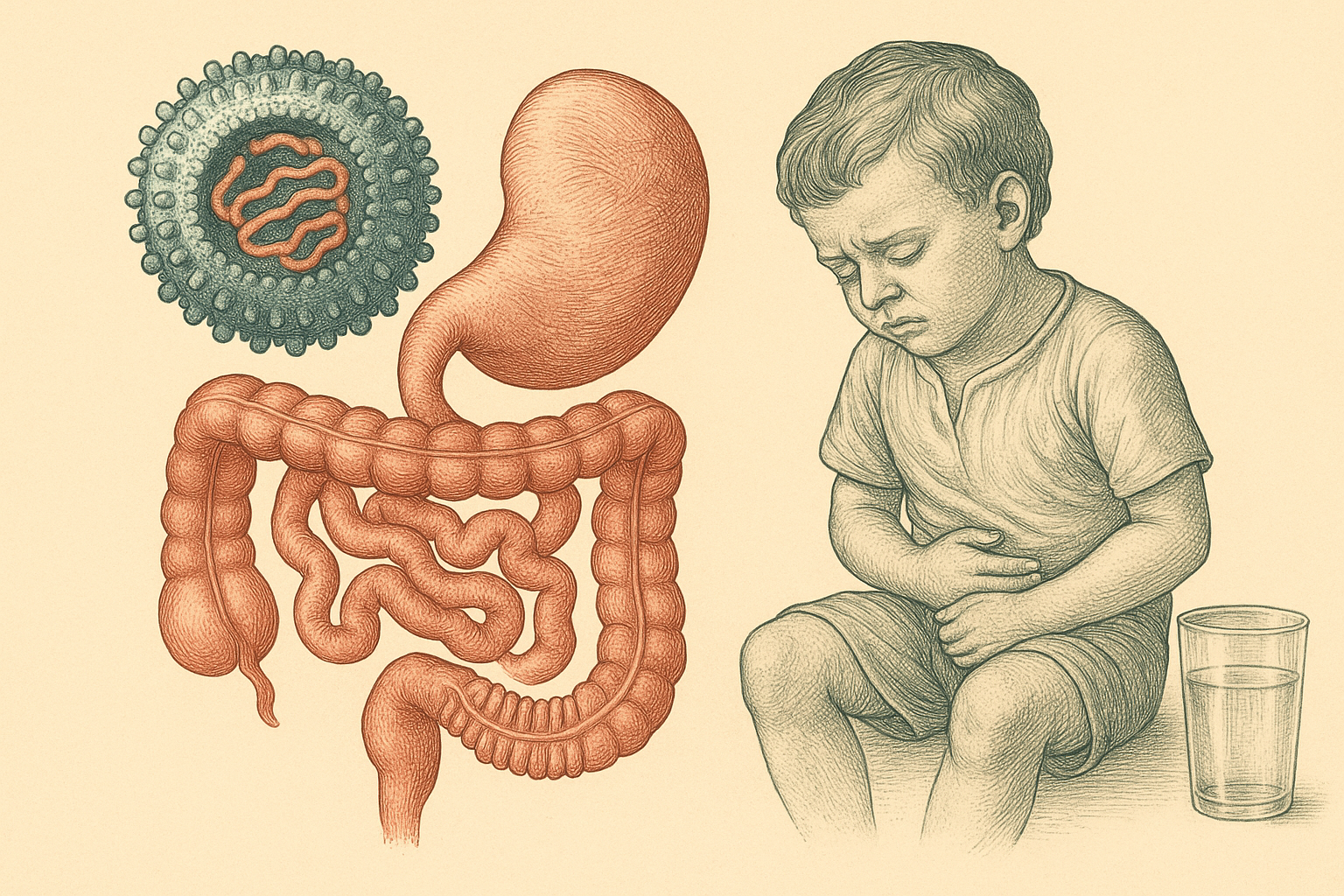
La gastroenteritis es una inflamación del revestimiento del estómago y los intestinos que provoca enfermedades diarreicas, a menudo debilitantes (Organización Mundial de la Salud, 2024). La diarrea, síntoma característico de esta afección, puede persistir durante varios días, causando una pérdida significativa de agua y sales esenciales para el correcto funcionamiento del organismo. Las complicaciones más graves incluyen la deshidratación severa, que puede ser fatal si no se trata a tiempo (Organización Mundial de la Salud, 2024). De acuerdo con la Organización Mundial de la Salud, las enfermedades diarreicas son la tercera causa de muerte en niños menores de cinco años a nivel mundial, cobrando la vida de más de 400,000 infantes al año.
Los rotavirus son uno de los principales agentes causantes de gastroenteritis en niños menores de cinco años. Estos virus pertenecen a la familia Sedoreoviridae, y cuentan con un genoma compuesto por 11 segmentos de RNA de doble cadena. Cada uno de estos segmentos codifica proteínas que desempeñan funciones vitales en el ciclo de replicación viral.
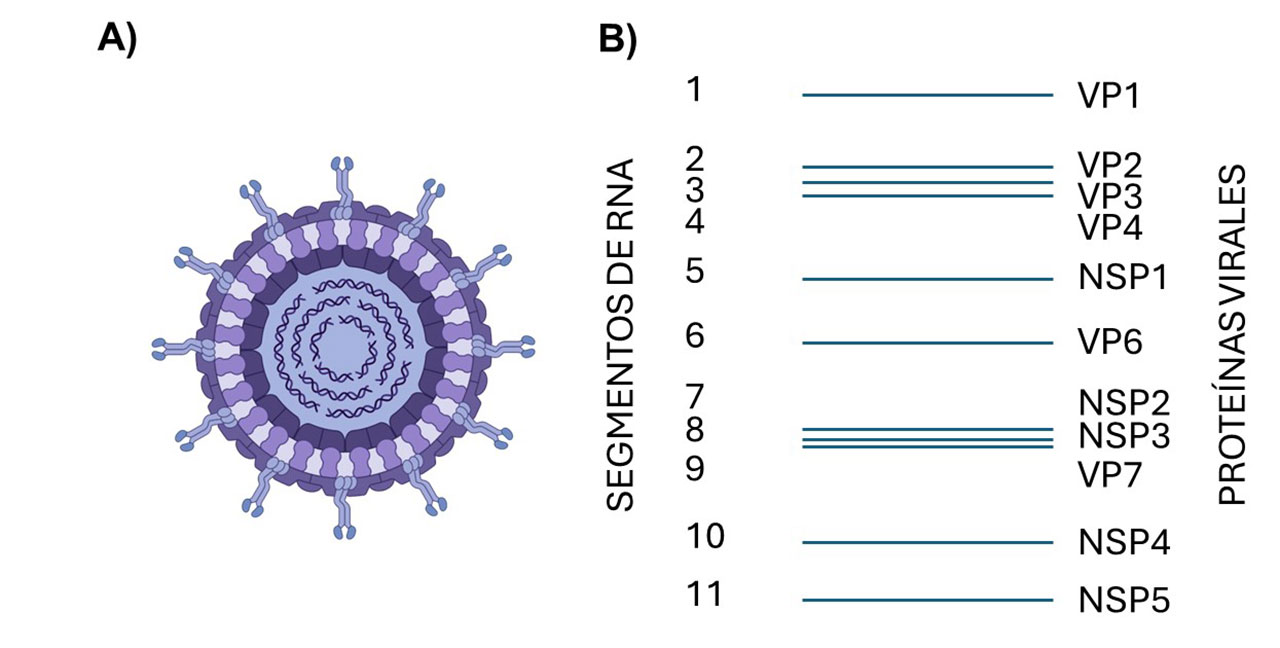
Las proteínas no estructurales, como NSP1, NSP2, NSP3, NSP4 y NSP5, son responsables de regular el metabolismo celular y formar las “fábricas virales”, donde ocurre la replicación del genoma viral. Por otro lado, las proteínas estructurales VP1, VP2, VP3, VP4, VP6 y VP7 constituyen la cápside del virus, una estructura que protege al genoma viral y permite la infección de las células (Crawford et al., 2017).
Rotavirus, con su complejo ciclo infeccioso y la variedad de proteínas involucradas en su replicación, sigue siendo una preocupación de salud global, especialmente para los niños menores de cinco años y aunque las vacunas como Rotateq y Rotarix han logrado reducir significativamente la incidencia de la enfermedad, aún no contamos con un tratamiento específico para combatir la infección una vez que ésta ha comenzado (CDC, 2024). Este escenario pone en evidencia la importancia de seguir investigando en profundidad la biología y los mecanismos de acción de este virus.
Infecciones intestinales causadas por rotavirus
Las infecciones intestinales causadas por rotavirus afectan principalmente a los enterocitos, las células maduras ubicadas en la punta de las vellosidades del intestino delgado. El intestino delgado es de vital importancia en nuestro organismo ya que en él se absorben los nutrientes de los alimentos digeridos hacia el torrente sanguíneo. La infección por este virus provoca cambios estructurales significativos, como el aplanamiento de las vellosidades y la disrupción de las barreras epiteliales que protegen el intestino. Estas alteraciones derivan en los síntomas típicos de la infección por rotavirus, que incluyen diarrea acuosa severa, vómito, fiebre, dolor abdominal y deshidratación. Los síntomas suelen aparecer dos días después del contagio y pueden durar entre 3 y 8 días (Organización Mundial de la Salud, 2024).
Rotavirus induce diarrea a través de varios mecanismos. En primer lugar, la disrupción de la homeostasis intestinal afecta tres procesos claves: la reducción de las vellosidades intestinales, la deslocalización de proteínas transportadoras en los enterocitos y la alteración de las proteínas de unión estrecha que mantienen la integridad de las barreras epiteliales. En segundo lugar, la infección interfiere con el transporte de sodio y cloruro en el intestino delgado debido a la degradación de la enzima diacilglicerol aciltransferasa 1 (DGAT1), lo que lleva a una absorción deficiente de nutrientes y, por lo tanto, a una diarrea no inflamatoria con mala absorción (Liu et al., 2023).
Además, la enterotoxina viral NSP4 estimula la secreción de serotonina en las células enteroendocrinas. Esta serotonina liberada actúa sobre los receptores del tracto gastrointestinal, incrementando la motilidad intestinal y la secreción de líquidos (Bialowas et al., 2013). Asimismo, NSP4 también provoca una desregulación de los niveles de calcio intracelular al interactuar con la Molécula de Interacción Estromal 1 (STIM1). STIM1 es una proteína que actúa como sensor de calcio en el retículo endoplásmico. Al interactuar NSP4 con STIM1 provoca el agotamiento de las reservas de calcio del retículo endoplásmico y la activación de canales de calcio en la membrana plasmática, contribuyendo a la diarrea (Hyser et al., 2013). Estos mecanismos explican cómo el rotavirus genera una diarrea severa y otros síntomas gastrointestinales, poniendo de manifiesto la complejidad de su interacción con el organismo humano.
¿Cómo detectar y prevenir las infecciones por rotavirus en México?
En México, el Instituto de Diagnóstico y Referencia Epidemiológicos (InDRE) se encarga de detectar el rotavirus como parte de la vigilancia de enfermedades diarreicas causadas por virus. Esta información permite al gobierno tomar decisiones importantes para proteger la salud, como organizar campañas de vacunación y programas de educación sanitaria. Para encontrar el virus, se usan diferentes métodos. Uno consiste en buscar directamente su material genético en muestras de pacientes. Otro detecta proteínas del virus usando anticuerpos especiales que actúan como “detectores” muy precisos. También se utiliza una técnica llamada RT-PCR, que amplifica el material genético del virus para comprobar si está presente (Secretaría de Salud, 2023).
Como tratamiento para las infecciones por rotavirus, la Secretaría de Salud de México recomienda prevenir la deshidratación aumentando la ingesta de líquidos, como agua, suero oral o caldos claros. Es importante ofrecer líquidos de forma frecuente, incluso en pequeñas cantidades, para compensar la pérdida causada por la diarrea y el vómito. Además, se aconseja mantener una buena higiene, como lavarse las manos antes de preparar alimentos y después de ir al baño, así como desinfectar superficies para evitar que el virus se propague a otras personas. También se debe vigilar que el paciente descanse lo suficiente y continúe su alimentación habitual si es posible.
En términos de prevención, se aplica la vacuna pentavalente (RotaTeq, de la casa farmacéutica Merck), elaborada con virus que fueron aislados originalmente en humanos y bovinos, y que contiene cinco serotipos de virus vivos atenuados. Esta vacuna es parte del Esquema Nacional de Vacunación de México, el cual contempla tres dosis aplicadas a los 2, 4 y 6 meses de edad (Secretaría de Salud, 2024).
En el mundo, las vacunas como Rotarix y RotaTeq han demostrado ser altamente efectivas, con tasas de protección del 96% y 98%, respectivamente, en la prevención de infecciones graves por rotavirus. Estas vacunas han desempeñado un papel crucial en la reducción de la mortalidad infantil causada por esta infección (CDC, 2024). Además de la vacunación, mantener medidas de higiene, como el lavado frecuente de manos y la desinfección de superficies, es esencial para prevenir la propagación del virus.
Infecciones extraintestinales por rotavirus y su relevancia en la salud
Si bien, rotavirus está asociado principalmente a infecciones del tracto gastrointestinal, se han reportado casos alrededor del mundo de rotavirus asociado a infecciones en diferentes órganos. Algunos estudios han reportado la detección de rotavirus en corazón (Lynch et al., 2003), cerebro (Laizane et al., 2019; Lynch et al., 2003), vías respiratorias (Fenaux et al., 2006; Zweigart et al., 2021), hígado (Nakano et al., 2011, Riepenhoff-Talty et al., 1996) y páncreas (Honeyman et al., 2014; Ramig, 2007).
Se postula que la diseminación viral a órganos distantes ocurre a través del sistema circulatorio, en un fenómeno conocido como viremia. La viremia es la presencia de virus en el torrente sanguíneo. Este término se utiliza comúnmente para describir la etapa de una infección viral en la que los virus han ingresado al sistema circulatorio, permitiendo su diseminación a diferentes órganos y tejidos del cuerpo. (Cioc & Nuovo, 2002; Lynch et al., 2003; Wong, 2001). Desde hace más de cuatro décadas, se han reportado casos de viremia en pacientes inmunocomprometidos (Saulsbury et al., 1980) y en poblaciones pediátricas generales, estableciendo a la viremia como un marcador de diseminación sistémica (Blutt et al., 2007).
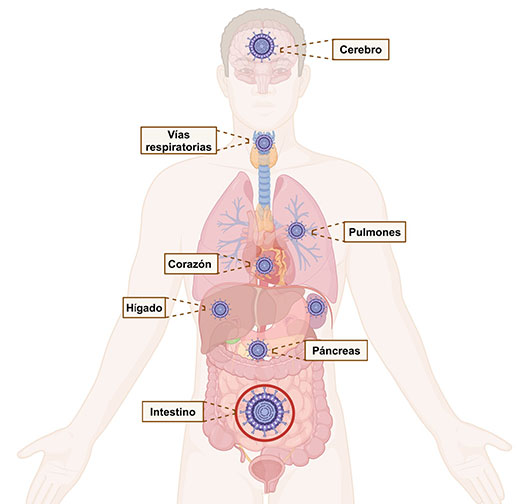
En pacientes con hepatitis crónica, se han detectado diversas proteínas virales, como VP6, NSP1, NSP3 y NSP4, en el tejido hepático. Esto sugiere una posible participación del virus en la patología hepática (Nakano et al., 2011). De manera similar, en casos de colestasis, una enfermedad caracterizada por la obstrucción del flujo de sales biliares, se ha identificado RNA de rotavirus en biopsias de niños afectados por esta condición (Riepenhoff-Talty et al., 1996).
Los estudios post-mortem de pacientes con infección por rotavirus han revelado que este virus puede contribuir a la necrosis de miocitos, miocarditis y miocardiopatía hipertrófica, habiéndose detectado RNA viral en el tejido cardíaco afectado (Lynch et al., 2003).
Otro sistema afectado por rotavirus es el respiratorio. Se ha observado una alta incidencia (entre 30%-65%) de síntomas respiratorios en bebés y niños poco después de un episodio de gastroenteritis por rotavirus, los cuales incluyen tos, dificultad respiratoria leve, rinitis, secreción nasal y congestión. Además, se ha detectado RNA viral por RT-PCR, en pulmones de niños con muertes asociadas a rotavirus, mientras que, en exudados orofaríngeos y secreciones nasofaríngeas, se ha identificado antígeno viral de rotavirus (Fenaux et al., 2006; Zweigart et al., 2021).
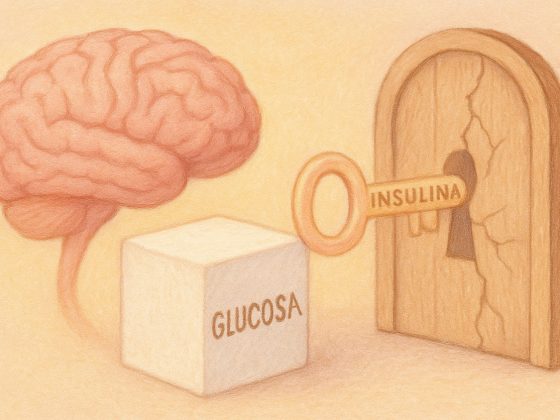
En cuanto al páncreas, aunque no existen reportes clínicos que asocien directamente a rotavirus con enfermedades pancreáticas en humanos, estudios en modelos animales han demostrado que la infección por rotavirus puede afectar a las células de los islotes pancreáticos. Esto reduce la producción de insulina, causando hiperglicemia. Los autores mencionan que, extrapolando sus datos y observaciones a los humanos, es de vital importancia monitorear la infección por rotavirus en niños que presenten pancreatitis aguda y/o el desarrollo de autoinmunidad de los islotes pancreáticos, para no llegar a mayores complicaciones (Honeyman et al., 2014; Ramig, 2007).
En el sistema nervioso central (SNC), rotavirus ha sido asociado a diversas patologías, incluidas meningitis, encefalopatía, encefalitis, cerebelitis y convulsiones. Se ha logrado identificar partículas virales, RNA de rotavirus y anticuerpos contra el virus en el tejido cerebral de pacientes con estas complicaciones (Laizane et al., 2019; Lynch et al., 2003; Takanashi et al., 2010). En investigaciones in vitro, se ha demostrado que las células neuronales pueden soportar la infección por rotavirus, lo que se confirmó mediante la detección de las proteínas virales NSP4 y VP7 (Weclewicz et al., 1998).
Se han propuesto dos mecanismos por los cuales rotavirus puede invadir el SNC; el primero es que el virus puede infectar directamente el cerebro a través de la barrera hematoencefálica, mientras que el segundo mecanismo propone la infección del nervio vago antes de llegar al cerebro. El daño al tejido cerebral podría estar mediado por citocinas proinflamatorias, especies reactivas de oxígeno y la enterotoxina NSP4, entre otros factores (Lee et al., 2022).
El rotavirus no solo causa diarrea grave: en algunos casos puede afectar el cerebro. Esto puede provocar convulsiones, inflamación del cerebro o del cerebelo, e incluso daños en recién nacidos. En Galicia, España, un estudio hecho en 2019 revisó los casos de 7,712 niños menores de 5 años que fueron hospitalizados por convulsiones. Compararon los años antes y después de aplicar la vacuna contra el rotavirus. El resultado fue muy importante: en 2019, las hospitalizaciones por convulsiones bajaron más de la mitad (50.9%) en comparación con los datos de 2014, gracias a la vacunación (Salas et al., 2019). Esto significa que la vacuna no solo protege contra la diarrea, sino que también ayuda a prevenir complicaciones relacionadas a la infección por rotavirus.
Estos estudios muestran que el rotavirus no solo causa problemas en el estómago y del intestino, sino que también puede afectar otros órganos del cuerpo. Estas complicaciones fuera del sistema digestivo muchas veces no se detectan a tiempo, por eso es importante que los médicos y científicos sigan investigando y vigilando más este virus. Entender mejor cómo el rotavirus interactúa con nuestro cuerpo ayudará a crear mejores formas de tratar y controlar esta infección de manera completa.
Recuerden que es fundamental buscar atención médica inmediata si el paciente no puede retener líquidos, presenta vómito persistente, diarrea muy abundante, fiebre alta, somnolencia excesiva, irritabilidad o signos de deshidratación como boca seca, llanto sin lágrimas o disminución en la cantidad de orina. La atención oportuna puede prevenir complicaciones graves.
Agradecimientos
DGAPA/UNAM (IN202823) JH-G y AMHB recibieron becas de CONACyT. (SECIHTI)
Referencias:
Bialowas S, Hagbom M, Nordgren J, Karlsson T, Sharma S, Magnusson KE, et al. Rotavirus and Serotonin Cross-Talk in Diarrhoea. PLoS ONE. 2016; 11(7):e0159660. Epub 20160726. https://doi.org/10.1371/journal.pone.0159660
BioRender.com. (2024). BioRender. Retrieved from https://biorender.com/
Black RE, Perin J, Yeung D, Rajeev T, Miller J, Elwood SE, Platts-Mills JA. Estimated global and regional causes of deaths from diarrhoea in children younger than 5 years during 2000-21: a systematic review and Bayesian multinomial analysis. Lancet Glob Health. 2024 Jun;12(6):e919-e928. https://doi.org/10.1016/S2214-109X(24)00078-0
Blutt SE, Matson DO, Crawford SE, Staat MA, Azimi P, Bennett BL, Piedra PA, Conner ME. Rotavirus antigenemia in children is associated with viremia. PLoS Med. 2007 Apr;4(4):e121. https://doi.org/10.1371/journal.pmed.0040121
Crawford SE, Ramani S, Tate JE, Parashar UD, Svensson L, Hagbom M, Franco MA, Greenberg HB, O’Ryan M, Kang G, Desselberger U, Estes MK. Rotavirus infection. Nat Rev Dis Primers. 2017 Nov 9;3:17083. https://doi.org/10.1038/nrdp.2017.83
Cioc AM, Nuovo GJ. Histologic and in situ viral findings in the myocardium in cases of sudden, unexpected death. Mod Pathol. 2002 Sep;15(9):914-22. https://doi.org/10.1097/01.MP.0000024291.37651.CD
Fenaux M, Cuadras MA, Feng N, Jaimes M, Greenberg HB. Extraintestinal spread and replication of a homologous EC rotavirus strain and a heterologous rhesus rotavirus in BALB/c mice. J Virol. 2006 Jun;80(11):5219-32. https://doi.org/10.1128/jvi.02664-05
Honeyman MC, Laine D, Zhan Y, Londrigan S, Kirkwood C, Harrison LC. Rotavirus infection induces transient pancreatic involution and hyperglycemia in weanling mice. PLoS One. 2014 Sep 2;9(9):e106560. https://doi.org/10.1371/journal.pone.0106560
Hyser Joseph M, Utama B, Crawford Sue E, Broughman James R, Estes MK. Activation of the Endoplasmic Reticulum Calcium Sensor STIM1 and Store-Operated Calcium Entry by Rotavirus Requires NSP4 Viroporin Activity. J Virol. 2013; 87(24):13579–13588. https://doi.org/10.1128/JVI.02629-13
Kashyap G, Singh R, Malik YS, Agrawal RK, Singh KP, Kumar P, Sahoo M, Gupta D, Singh R. Experimental bovine rotavirus-A (RV-A) infection causes intestinal and extra-intestinal pathology in suckling mice. Microb Pathog. 2018 Aug;121:22-26. https://doi.org/10.1016/j.micpath.2018.04.038
Laizane G, Smane L, Nokalna I, Gardovska D, Feemster KA. Rotavirus-associated seizures and reversible corpus callosum lesion. Acta Med Litu. 2019;26(2):113-117. https://doi.org/10.6001/actamedica.v26i2.4031
Lee KY. Rotavirus infection-associated central nervous system complications: clinicoradiological features and potential mechanisms. Clin Exp Pediatr. 2022 Oct;65(10):483-493. https://doi.org/10.3345/cep.2021.01333
Liu Z, Smith H, Criglar JM, Valentin AJ, Karandikar U, Zeng XL, et al. Rotavirus-mediated DGAT1 degradation: A pathophysiological mechanism of viral-induced malabsorptive diarrhea. Proc Natl Acad Sci U S A. 2023; 120(51):e2302161120. Epub 20231211. https://doi.org/10.1073/pnas.2302161120
Lynch M, Shieh WJ, Tatti K, Gentsch JR, Ferebee-Harris T, Jiang B, Guarner J, Bresee JS, Greenwald M, Cullen S, Davies HD, Trevenen C, Zaki SR, Glass RI. The pathology of rotavirus-associated deaths, using new molecular diagnostics. Clin Infect Dis. 2003 Nov 15;37(10):1327-33. https://doi.org/10.1086/379322
Morrison C, Gilson T, Nuovo GJ. Histologic distribution of fatal rotaviral infection: an immunohistochemical and reverse transcriptase in situ polymerase chain reaction analysis. Hum Pathol. 2001 Feb;32(2):216-21. https://doi.org/10.1053/hupa.2001.21565
Nakano I, Taniguchi K, Ishibashi-Ueda H, Maeno Y, Yamamoto N, Yui A, Komoto S, Wakata Y, Matsubara T, Ozaki N. Sudden death from systemic rotavirus infection and detection of nonstructural rotavirus proteins. J Clin Microbiol. 2011 Dec;49(12):4382-5. https://doi.org/10.1128/jcm.01303-11
Ramig RF. Systemic rotavirus infection. Expert Rev Anti Infect Ther. 2007 Aug;5(4):591-612. https://doi.org/10.1586/14787210.5.4.591
Riepenhoff-Talty M, Gouvea V, Evans MJ, Svensson L, Hoffenberg E, Sokol RJ, Uhnoo I, Greenberg SJ, Schäkel K, Zhaori G, Fitzgerald J, Chong S, el-Yousef M, Nemeth A, Brown M, Piccoli D, Hyams J, Ruffin D, Rossi T. Detection of group C rotavirus in infants with extrahepatic biliary atresia. J Infect Dis. 1996 Jul;174(1):8-15. https://doi.org/10.1093/infdis/174.1.8
Rotavirus gastroenteritis, Disease and epidemiology. https://www.emro.who.int/health-topics/rotavirus-gastroenteritis/disease-and-epidemiology.html, https://www.who.int/es/news-room/fact-sheets/detail/diarrhoeal-disease
Salas, A., Rodríguez-Tenreiro, C., Gómez-Rial, J., et al. (2019). Impact of rotavirus vaccination on childhood hospitalizations for seizures: Heterologous or unforeseen direct vaccine effects? Vaccine, 37(25), 3362-3368. https://doi.org/10.1016/j.vaccine.2019.04.086
Saulsbury FT, Winkelstein JA, Yolken RH. Chronic rotavirus infection in immunodeficiency. J Pediatr. 1980 Jul;97(1):61-5. https://doi.org/10.1016/S0022-3476(80)80131-4
Secretaría de Salud. (2023). Lineamientos para la vigilancia por laboratorio de la gastroenteritis viral: Rotavirus, Norovirus, Astrovirus y Adenovirus entérico. Instituto de Diagnóstico y Referencia Epidemiológicos (InDRE). Disponible en: https://www.gob.mx/salud
Secretaría de Salud. (2024). Vacuna antirrotavirus. Gobierno de México. Recuperado de https://www.gob.mx/salud/articulos/vacuna-antirrotavirus
Takanashi J, Miyamoto T, Ando N, Kubota T, Oka M, Kato Z, Hamano S, Hirabayashi S, Kikuchi M, Barkovich AJ. Clinical and radiological features of rotavirus cerebellitis. AJNR Am J Neuroradiol. 2010 Oct;31(9):1591-5. https://doi.org/10.3174/ajnr.A2131
Vaccines y preventable disease, Rotavirus. https://www.cdc.gov/vaccines/vpd/rotavirus/hcp/about-vaccine.html
Ward RL, Knowlton DR, Pierce MJ. Efficiency of human rotavirus propagation in cell culture. J Clin Microbiol. 1984 Jun;19(6):748-53. https://doi.org/10.1128/jcm.19.6.748-753.1984
Weclewicz K, Svensson L, Kristensson K. Targeting of endoplasmic reticulum-associated proteins to axons and dendrites in rotavirus-infected neurons. Brain Res Bull. 1998 Jul 1;46(4):353-60. https://doi.org/10.1016/S0361-9230(98)00013-6
Wong V. Acute gastroenteritis-related encephalopathy. J Child Neurol. 2001 Dec;16(12):906-10. https://doi.org/10.1177/088307380101601208
*Foto de portada creada con Chat GPT