Cuando preguntamos ¿Qué es el cerebro? la respuesta común es que se trata de un órgano constituido por una compleja red de neuronas. Esto es correcto, pero no son las únicas células que lo conforman. Revisemos cuál es la ubicación, función y las razones que explican por qué un grupo particular de ellas, las células gliales, gozan de poca fama.
¿Una complicidad conveniente?
La complejidad del tejido cerebral está íntimamente relacionado con la versatilidad de sus funciones, mismas que no se explican sin la presencia de múltiples tipos celulares, que interactúan y se comunican. Además de neuronas estrelladas, fusiformes o piramidales, el cerebro de los mamíferos está conformado por células gliales, también llamadas neuroglia o sólo glía, que es un conjunto de pequeñas células ramificadas que superan hasta en 10 veces el número a las más de 100 mil millones de neuronas que tiene el cerebro humano. Esta supremacía de la glía, en términos de densidad poblacional ¿tiene una implicación fisiológica?
Las células gliales realizan diferentes funciones que van desde proporcionar nutrientes al microambiente celular; ser el sistema de vigilancia y protección; dar mantenimiento a las estructuras neuronales como los axones; diferenciarse en neuronas si es necesario; y liberar moléculas de respuesta inmune como citocinas y quimiocinas, e incluso gliotransmisores, que coadyuvan en la comunicación neuronal (Figura 1).
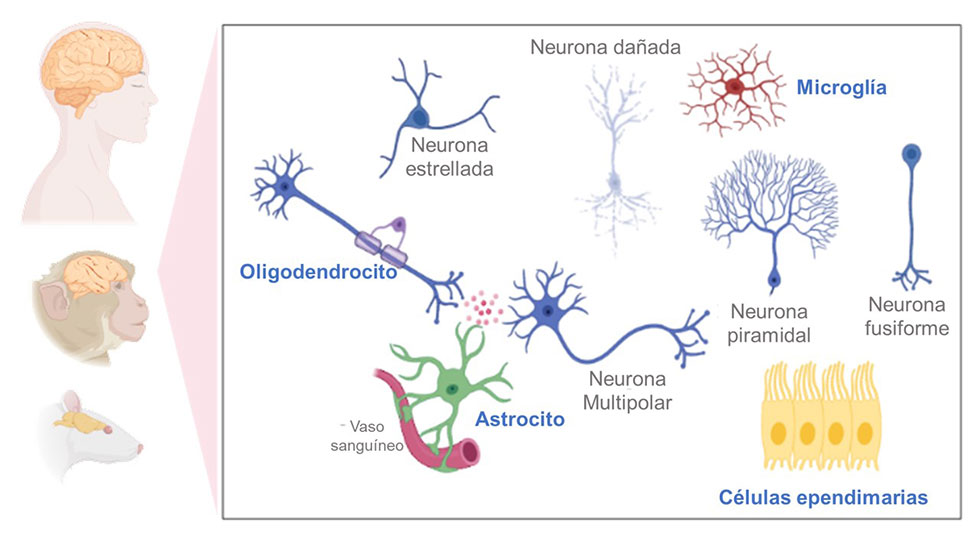
El estudio de la glía se realiza mediante modelos in vitro, como el cultivo celular de glía aislada de mamíferos, y modelos in vivo donde destaca el empleo de la rata o el ratón. La estrategia para investigarlas consiste en la identificación de moléculas que forman parte de las células gliales, elementos conocidos como “marcadores”, los cuales son específicos para cada tipo de glía (Figura 2). En el caso de los marcadores de células gliales, deben permitir la identificación y el análisis de su interacción entre ellas mismas y con las neuronas, ya sea en condiciones de homeostasis o en condiciones patológicas. Para visualizar a las células, o a sus organelos, se han desarrollado distintos tipos de microscopia, destacando la microscopia confocal, electrónica, de fluorescencia. Esta tecnología ha avanzado a la par del desarrollo de tinciones y métodos para el inmunomarcaje celular, que junto con las técnicas de biología molecular, genética e incluso de resonancia magnética, han ayudado al entendimiento y descripción de las funciones de las células gliales.
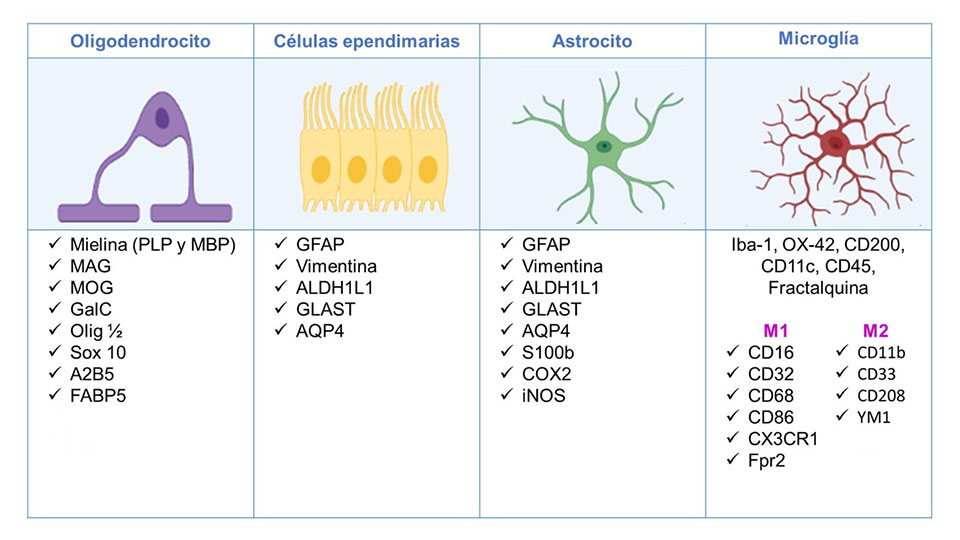
La diversidad de funciones realizadas por tipos específicos de células glíales (astrocitos, células ependimarias, oligodendrocitos, microglia), están enfocadas al mantenimiento de la homeostasis y supervivencia. Se enfatiza esto porque en el pasado se consideraba que las células gliales tenían una función pasiva, limitando su desempeño como células de soporte, en cierta congruencia por la ausencia de tejido conectivo en el cerebro. Sin embargo, investigaciones recientes han demostrado que la glía es más que solo un pegamento, encontrándose que además de las funciones establecidas, ciertos fenotipos gliales mantienen el equilibrio iónico; en el espacio extracelular, aislan los axones para acelerar la comunicación eléctrica e incluso liberan gliotransmisores. El amplio grupo de funciones permite reflexionar sobre su naturaleza ontogénica. En este contexto, las células gliales provienen del neuroectodermo como las neuronas, con la diferencia de que las células gliales pueden proliferar, pero no son capaces de generar potenciales de acción como las neuronas. Aún con sus diferencias ¿cuál es el nivel de colaboración de todos los tipos de células gliales con las neuronas?
Los oligodendrocitos y el andamiaje neuronal
Los oligodendrocitos, descritos por Del Río Hortega en 1921 mediante impregnación argéntica, representan del 5-10% de la totalidad de las células gliales. Si bien comparten un origen embrionario con las células ependimarias, los astrocitos y las neuronas, los oligodendrocitos tienen como progenitor a las células progenitoras de oligodendrocitos (también llamadas polidendrocitos); estas células surgen durante el desarrollo embrionario en el tubo neuronal, y comienzan a migrar hacia el resto del cerebro para diferenciarse en oligodendrocitos maduros ante diferentes estímulos; no obstante, es importante mencionar que algunos polidendrocitos permanecen hasta la edad adulta.
Se puede clasificar a los oligodendrocitos según su ubicación y su morfología. Por la ubicación encontramos oligodendrocitos interfasciculares, perivasculares y perineuronales. Los primeros se encuentran en la sustancia blanca y tienen como principal función la mielinización de los axones; los perivasculares, se localizan cerca de los vasos sanguíneos del cerebro; mientras que los perineuronales se hallan en la sustancia gris, donde se unen a los somas neuronales realizando funciones metabólicas; son capaces de producir mielina y migrar si es necesario ante alguna patología o daño.
Por su morfología se han descrito cuatro tipos de oligodendrocitos, caracterizados por la presencia de un soma del cual salen proyecciones citoplasmáticas que envuelven el axón neuronal. El tipo I presente principalmente en la sustancia gris, se destaca por somas redondeados y una compleja arborización. Los de tipo II poseen somas pequeños y se encuentran en la sustancia blanca. Los tipo III se caracterizan por cuerpos celulares más grandes que los tipo I y II, y su poder de mielinización en axones de gran tamaño en zonas como el bulbo raquídeo o la médula espinal. Asimismo, los tipo IV mielinizan un solo axón de gran tamaño (hasta 1000 mm de longitud) y se localizan en la entrada de las raíces nerviosas del SNC.
La función principal de los oligodendrocitos es la generación de mielina durante el desarrollo, la mielinización adaptativa en la edad adulta y la remielinización después de daño. La mielina es una lipoproteína que recubre los axones, lo que facilita la conducción eléctrica de los impulsos nerviosos. Su citoplasma es tan amplio que favorece el envolvimiento de ciertas porciones de los axones de las neuronas, formando lo que se conoce como vainas de mielina, y dejando otras porciones al descubierto, llamadas nódulos de Ranvier, por donde los impulsos “saltan” para transmitir la información. Además, los oligodendrocitos favorecen la conducción eléctrica y desempeñan un papel fundamental en el metabolismo neuronal.
Por su parte, los polidendrocitos que llegan a la edad adulta, además de favorecer la producción de oligodendrocitos, también son capaces de diferenciarse en astrocitos y células de Schwann; estas últimas son células productoras de mielina que tienen capacidad inmunomoduladora ante daño temporal o crónico. Por su participación en los procesos de mielinización, los oligodendrocitos se han relacionado directamente con patologías como la esclerosis múltiple o las leucodistrofias, que conllevan a problemas cognitivos y motores.
Células ependimarias y líquido cefaloraquídeo
Las células ependimarias son un tipo de células epiteliales de forma cúbica o cilíndrica, que recubren el sistema ventricular del cerebro y la médula espinal. Tienen su origen en las células madre neuroepiteliales embrionarias, localizadas en el tubo neural ventral. Se encargan de la producción del líquido cefaloraquídeo (LCR) por ultrafiltración del plasma sanguíneo. Se caracterizan por la presencia de un citoplasma rico en mitocondrias, haces filamentosos, cilios y vellosidades que sobresalen del soma. Estos últimos permiten el movimiento del LCR que producen y un proceso selectivo de lo que entra y no en los conductos que forman, funcionando como un sistema para absorber nutrientes y eliminar desechos, constituyendo parte del sistema linfático.
Se han descrito tres tipos de células ependimarias: 1) Las células epiteliales coroideas, encargadas de regular la producción y composición del LCR; 2) los ependimocitos que permiten la comunicación del LCR y el tejido nervioso; y 3) los tanicitos que se encuentran solo en el revestimiento del piso del tercer ventrículo en el cerebro, y que poseen prolongaciones alargadas que les permiten transportar hormonas. Como es evidente, las primeras sirven para contener el LCR y evitar fugas a otras regiones del cerebro, y las segundas permiten la difusión del LCR, el cual es encargado de brindar un sistema de amortiguamiento ante daños mecánicos como traumas y una protección inmunológica a nivel cerebral.
Astrocitos y sinapsis
Los astrocitos, descubiertos por Von Lenhossek en 1893 y descritos por Ramón y Cajal en 1913, pueden interactuar con más de un millón de sinapsis en el cerebro humano. Se trata de células provenientes del ectodermo, lo que ha permitido la generación de subtipos de astrocitos, los cuales son clasificados en función de su morfología, ubicación, perfil genético y tipo de moléculas liberadas.
Una de las clasificaciones más aceptadas es la propuesta por Rudolf Albert Von Kölliker y William Lloyd Andriezen, quienes clasifican a los astrocitos como protoplasmáticos y fibrosos. Los primeros se ubican principalmente en la sustancia gris, asociándose con los somas neuronales y las sinapsis; los segundos se localizan en la sustancia blanca y se ligan a los axones. Es importante mencionar que, aunque esta es la más aceptada, existen distintas clasificaciones que muestran otros subtipos de astrocitos. No obstante, morfológicamente los distintos tipos de astrocitos se caracterizan por una forma estrellada con ramificaciones múltiples que se involucran en diferentes procesos biológicos.
Los astrocitos intervienen en la regulación de la homeostasis y en la formación de la citoarquitectura cerebral y de contactos con los vasos sanguíneos. Una de sus principales actividades es la “nutrición cerebral”, tomando metabolitos y sustratos directamente de los vasos sanguíneos. Un ejemplo es la glucosa; los astrocitos la convierten en glucógeno o lactato (igual que los oligodendrocitos) favoreciendo la síntesis de ATP y la neurotransmisión.
Al estar en contacto directo con los vasos sanguíneos, regulan su flujo y las concentraciones de oxígeno; además forman parte del sistema linfático (junto con las células ependimarias y la microglía), al capturar y metabolizar neurotransmisores durante la sinapsis. También se encargan del funcionamiento de la barrera hematoencefálica, además de regular las concentraciones de iones (calcio y potasio), contrarrestando el estrés oxidativo a través de la vía del glutatión. Asimismo, participan como línea de respuesta ante procesos inflamatorios o agresiones, promoviendo la liberación de citocinas e interleucinas, activación de fagocitosis, proceso que en conjunto se conoce como astrogliosis.
Dentro de las investigaciones recientes sobre los astrocitos destacan tres. La primera hace referencia a la importancia de los astrocitos para el desarrollo de la memoria y el aprendizaje, donde las investigaciones han demostrado que un número mayor de astrocitos en el individuo favorece estas capacidades. La segunda línea hace referencia a la capacidad de los astrocitos para transferir mitocondrias funcionales (vía contacto directo de célula a célula o mediante vesículas extracelulares) a neuronas dañadas, aumentando la respiración aeróbica. Una de las líneas que más ha llamado la atención es la que describe que bajo ciertos escenarios los astrocitos poseen la capacidad de reprogramarse y diferenciarse en neuronas funcionales.
Microglía y la defensa del microentorno
La microglía, descrita en 1919 por Del Río Hortega, es un tipo celular de estirpe macrofágica que durante la órganogénesis se forma en el saco vitelino, y tiene precursores que residen en la medula ósea.
Durante el proceso de embriogénesis, la microglía migra al encéfalo en donde madura y permanece de manera inactiva (en estado de reposo) hasta que un estresor se presenta. Su función general es regular la homeostasis a nivel cerebral, participando en la neurogénesis; la liberación de factores neurotróficos como el factor neurotrófico derivado del cerebro (BDNF en inglés) o la activina A, que activa los oligodendrocitos; en la muerte celular programada; en la formación, modificación y poda de sinapsis; en el soporte y protección de las neuronas a través de uniones microglía-soma; en el control de la excitabilidad neuronal y axonal mediante contactos microglía-axón; en la eliminación de sinapsis; en procesos de migración celular (de otras células gliales y neuronas); y en la formación/reforzamiento/eliminación de circuitos neuronales.
Su estado inactivo se distingue por un tamaño celular menor a 10 µm, y prolongaciones citoplasmáticas cortas, sin embargo, cuando la microglía se activa, cambia drásticamente su morfología. En la primer parte del proceso de activación, las ramificaciones de la microglía se vuelven largas y gruesas con un soma ligeramente agrandado; después se adaptan volviéndose cortas y robustas (segunda etapa), mientras que en la tercer etapa adquiere una forma ameboide, mientras que el último fase se destaca una forma forma redonda, irregular y más grande que las ameboides denominado etapa fagocítica. Estos cambios en su morfología, junto con el perfil de marcadores celulares que expresan, y las citocinas e interleucinas que liberan tras su activación, ha permitido clasificar a la microglía activada como microglía de fenotipo M1 o de fenotipo M2.
El fenotipo M1 es promovido por la presencia de altos niveles de interferón (IFN), factor de necrosis tumoral (TNF) y estresores como el lipopolisacárido (LPS), presente en algunas infecciones bacterianas. Además produce y libera mediadores proinflamatorios que son tóxicos para las neuronas, lo que conduce a la neuroinflamación o neurodegeneración, es decir, a un proceso que ocasiona daño en las neuronas que muchas veces es irreversible. Por el contrario, el fenotipo M2 se caracteriza por la presencia de altos niveles de citocinas antiinflamatorias, entre ellas las interleucinas 4 y 13 (IL-4, IL-13), además de diversos factores neurotróficos vinculados a la neuroprotección.
El nivel de activación de las células microgliales depende de la intensidad, duración y tipo del estímulo estresor. Si bien la clasificación por tipo M1 y M2 se basa en cambios morfométricos de la glia, diversos autores han sugerido complementar su tipificación con base en patrones electrofisiologícos, o bien genotipado. Lo relevante es que la complementariedad de técnicas para la distinción morfológica o fisiológica de la microglia se volvió clave para el entendimiento de las enfermedades neurodegenerativas.
Interacción funcional de neuronas y células gliales
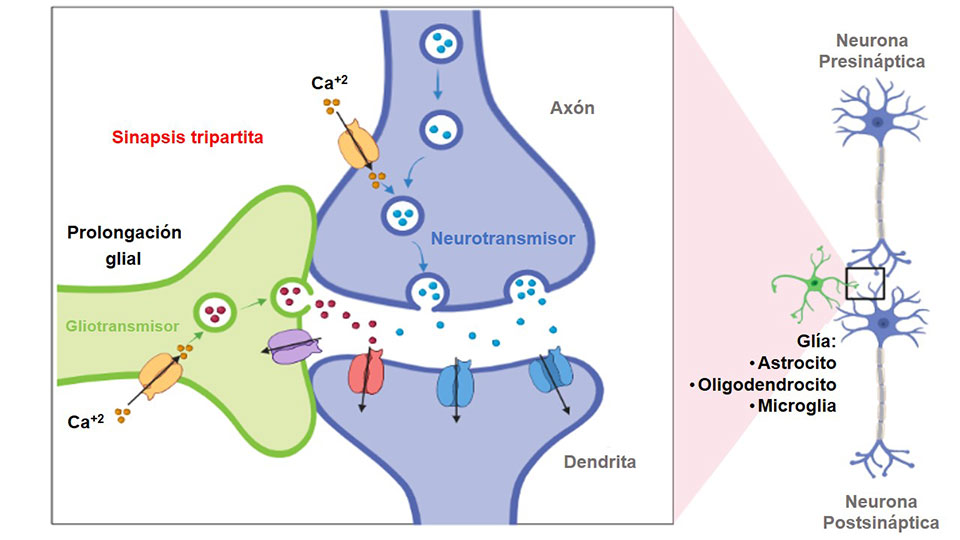
El trabajo en equipo, sincronizado y eficiente, es una característica de todos los sistemas biológicos. Las células gliales pueden liberar compuestos químicos semejantes a la función que tienen los neurotransmisores; en este caso, el término aplicado es “gliotransmisión” (Figura 3). Se ha demostrado que los oligodendrocitos, los astrocitos y la microglía son los representantes de la glía que actúan en este proceso. Para que un compuesto se denomine como gliotransmisor debe ser sintetizado o almacenado en la glía; su liberación debe activarse por estímulos fisiológicos o patológicos; debe tener respuesta rápida sobre las células (de milisegundos a segundos), y debe participar en los procesos fisiológicos o patológicos. Con estos criterios podemos encontrar diferentes gliotransmisores según su estructura química, teniendo gliotransmisores de tipo aminoácido, como el glutamato, la D-serina y GABA; gliotransmisores nucleótidos, como el ATP; y gliotransmisores peptídicos, tales como péptido natriurético auricular y BDNF. Es de destacar que los mecanismos por los cuales los gliotransmisores son liberados aún son discutidos por los neurocientíficos, pero pueden ser por mecanismos dependientes e independientes de calcio (Ca2+), mecanismos vesiculares, mediados por canales y transportadores, cambios en la captación de neurotransmisores e iones y eventos de fusión de membrana.
Conclusión
La comunicación constante y acciones coordinadas de las neuronas y las células gliales permiten mantener la homeostasis cerebral. No obstante, aún quedan muchas interrogantes por resolver sobre las interacciones y funciones glíales.
Referencias
- Guillamón-Vivancos, T., Gómez-Pinedo, U., & Matías-Guiu, J. (2015). Astrocitos en las enfermedades neurodegenerativas (I): función y caracterización molecular. Neurología, 30(2), 119-129.
- Heman-Bozadas, P., Romero, C., Martínez-Remedios, P., Freitag, et al., (2022). Lesion-associated microglia and macrophages mediate corralling and react with massive phagocytosis for debris clearance and wound healing after LPS-induced dopaminergic depletion. Journal of Neuroimmunology, 367, 577874.
- Hernandez Baltazar, D., Nadella, R., Barrientos Bonilla, A., Flores Martinez, Y., Olguin, A., Heman Bozadas, P., et al. (2020). Does lipopolysaccharide-based neuroinflammation induce microglia polarization? Folia Neuropathol, 58(2), 113-122.
- Lurdes Chivava, C.N., Ramírez Carmenate, Z., & González Núñez, L. (2018). Las neuroglias y su relación con las enfermedades neurodegenerativas/Glial cells and their relationship with neurodegenerative diseases. Ciencia&Conciencia, 1(1), 47-51.
- Kuhn, S., Gritti, L., Crooks, D., & Dombrowski, Y. (2019). Oligodendrocytes in Development, Myelin Generation and Beyond. Cells, 8(11), 1424.
- Pensado Guevara, P. B., Flores Martínez, YM. Hernández Baltazar D.(2024). Estudiando el proceso neuroinflamatorio. Revista Elementos. BUAP. 134: 23-31.
- Rela, L. (2016). Células gliales ¿Servidoras de las neuronas o compañeras de equipo? Asociación Civil Ciencia Hoy; Ciencia Hoy, 26 (151): 37-42.
- Sohair AM Eltony and Sanaa AM Elgayar. (2017). CNS Glia: From Passive Glue to Excitable Cells. EC Neurology, 7, 129-150.
- Talaverón, R. y Morado-Díaz CJ. (2019). La glía, las otras células del sistema nervioso. Elementos: 39-44.
- Tena-Suck, M. L., & Rubio-Osornio, M. C. (2021). Células madre del sistema nervioso central. Patología, 59, 1-13.
*Foto de portada creada con Gemini 2.5 Flash