El dolor y su clasificación
El dolor es el sistema de alarma del organismo ante estímulos potencialmente nocivos presentes en el entorno. La palabra dolor proviene del anglo-francés peine que significa pena o sufrimiento, del latín pena que expresa castigo y del griego poine que está relacionado con pago o castigo. La Asociación Internacional para el Estudio del Dolor (IASP) lo define como una experiencia sensorial y emocional desagradable semejante a la asociada con daño real o potencial al tejido. De acuerdo con su origen, el dolor se clasifica en 4 tipos: nociceptivo, inflamatorio, neuropático y nociplástico.
El primer tipo se genera mediante estímulos de alta intensidad y corta duración, de tal manera que se activan las neuronas de alto umbral del sistema sensorial nociceptivo. A este tipo de dolor se le conoce como dolor fisiológico. El dolor inflamatorio se produce cuando el estímulo es de alta intensidad y duración suficiente para generar daño al tejido. Este dolor se acompaña de vasodilatación que se manifiesta como calor y coloración roja en el área dañada, además de inflamación (edema) y, eventualmente, perdida de la función. El dolor neuropático se genera cuando se lesionan las vías (nervios) que conducen el estímulo doloroso desde la periferia hasta el sistema nervioso central. Por último, el dolor nociplástico es una clase de dolor enigmático donde no hay daño al tejido o lesión de los nervios. Se sugiere que se debe a un procesamiento aberrante de las señales de dolor a nivel espinal y supra espinal.
Los nociceptores
El dolor se percibe mediante neuronas específicas llamadas nociceptores, que son neuronas de alto umbral, capaces de discriminar entre estímulos inocuos y nocivos. Los nociceptores responden a estímulos nocivos químicos, mecánicos o térmicos. Existen dos tipos de neuronas que funcionan como nociceptores: fibras amielínicas C y fibras mielínicas de diámetro pequeño Aδ. En ciertas condiciones, las fibras de diámetro grueso Aβ también funcionan como nociceptores. La diferencia principal entre los nociceptores es la velocidad de conducción y algunos marcadores moleculares distintivos. Estas neuronas se encargan de traducir los estímulos nocivos de cualquier tipo en potenciales de acción (señales eléctricas), que se conducen a lo largo del axón hasta la parte posterior de la medula espinal, donde hacen un primer relevo con neuronas de proyección, que a su vez conducen la información al tálamo. De éste surgen proyecciones que llevan la información a distintas áreas cerebrales que incluyen la corteza somatosensorial, amígdala, ínsula, corteza anterior del cíngulo y la corteza prefrontal, entre otras. La interacción con estas áreas combina el componente sensorial con un elemento afectivo motivacional para integrar la experiencia subjetiva del dolor (Figura 1).
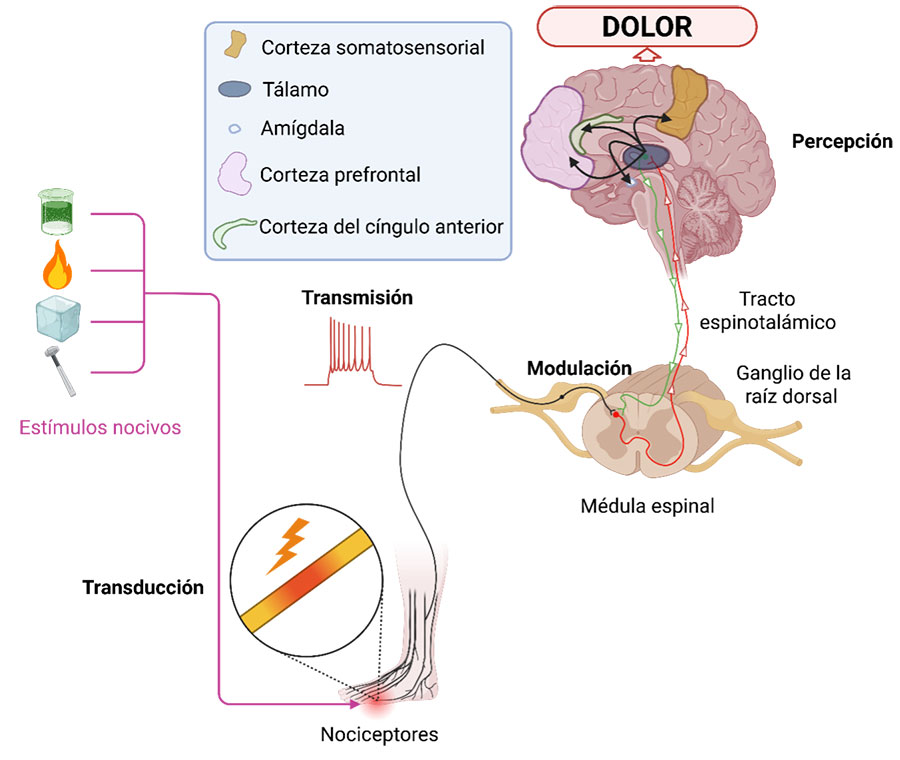
El dolor crónico es aquel que se presenta en una o más regiones anatómicas por más de 3 meses y se acompaña de alteraciones del estado de ánimo (angustia, ansiedad, miedo y frustración) y discapacidad funcional (interferencia con las actividades diarias). El dolor crónico afecta al 20% de la población general (13-55%) y esta prevalencia aumenta con la edad. El dolor crónico es más frecuente, severo y de más larga duración en las mujeres que en los hombres. Es el caso de la fibromialgia, migraña, neuropatía diabética, dolor postoperatorio, artritis reumatoide y osteoartritis, entre otras. La prevalencia del dolor crónico en mujeres es hasta 20% mayor que en los hombres. A pesar de los datos epidemiológicos, la mayoría de la investigación preclínica en el área de las neurociencias, y en particular del dolor, se realiza en ratas o ratones macho.
Impacto del sexo en animales con dolor crónico
En años recientes, se ha promovido la inclusión de hembras en los diseños experimentales que involucran investigación del dolor en animales (Mogil y Chanda, 2005). Esto ha contribuido al conocimiento de diferencias en algunos mecanismos del dolor dependientes del sexo. Por ejemplo, la administración del péptido relacionado con el gen de calcitonina (CGRP) en la duramadre produce migraña en ratones hembra, pero no macho (Avona et al., 2019). En apoyo de esto, estudios recientes han encontrado que la migraña en ratones hembra depende de la hormona prolactina (Singh et al., 2024). La prolactina aumenta la liberación del CGRP e induce la migraña en ratones hembra, pero no en machos. De acuerdo con estos estudios y dado que la evidencia sugiere que el CGRP promueve los ataques de migraña en el ser humano, los fármacos que bloquean los efectos del CGRP deberían ser más efectivos en mujeres que en hombres. A la fecha, los datos clínicos muestran que los antagonistas del receptor a CGRP, pero no los anticuerpos anti-CGRP, son más efectivos en el tratamiento de la migraña aguda en mujeres que en hombres. La diferencia se podría explicar por la forma en que actúan estos tratamientos. Los antagonistas del receptor a CGRP se unen al receptor impidiendo su función, mientras que los anticuerpos anti-CGRP evitan la acción del CGRP en su receptor. Este es un ejemplo de cómo los estudios que evalúan el dimorfismo sexual en el dolor pueden tener un impacto en el tratamiento del dolor en humanos.
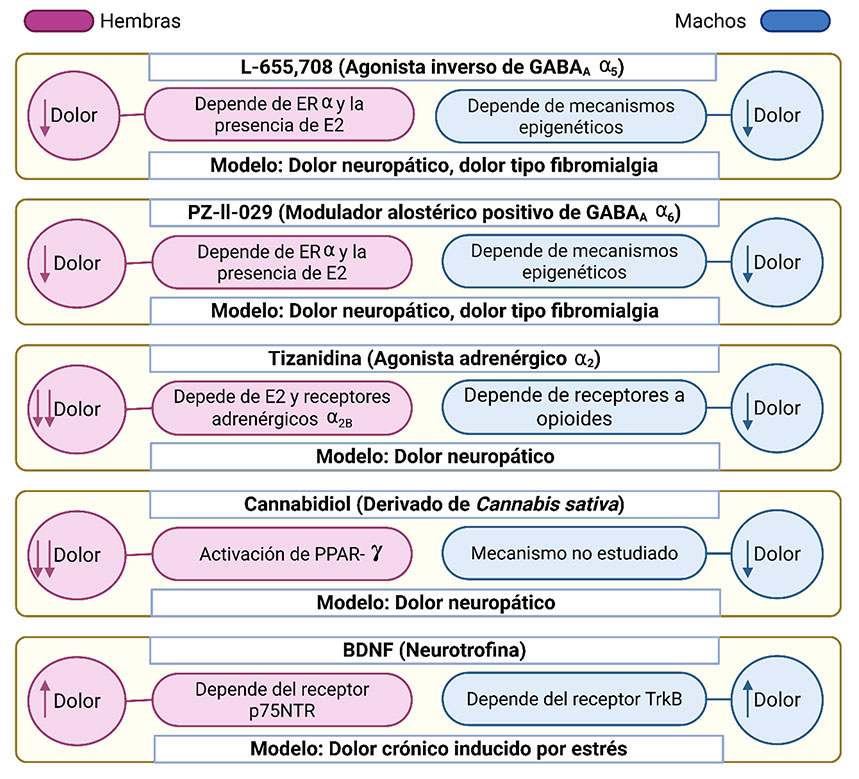
Los receptores ácido γ-aminobutírico A (GABAA) se encuentran distribuidos ampliamente en el cerebro. Estos receptores funcionan normalmente como inhibidores de la excitabilidad de las neuronas. Sin embargo, la función de este receptor en condiciones patológicas (como en el dolor crónico) pasa de inhibidora a activadora. Por lo tanto, la administración de antagonistas de los receptores GABAA reduce el dolor crónico. Estudios de nuestro laboratorio han encontrado que la administración espinal (intratecal) de L-655,708, una sustancia que bloquea al receptor GABAA α5, reduce el dolor neuropático en ratas y ratones hembra, pero no en machos (Franco-Enzástiga et al., 2021). Además, la administración espinal de L-655,708 es más efectivo para disminuir la fibromialgia en ratas hembra que en machos (De la Luz-Cuellar et al., 2019). De manera similar, la administración espinal de PZ-II-029 (una sustancia que activa al receptor GABAA α6), reduce el dolor neuropático en ratas y ratones hembra, pero no en macho (Rodríguez-Palma et al., 2023). El efecto analgésico de L-655,708 o PZ-II-029 en las hembras depende de la presencia de la hormona gonadal femenina estradiol y del receptor a estrógenos α. La falta de efecto de estas sustancias en los animales macho se relaciona con mecanismos epigenéticos. Otros estudios del laboratorio indican que la tizanidina (agonista de los receptores adrenérgicos α2) es más efectiva para aliviar el dolor neuropático en ratas hembra que en ratas macho. El efecto en las hembras depende de la presencia de estradiol y la activación del receptor adrenérgico α2B, mientras que en los machos se requiere de la activación de los receptores opioides. Datos recientes de nuestro laboratorio demuestran que la administración espinal de cannabidiol (un cannabinoide derivado de la planta Cannabis sativa) alivia el dolor preferentemente en ratones hembra (Islas-Espinoza et al., 2025). Este efecto lo realiza mediante la activación de los receptores activados por proliferadores de peroxisomas γ (PPARγ). Finalmente, encontramos que el factor neurotrófico derivado del cerebro (BDNF) induce dolor mediante la activación del receptor proteína-tirosina cinasa B (TrkB) en los machos, mientras que el BDNF activa al receptor a neurotrofina p75 (p75NTR) en las hembras sometidas a estrés crónico. Estos hallazgos sugieren que el bloqueo espinal de los receptores GABAA α5, la activación espinal de los receptores GABAA α6, las activación sistémica de los receptores adrenérgicos α2B y la activación espinal de los receptores PPARγ sería más efectivo en mujeres que en hombres. En contraste, el bloqueo del receptor espinal p75NTR aliviaría el dolor inducido por estrés en las mujeres, mientras que el bloqueo del receptor espinal TrkB aliviaría el dolor por estrés en los hombres (Figura 2).
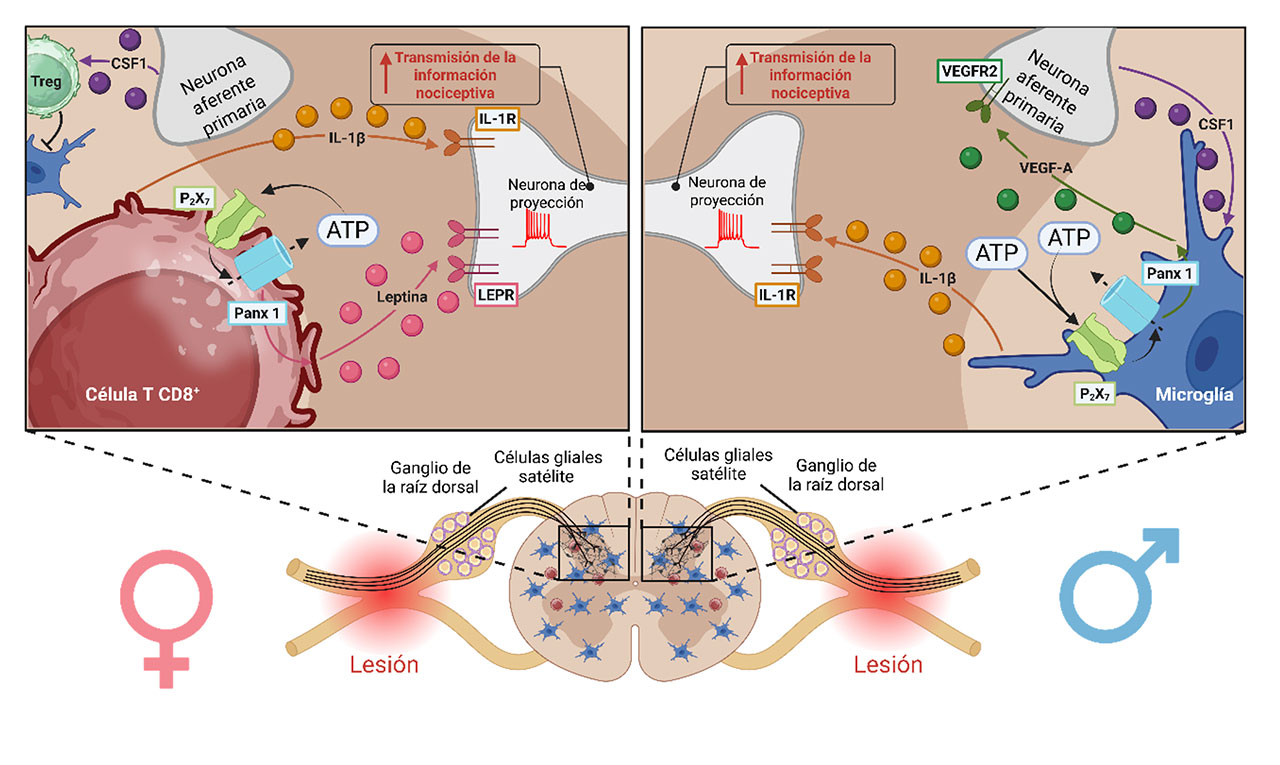
Otros estudios también demuestran la presencia de mecanismos divergentes entre ratones hembra y macho. La evidencia sugiere que la proliferación de la microglía juega un papel importante en la expresión de dolor neuropático en machos, pero no en hembras (Taves et al., 2016), mientras que la infiltración de células T participa en el dolor en las hembras. Otros hallazgos apoyan esta hipótesis. La ligadura de los nervios espinales induce dolor neuropático e impulsa la liberación del factor estimulante de colonias 1 (CSF1) de la terminal central de las neuronas aferentes primarias (Figura 3). De acuerdo con esto, el CSF1 activa a la microglía de machos, pero no de hembras. El CSF1 induce la activación de células T reguladoras (Treg) que a su vez suprimen la neuroinflamación inactivando el mecanismo dependiente de la microglía en los ratones hembra (Kuhn et al., 2021).
Un estudio reciente ha avanzado en el conocimiento acerca de los diferentes mecanismos de generación del dolor neuropático en hembras y machos. Los investigadores han encontrado que, aparte de los mecanismos descritos anteriormente, la activación de panexina, presente en la microglía, conduce a la liberación del factor de crecimiento endotelial vascular (VEGF) que a su vez induce dolor mediante la activación del receptor a VEGF en ratones macho, mientras que la activación de panexina (un canal que permite el paso de ATP) presente en células T (CD8+) promueve la liberación de leptina que su vez induce el dolor neuropático mediante la activación del receptor a leptina en ratones hembra con dolor neuropático (Fan et al., 2025) (Figura 3).
Actualmente somos testigos del progreso en el conocimiento de los mecanismos que conducen al dolor en roedores hembra y macho. Este progreso en el conocimiento se ha generado mediante la inclusión de hembras en los experimentos sobre el dolor. El impacto que las diferencias en los mecanismos para generar dolor en animales hembra y macho puede tener en el tratamiento del dolor en humanos se ha comenzado a vislumbrar, específicamente en el tratamiento de la migraña. Sin embargo, estas investigaciones podrían sentar las bases para el uso de analgésicos que funcionen sólo en mujeres o en hombres. También podrían ser útiles para desarrollar analgésicos que funcionen en ambos sexos.
Referencias
Avona, A., Burgos-Vega, C., Burton, M. D., et al. (2019). Dural calcitonin gene-related peptide produces female-specific responses in rodent migraine models. J Neurosci, 39(22), 4323–4331.
De la Luz-Cuellar, Y. E., Rodríguez-Palma, E. J., Franco-Enzástiga, Ú., et al. (2019). Blockade of spinal a5-GABAA receptors differentially reduces reserpine-induced fibromyalgia-type pain in female rats. Eur J Pharmacol, 858, 172443.
Fan, C. Y., McAllister, B. B., Stokes-Heck, S., Harding, E. K., Pereira de Vasconcelos, A., Mah, L. K., Lima, L. V., et al. (2025). Divergent sex-specific pannexin-1 mechanisms in microglia and T cells underlie neuropathic pain. Neuron, 113(6), 896–911.
Franco-Enzástiga, Ú., García, G., Murbartián, J., et al. (2021). Sex-dependent pronociceptive role of spinal a5-GABAA receptor and its epigenetic regulation in neuropathic rodents. J Neurochem, 156(6), 897–916.
Islas-Espinoza, A. M., Ramos-Rodríguez, I. I., Escoto-Rosales, M. J., et al. (2025). Cannabidiol reduces neuropathic pain and cognitive impairments through activation of spinal PPARg. J Pain, 30, 105378.
Kuhn, J. A., Vainchtein, I. D., Braz, J., et al. (2021). Regulatory T-cells inhibit microglia-induced pain hypersensitivity in female mice. eLife, 10, e69056
Mogil, J. S. y Chanda, M. L. (2005). The case for the inclusion of female subjects in basic science studies of pain. Pain, 117, 1–5.
Rodríguez-Palma, E. J., De la Luz-Cuellar, Y. E., Islas-Espinoza, A. M., et al. (2023). Activation of a6-containing GABAA receptors induces antinociception under physiological and pathological conditions. Pain, 164(5), 948–966.
Singh, S., Kopruszinski, C. M., Watanabe, M., Dodick, D. W., Navratilova, E., Porreca, F. (2024). Female-selective mechanisms promoting migraine. J Headache Pain, 25(1), 63.
Taves, S., Berta, T., Liu, D. L., et al. (2016). Spinal inhibition of p38 MAP kinase reduces inflammatory and neuropathic pain in male but not female mice: Sex-dependent microglial signaling in the spinal cord. Brain Behav Immun, 55, 70–81.
*Foto de portada creada con Chat GPT











