Los aminoácidos y las proteínas
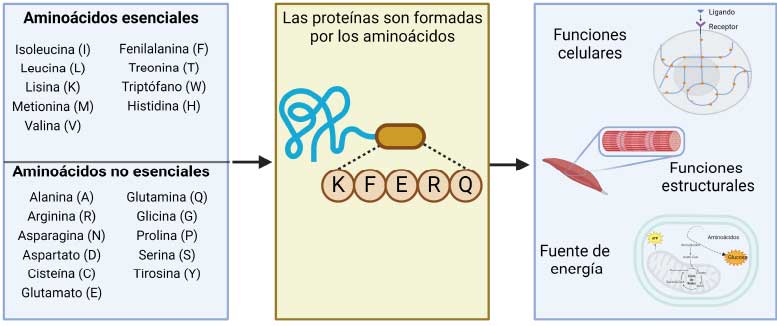
Las proteínas son las biomoléculas más abundantes en todas las células. Tienen diversas funciones esenciales, como la señalización celular, la regulación del ciclo celular, el metabolismo y la producción de energía, además de que son componentes estructurales, como la actina y la miosina en el músculo (Figura 1) (Nelson & Cox, 2017). Las proteínas están formadas por 20 aminoácidos, los cuales se combinan de diferente manera para cada proteína y se unen a través de un enlace que se conoce como peptídico.
Las proteínas se pueden consumir y romper hasta los aminoácidos que las componen, para que las células puedan utilizarlas como materia prima para obtener energía o bien, para formar nuevas proteínas. Así, desde un punto de vista nutricional, los aminoácidos pueden clasificarse en dos grupos principales: no esenciales y esenciales (Ellington & Cherry, 1996).
Los aminoácidos no esenciales se componen de 11 miembros y son aquéllos que, además de obtenerse a través de la dieta, también pueden sintetizarse por nuestras células a través de diferentes reacciones químicas. Los aminoácidos que pertenecen a este grupo son: alanina, arginina, asparagina, aspartato, cisteína, glutamato, glutamina, glicina, prolina, serina y tirosina (Figura 1).
Los aminoácidos esenciales no pueden ser sintetizados por nuestro organismo, por lo que necesitamos consumirlos con los alimentos. Los aminoácidos que forman este grupo son: isoleucina, leucina, lisina, metionina, valina, fenilalanina, treonina, triptófano y arginina (Figura 1).
Aminoácidos de cadena ramificada
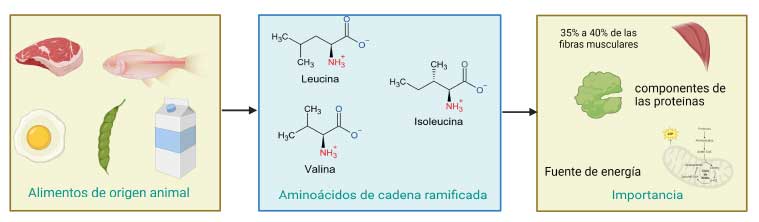
Entre los aminoácidos esenciales se encuentra un grupo denominado aminoácidos de cadena ramificada (AACR), que se integra por leucina, isoleucina y valina. Las principales fuentes de obtención de estos aminoácidos son las carnes rojas y de aves o pescado (20 a 30%) (Ahmad, R.S. 2018), productos lácteos (10 a 25%) (Khan, I.T. 2019), huevo (15 a 20%), insectos, leguminosas y frutos secos (alrededor de 10%) (Figura 2), siendo la ingesta recomendada para adultos de leucina, isoleucina y valina de 39, 20 y 26 mg/Kg de peso por día, respectivamente (WHO, 2007).
Este grupo de aminoácidos comparte propiedades químicas que, al formar parte de las proteínas, contribuyen a que adopten su estructura funcional. Los AACR son los aminoácidos más abundantes en las fibras musculares, representando entre el 35 y 40 % del total de aminoácidos en éstas, lo cual los convierte en nutrientes importantes para la locomoción, la generación de fuerza y la ganancia de masa muscular. Los AACR pueden ser utilizados por el metabolismo como materia prima para la producción de glucosa y cuerpos cetónicos que son fuentes de energía para las células. Este proceso es de gran importancia en periodos de ayuno prolongado o escasez de otro tipo de nutrientes (Figura 2) (Neinast et al., 2019).
Por lo tanto, debido a su capacidad de estimular la ganancia de masa muscular y a la importancia de este tejido en la regulación de la concentración de glucosa en la sangre, se han estudiado los beneficios del consumo de una dieta rica en AACR en la ganancia de masa muscular y en la prevención de la obesidad y diabetes tipo 2 (Martinho, D.V. 2022; Solon-Biet, S.M. 2022).
Los AACR en el ejercicio
Desde levantar mucho peso, correr un maratón, hacer ejercicio en un gimnasio, nadar, caminar e incluso levantarse por la mañana, requiere la generación de fuerza, la cual proviene de la contracción y relajación coordinada de las fibras musculares. Éstas son un conjunto de células llamadas miocitos que forman una estructura en forma de tubo, las cuales pueden contraerse y relajarse gracias a que contienen miofibrillas formadas por proteínas como la actina y la miosina (Mukund & Subramaniam, 2020).
El uso de suplementos de AACR en la práctica del ejercicio, se ha convertido en una estrategia habitual debido a que promueven la ganancia de masa muscular, fuerza, composición corporal de los sujetos, atenuación de la fatiga, reducción del dolor y daño muscular, y el efecto de la respuesta anabólica mediante la activación de la síntesis de proteínas (Rabassa, J. 2017). Además, se ha reportado que la ingesta de AACR, previo a realizar ejercicio, ayuda a mitigar la degradación de proteínas durante el periodo de recuperación (Matsumoto, K. 2019). Se ha informado que la ingesta de máximo 450 mg/kg de peso de los tres AACR en suplementos es bien tolerado en adultos sanos (Gleeson, 2005). Sin embargo, el consumo de cantidades elevadas de AACR se asocia a un incremento en la presencia de moléculas inflamatorias y de especies reactivas de oxígeno en las células endoteliales, lo que contribuye a iniciar diversas patologías cardiovasculares, como la aterosclerosis o la hipertensión, tanto en pacientes con diabetes tipo 2, como en deportistas que consumen cantidades elevadas de suplementos con AACR (Zhenyukh, 2018). Por lo tanto, siempre es recomendable consultar con un profesional de la salud o un nutricionista antes de iniciar cualquier suplementación, ya que las necesidades varían según la persona y el tipo de entrenamiento.
La relación de los AACR con la obesidad y diabetes tipo 2
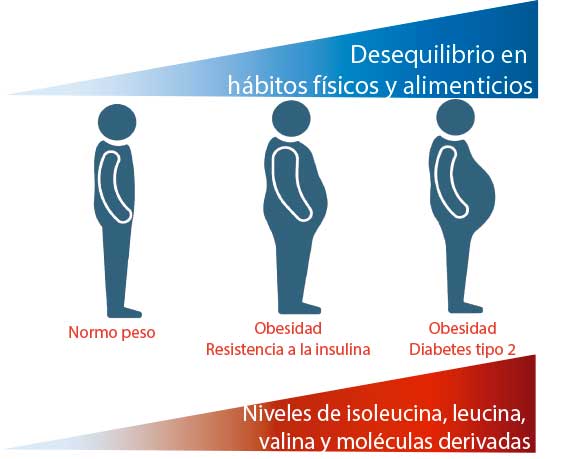
La obesidad se define como una acumulación excesiva de grasa que puede afectar a la salud. Esta condición es el principal factor de riesgo para desarrollar resistencia a la insulina (RI), la cual se ha identificado como un factor clave en la aparición y progresión de la diabetes tipo 2 (Pérez, L., 2022).
Diversos estudios, en los cuales se analiza el perfil completo de las moléculas del metabolismo celular presentes en la sangre, permiten identificar compuestos que tienen una concentración diferente en este fluido en alguna condición de enfermedad, en comparación con personas sanas. Estas moléculas pueden usarse como biomarcadores de la enfermedad en cuestión. Los AACR, así como varias moléculas producto de su metabolismo (cetoácidos de cadena ramificada, 3-hidroxiisobutirato, C3 y C5 acilcarnitinas), aunque juegan un papel muy importante en una gran cantidad de procesos fisiológicos, se ha encontrado que tienen una relación significativa con la obesidad, la RI y la diabetes tipo 2, pues se encuentran acumulados en la sangre de las personas con estas enfermedades, e incluso se han propuesto como biomarcadores de diagnóstico (Figura 3) (Newgard, C. et al., 2009).
Sin embargo, aún no está completamente claro por qué los AACR se acumulan en la sangre de estos pacientes y si ésto es una causa o consecuencia de la RI. Se ha propuesto que el consumo excesivo de nutrientes en obesidad sobre activan señales celulares que pueden tener como consecuencia RI. Por otro lado, se ha reportado que en condiciones de obesidad y RI, hay una menor cantidad de proteínas encargadas del metabolismo de los AACR, lo que promueve la acumulación de estos aminoácidos circulantes (Lynch y Adams, 2014). Resolver este enigma permitiría ahondar en el entendimiento de los mecanismos involucrados en la RI y diabetes tipo 2, y por tanto, diseñar estrategias que contribuyan a su tratamiento y prevención.
Debido a esto, nuestro grupo de investigación estudia este tópico utilizando modelos de obesidad y resistencia a la insulina inducidos por dieta en ratones, así como en pacientes. Con esto hemos entendido qué pasa con las reacciones químicas encargadas de procesar a los AACR y cómo se modifican en presencia de estas condiciones.
Considerando esta situación contradictoria de los AACR, es fundamental la obtención de aminoácidos esenciales a través de una dieta equilibrada y variada. Además, como se mencionó anteriormente, si se busca consumir suplementos de AACR, siempre será recomendable la evaluación previa de un médico o nutricionista.
Referencias
Ahmad, R. S., Imran, A., & Hussain, M. B. (2018). Nutritional Composition of Meat. InTech. doi: 10.5772/intechopen.77045
Ellington, A. and Cherry, J.M. (1996). Characteristics of Amino Acids. Current Protocols in Molecular Biology, 33 (1) A.1C.1-A.1C.12.
Gleeson M. (2005). Interrelationship between Physical Activity and Branched-Chain Amino Acids. The Journal of Nutrition,135(6), 1591S-1595S.
Joint WHO/FAO/UNU Expert Consultation (2007). Protein and amino acid requirements in human nutrition. World Health Organ Tech Rep Ser, 935.
Khan, I.T., Nadeem, M., Imran, M., Ullah R., Ajmal, M., Jaspal M.H. (2019). Antioxidant properties of Milk and dairy products: a comprehensive review of the current knowledge. Lipids in health and disease,18 (41), 1-13.
Lynch C.J., Adams S.H. (2014). Branched-chain amino acids in metabolic signaling and insulin resistance. Nat Rev Endocrinol, 10(12), 723-36.
Martinho, D. V., Nobari, H., Faria, A., Field, A., Duarte, D., & Sarmento, H. (2022). Oral Branched-Chain Amino Acids Supplementation in Athletes: A Systematic Review. Nutrients, 14(19), 4002.
Matsumoto, K., Koba, T., Hamada, K., Tsujimoto, H., & Mitsuzono, R. (2009). Branched-chain amino acid supplementation increases the lactate threshold during an incremental exercise test in trained individuals. Journal of nutritional science and vitaminology, 55(1), 52–58.
Mukund, K., & Subramaniam, S. (2020). Skeletal muscle: A review of molecular structure and function, in health and disease. Wiley interdisciplinary reviews. Systems biology and medicine, 12(1), e1462.
Neinast, M., Murashige, D., & Arany, Z. (2019). Branched Chain Amino Acids. Annual review of physiology, 81, 139–164.
Nelson, D. L., & Cox, M. M. (2017). Proteins. In Lehninger Principles of Biochemistry (7th ed.). W.H. Freeman.
Newgard C.B., An J., Bain J.R., Muehlbauer M.J., Stevens R.D., Lien L.F., Haqq A.M., Shah S.H., Arlotto M., Slentz C.A., Rochon J., Gallup D., Ilkayeva O., Wenner B.R., Yancy W.S. Jr, Eisenson H., Musante G., Surwit R.S., Millington D.S., Butler M.D., Svetkey L.P. (2009). A branched-chain amino acid-related metabolic signature that differentiates obese and lean humans and contributes to insulin resistance. Cell Metabolism, 9(4), 311-26.
Pérez Lagos, F. (2022). Efecto dual de los aminoácidos de cadena ramificada y su relación con la resistencia a la insulina. MLS Health and Nutrition Research, 1(1), 23-41.
Rabassa-Blanco, Jordi, & Palma-Linares, Imma. (2017). Efectos de los suplementos de proteína y aminoácidos de cadena ramificada en entrenamiento de fuerza: revisión bibliográfica. Revista Española de Nutrición Humana y Dietética, 21(1), 55-73.
Solon-Biet, S. M., Griffiths, L., Fosh, S., Le Couteur, D. G., Simpson, S. J., & Senior, A. M. (2022). Meta-analysis links dietary branched-chain amino acids to metabolic health in rodents. BMC biology, 20(1), 19.
Yao H., Li K., Wei J., Lin Y. and Liu Y. (2023). The contradictory role of branched-chain amino acids in lifespan and insulin resistance. Frontiers in nutrition. 10:1189982.
Zhenyukh, O., González-Amor, M., Rodrigues-Diez, R. R., Esteban, V., Ruiz-Ortega, M., Salaices, M., Mas, S., Briones, A. M., & Egido, J. (2018). Branched-chain amino acids promote endothelial dysfunction through increased reactive oxygen species generation and inflammation. Journal of cellular and molecular medicine, 22(10), 4948–4962.
Imagen de portada: Freepik













