Según la Organización Mundial de la Salud (OMS) el cáncer de mama es el tipo de cáncer más común, en 2020 se reportaron más de 2,2 millones de casos a nivel mundial y alrededor de 685 000 mujeres fallecieron como consecuencia de esa enfermedad. Se estima que cerca de una de cada 12 mujeres enfermarán de cáncer de mama a lo largo de su vida [1].
Carcinogénesis y genes implicados en el cáncer de mama
La generación del cáncer comprende modificaciones en los genes de una célula normal. Los principales genes implicados en la carcinogénesis mamaria son los oncogenes y los genes supresores de tumores [2].
Los oncogenes son versiones alteradas de los proto oncogenes. Éstos estimulan normalmente la división celular, de ellos dependen el desarrollo embrionario, la cicatrización de las heridas y la regeneración de las células. Entre los principales oncogenes involucrados en el cáncer de mama se encuentra el HER-2.
HER-2
El oncogen HER-2 codifica a un receptor o proteína que se encuentra en la membrana de las células. La activación de este receptor inicia una cascada de señalización, es decir, envía señales desde el exterior de la célula hacia el núcleo para estimular el crecimiento y la división celular.
Esta activación depende de la dimerización (unión de dos moléculas) del HER 2 con algún otro miembro de la familia HER (HER-1, HER-3, HER-4). Estos receptores se encuentran en una conformación “cerrada”, en la cual el dominio de dimerización está oculto y, como resultado, el receptor es incapaz de formar dímeros. La unión de una molécula o ligando a estos receptores genera un cambio conformacional permitiéndole dimerizarse e iniciar la cascada de señalización. HER2 es el único receptor de la familia que existe en una conformación “abierta” lista para dimerizarse. Después de la dimerización; se activan las vías de señalización por medio de la fosforilación, es decir, se agrega un grupo fosfato, lo cual provoca que se desencadenen diversos procesos celulares (Figura 1) [3].
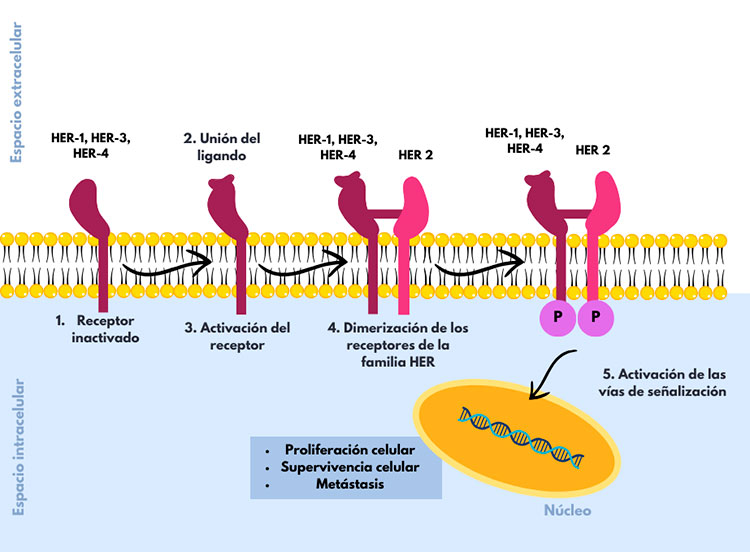
Figura 1. Esquema de la activación del receptor HER 2. La unión del ligando al receptor genera un cambio conformacional que permite la dimerización con otro receptor de la familia HER. Después se activan las vías de señalización por medio de la fosforilación, provocando diversos procesos celulares tales como proliferación celular, supervivencia y metástasis.
La amplificación de HER-2 se presenta en 15-25 % de los carcinomas mamarios primarios [4]. También está amplificado en un porcentaje similar de otros tipos de carcinomas como el cáncer de ovario, páncreas, vejiga o pulmón [5]. La amplificación de este gen produce una sobrexpresión del receptor, que va de los niveles normales de 30,000 receptores por célula hasta 1 millón de ellos,6 por lo que, al sobrexpresarse se contribuye a que la célula no muera y continúe proliferando.
Importancia del HER 2 como factor pronóstico y blanco terapéutico en el cáncer de mama
Una utilidad clínica del HER 2 es su valor pronóstico; ya que se ha demostrado que los tumores en los que se encuentra amplificado tienen mayor resistencia a los tratamientos convencionales como la quimioterapia y la terapia hormonal, y además una menor tasa de supervivencia [5].
Otra utilidad de HER2 es su papel como diana terapéutica, pues brinda una alternativa en el tratamiento del cáncer de mama. Con el paso de los años se han ido desarrollando nuevas estrategias de manejo terapéutico. La sobrexpresión de este receptor en las células se ha utilizado para desarrollar moléculas que puedan dirigirse a sitios específicos del receptor, como son los anticuerpos contra HER2 o anticuerpos antitumorales dirigidos contra HER2. Uno de ellos es el fármaco trastuzumab. Un estudio demostró que la adición de trastuzumab a la quimioterapia mejoraba la supervivencia general en mujeres con cáncer de mama metastásico positivo para Her-2. Otro anticuerpo monoclonal es el pertuzumab, el segundo más utilizado (Figura 2); se ha mostrado que la combinación de trastuzumab y pertuzumab inhibe sinérgicamente el crecimiento tumoral [6].
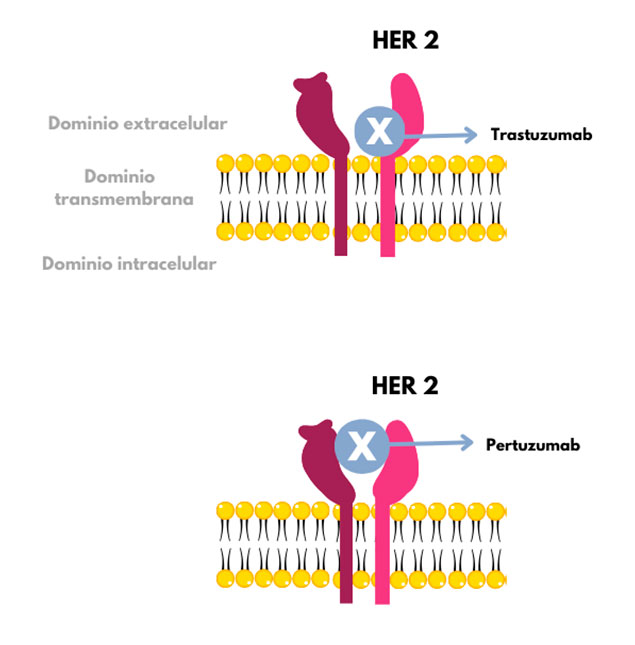
A pesar de este beneficio, se han documentado efectos adversos relacionados con los anticuerpos monoclonales, como cardiotoxicidad, reacciones alérgicas, resistencia al fármaco, así como la falta de memoria inmunológica [6], lo cual nos llevaría a una aplicación continua del fármaco. Por ello, se ha estudiado otra forma de inmunoterapia con la que se pueda estimular al sistema inmunológico de la paciente para atacar el cáncer mediante la inducción de una respuesta inmune y además desarrollar memoria inmunológica, que puede lograrse con el empleo de vacunas.
¿Vacunación contra HER 2 positivo?
Las vacunas contra el cáncer están diseñadas para inducir una respuesta inmune contra el antígeno administrado. La mayoría de ellas emplean moléculas diana denominadas antígenos asociados con tumores (TAA) [7], descritas como proteínas sobrexpresadas en las células en cualquier tipo de cáncer, como el receptor HER 2. Se han estudiado vacunas contra el cáncer HER 2 positivo basadas en moléculas formadas por aminoácidos o péptidos de HER 2, con el objetivo de amplificar la respuesta inmune asociada con la activación de células T y la producción de anticuerpos.
Después de la administración de la vacuna, se activa el sistema inmunológico; las moléculas liberadas por la vacuna son capturadas por células que se encargan de presentar este antígeno (conocidas como células presentadoras de antígenos) a dos tipos de linfocitos T conocidos como células T CD4+ y células T CD8+. Las células T CD4+ se diferencian en células Th1 y Th2; las células Th1 se encargarán de liberar moléculas para reclutar células denominadas monocitos asesinos naturales (NK, por sus siglas en ingles) y células T citotóxicas encargadas de generar una respuesta tóxica contra aquellas células que expresen HER 2. Las células T CD4+ y CD8+ son capaces de diferenciarse en células de memoria. Durante este proceso, las células Th2 derivadas de las células T CD4+ secretan ciertas proteínas que se encargan de activar y de regular la diferenciación de las células B en células plasmáticas, las cuales producen anticuerpos (Figura 3) [7].
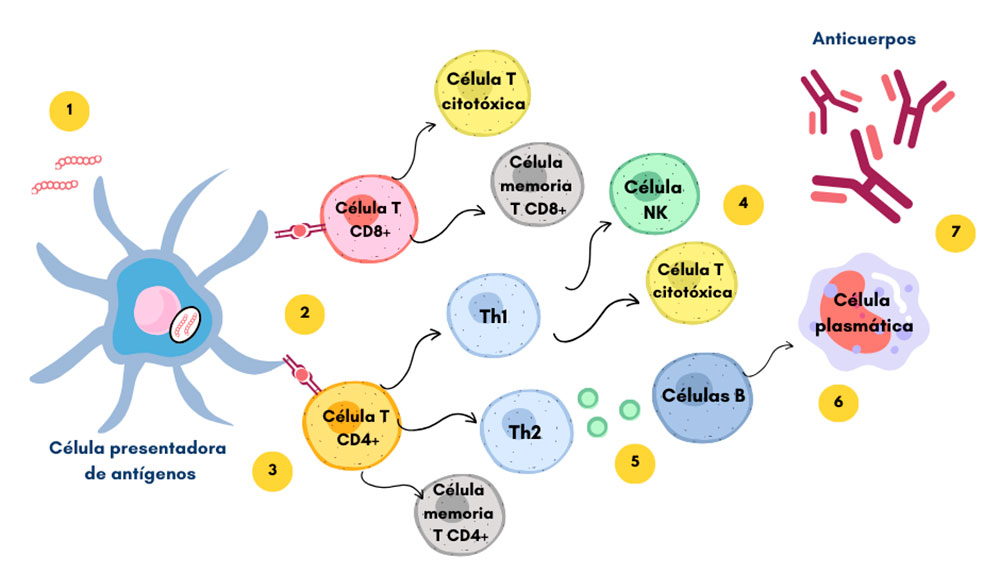
El empleo de vacunas contra el cáncer de mama HER 2 positivo se encuentra en ensayo clínico fase l, es decir, aún bajo investigación [8]. Además, las vacunas aún no se consideran una forma de prevención para el cáncer de mama; su objetivo es la prevención de metástasis y la recurrencia del tumor, por lo que podría ser una alternativa al uso de anticuerpos monoclonales, o su uso podría combinarse con la terapia convencional.
Referencias bibliográficas
[1] Organización Mundial de la Salud. (2021). Cáncer de mama. Recuperado de: https://www.who.int/es/news-room/fact-sheets/detail/breast-cancer#:~:text=El%20c%C3%A1ncer%20de%20mama%20es,de%20mortalidad%20en%20las%20mujeres
[2] Miguel-Soca, Pedro, Argüelles González, Ivis, & Peña González, Marisol. (2016). Factores genéticos en la carcinogénesis mamaria. Revista Finlay, 6(4), 299-316. Recuperado en 28 de febrero de 2023, de http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S2221-24342016000400007&lng=es&tlng=es
[3] Colonia, Ana, Rivera, Juliana, Orozco, Juan, & Marín, Daniel. (2015). HER-2: Un marcador molecular usado en el diagnóstico, pronóstico y tratamiento del cáncer de mama. Revista Médica de Risaralda, 21(1), 31-37. Retrieved March 08, 2023, from http://www.scielo.org.co/scielo.php?script=sci_arttext&pid=S0122-06672015000100007&lng=en&tlng=es
[4] Miguel-Soca, Pedro, Argüelles González, Ivis, & Peña González, Marisol. (2016). Factores genéticos en la carcinogénesis mamaria. Revista Finlay, 6(4), 299-316. Recuperado en 28 de febrero de 2023, de http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S2221-24342016000400007&lng=es&tlng=es.
[5] R. Colomer, S. Montero, S. Ropero. (2001). El oncogén HER2 como ejemplo del progreso diagnóstico y terapéutico en cáncer de mama. Vol. 14. Núm. 1, páginas 8-19. Recuperado de: https://www.elsevier.es/es-revista-revista-senologia-patologia-mamaria–131-articulo-el-oncogen-her2-como-ejemplo-13013625 y Díaz Miguel Maseda. (2021). Cáncer de mama y HER 2. Recuperado de: https://www.master-mastologia.com/wp-content/uploads/2021/01/PRESENTACION_HER-2-y-su-implicacion-clinica_Mariano-Diaz-Miguel.pdf
[6] Tobias J, Garner-Spitzer E, Drinić M, Wiedermann U. (2022). Vaccination against Her-2/neu, with focus on peptide-based vaccines. ESMO Open. 2022 Feb;7(1):100361. Recuperado de: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8760406/
[7] Nicolás-Morales ML, Luisa-Sanjuan A, Gutiérrez-Torres M, Vences-Velázquez A, Ortuño-Pineda C, Espinoza-Rojo M, Navarro-Tito N, Cortés-Sarabia K. (2022). Peptide-Based Vaccines in Clinical Phases and New Potential Therapeutic Targets as a New Approach for Breast Cancer: A Review. Vaccines; 10(8):1249. Recuperado de: https://doi.org/10.3390/vaccines10081249
[8] María L. Disis, yushe Dang, Andrew L. Coveler, Jennifer S. Childs, Doreen Higgins, Ying Lu, Jingzhou, Sean Mackay, Lupe G. Salazar. (2023). A Phase I/II Trial of HER2 Vaccine–Primed Autologous T-Cell Infusions in Patients with Treatment Refractory HER2–Overexpressing Breast Cancer. Clinical cancer research; 29 (17): 3362–3371.Recuperado de: https://doi.org/10.1158/1078-0432.CCR-22-3578












