Introducción
La edición genética tiene el potencial de contribuir al mejoramiento de los cultivos agrícolas, ofreciendo herramientas para introducir cambios deseados en el genoma de las plantas. Entre los instrumentos para la edición genética, la tecnología CRISPR-Cas destaca por su capacidad para editar genes con precisión, abriendo nuevas posibilidades para la creación de germoplasma de maíz con mejor rendimiento, mayor resistencia a plagas y enfermedades, tolerancia a condiciones climáticas adversas y mejor calidad nutricional.
En el mundo, la implementación de CRISPR-Cas en el mejoramiento del maíz ya está en marcha, con resultados prometedores que subrayan su potencial para enfrentar los desafíos agrícolas del siglo XXI. Sin embargo, en México, país centro de origen y domesticación del maíz, las políticas públicas actuales parecen limitar la adopción de esta tecnología innovadora. Un argumento común en contra de la edición genética del maíz es la de proteger las líneas criollas y la diversidad del maíz en México. Sin embargo, valorar y utilizar la diversidad genómica del maíz en México es precisamente de las principales ventajas de la edición genómica. La posibilidad de hacer cambios discretos en la secuencia de genes nos facilita aprovechar la diversidad alélica en maíz en dos sentidos. Por un lado, se podría reconstituir en líneas mejoradas de maíz que ya son de uso común alelos útiles descubiertos en maíces criollos. Por otro lado, la edición genómica podría conferir resistencia a plagas u otras características a líneas criollas haciendo cambios muy precisos al genoma. En ambos casos se evita hacer tantas cruzas como en el mejoramiento tradicional en donde se mezclan todas las características de las dos líneas y después es necesario seleccionar otra vez los rasgos deseados, un proceso largo y laborioso.
En este artículo, exponemos los avances recientes en la aplicación de CRISPR-Cas para la edición genética del maíz, destacando estudios claves y casos de éxito en otros países. Además, exponemos los desafíos técnicos y éticos asociados con esta tecnología. Nuestro objetivo es resaltar el potencial de CRISPR-Cas en México para mejorar el maíz en su productividad y resistencia al cambio climático, asegurando así su sostenibilidad y beneficios para generaciones futuras.
Origen y principios de CRISPR-Cas9
Los elementos CRISPR (repeticiones palindrómicas cortas agrupadas y regularmente interespaciadas; en inglés Clustered Regularly Interspaced Short Palindromic Repeats) existen naturalmente en el genoma de muchas especias de bacterias y otros organismos unicelulares. Las secuencias CRISPR derivan del ADN de los virus y plásmidos (ADN circular que se puede transferir entre células) que infectan a las bacterias. Como las secuencias CRISPR son iguales a las secuencias de los virus que infectan a las bacterias, sirven como un sistema inmune: cuando un virus infecta una célula bacteriana, las secuencias CRISPR se transcriben para hacer moléculas de ARN cortas llamadas RNA guías (gRNA) que sirven para llevar la enzima Cas9 al ADN del virus o plásmido. Como Cas9 es una enzima endonucleasa, Cas9 corta e inhabilita la secuencia del virus o plásmido, cumpliendo su función como un tipo de sistema inmunitario procariótico (Horvath & Barrangou, 2010; https://es.wikipedia.org/wiki/CRISPR).
El descubrimiento del sistema CRISPR-Cas en microorganismos estableció las bases para optimizar el sistema de los gRNA y la enzima Cas9 para modificar genes de manera precisa en otros organismos, resultando en un Premio Nobel de Química para Emmanuelle Charpentier y Jennifer Doudna en el año 2020. Inicialmente, el sistema de CRISPR-Cas9 fue utilizado para cortar una secuencia específica de ADN, lo que generaba errores ocasionales en la reparación de la ruptura de la cadena del ADN y consecuentemente la inactivación del gen. Últimamente, los sistemas de CRISPR-Cas9 se han vuelto más sofisticados, sirviendo no sólo para inactivar genes, sino también para generar cambios precisos en la secuencia de genes de manera que se pueda regular su expresión. Quitar la función de un gen puede ser útil para el mejoramiento, por ejemplo, inactivando un receptor que es necesario para que un patógeno pueda entrar a la célula de una planta, mientras que cambios precisos podrían resultar en la actividad mejorada de una enzima o en un cambio de los elementos reguladores de genes.
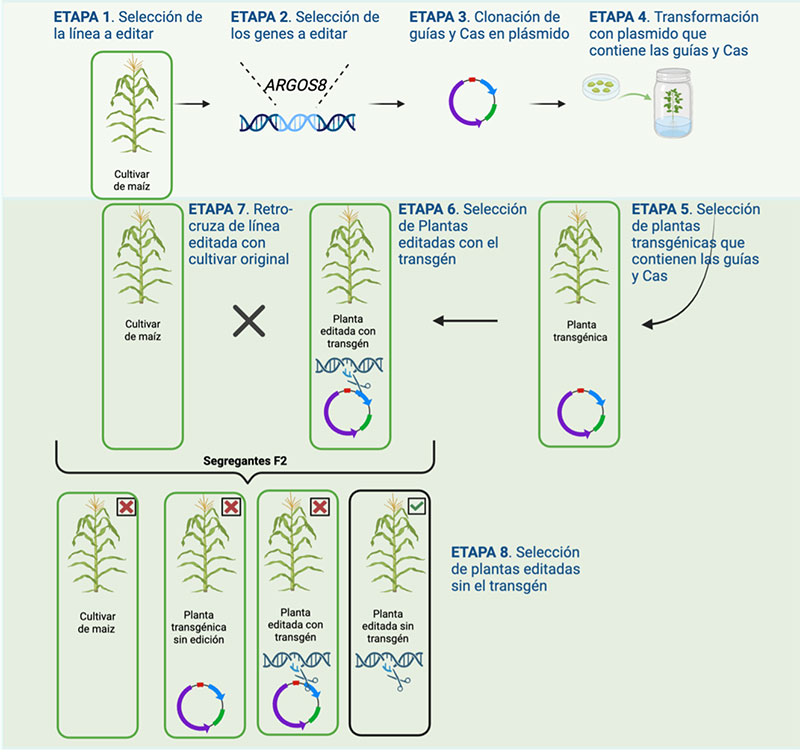
En el contexto del mejoramiento del maíz en México, CRISPR-Cas9 resulta una alternativa crucial debido a las restricciones sobre cultivos transgénicos. Es importante resaltar que, a diferencia de los cultivos transgénicos tradicionales que requieren los transgenes para su funcionalidad, los cultivos editados mediante CRISPR producen plantas agrícolas prácticamente idénticas a la planta original, ya que eliminan cualquier componente transgénico requerido durante su creación, por lo que esta tecnología se posiciona como una alternativa real para desarrollar variedades de maíz capaces de responder a los desafíos actuales del campo y de brindar beneficios directos a los agricultores (Figura 1).
El mejoramiento convencional comparado con la edición genómica
En los últimos 100 años, casi todos los avances en la productividad del maíz y de otros cultivos han sido por el mejoramiento convencional. El mejoramiento convencional utiliza la variación genética que existe en líneas criollas para transferir rasgos útiles a líneas ya mejorados (líneas élites) a través de cruzas. La mayoría de esta variación genética consiste en diferentes secuencias de genes, que se llaman ‘alelos’, es decir los alelos de un gen son variantes del mismo gen. Considerando la vasta diversidad genética del maíz criollo en México, en el país existen cientos de alelos de cada gen de maíz. Por eso las líneas criollas de México (y también la diversidad de maíces que se siembran ahora en todo el mundo) tienen un valor cultural y agronómico incalculable.
Las líneas criollas quizás no son las más productivas, o les faltan otras características que son convenientes en la agricultura moderna (por ejemplo, una arquitectura de la planta que permite cosechar los granos fácilmente), pero sí pueden tener ventajas como resistencia a plagas o tolerancia a sequía, rasgos que generalmente dependen de muchos genes diferentes. Por eso, transferir un rasgo útil de una línea criolla a una línea ‘élite’ puede ser un proceso de larga duración, aún con avances recientes como marcadores moleculares y modelos de predicción genómica. Después de cruzar la línea criolla con una línea élite, la primera generación es una mezcla de todos los alelos de las dos líneas, y hay que seleccionar otra vez los alelos que confieren los rasgos de la línea élite además de los alelos de la línea criolla que confieren resistencia a sequía, por poner un ejemplo. Este proceso puede tomar muchas generaciones, considerando un máximo de dos generaciones por año en cultivos como maíz. La enorme ventaja del mejoramiento tradicional es que la selección de los rasgos deseables ocurre en condiciones de campo, asegurando que los genotipos seleccionados tienen relevancia para la agricultura.
La edición genómica por CRISPR-Cas tiene ventajas y desventajas complementarias al mejoramiento tradicional. De las ventajas más destacadas de CRISPR-Cas es su precisión: se puede hacer un cambio en un solo gen (es decir, crear un nuevo alelo) sin hacer ningún cambio en el resto del genoma, un gran contraste con el mejoramiento tradicional mencionado arriba que implica cruzamientos repetidos y selección. Con edición genómica, se puede hacer un cambio directamente en una línea élite y después eliminar el transgén con la enzima Cas, resultando en una línea élite con la edición precisa del gen. De los retos de la edición genómica es el hecho que se tiene que entender el mecanismo del proceso de edición, es decir saber exactamente cual gen editar y que la edición de este gen tenga un impacto considerable en el rasgo deseado. Otro reto es asegurar que la edición del gen tiene el efecto esperado en condiciones de campo, no sólo en el laboratorio o en un invernadero. Precisamente para enfrentar este reto, cuando Rodríguez-Leal et al (2017) usaron CRISPR para buscar variación alélica para aumentar el tamaño de jitomates, hicieron la selección de nuevos genotipos directamente en el campo.
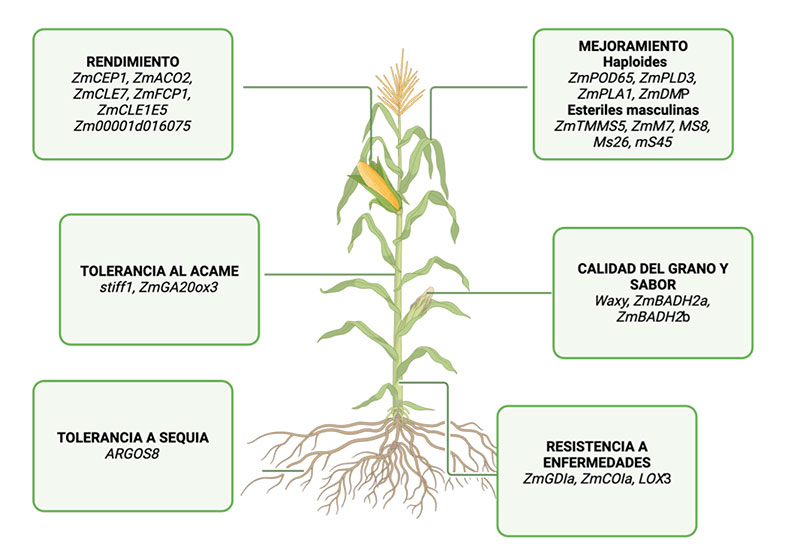
CRISPR-Cas no solo puede emplearse para la edición directa de genes en plantas, sino también para perfeccionar las técnicas de mejoramiento convencional. Por ejemplo, la tecnología de doble haploide puede crear individuos perfectamente homocigotos, al fijar rápidamente los genomas haploides recombinantes en una progenie homogénea, superando diversas limitaciones en el mejoramiento genético y posibilitando una evaluación rápida de los rasgos fenotípicos en el maíz (Figura 2). CRISPR-Cas ha permitido la edición de genes como ZmPOD65, ZmPLD3, ZmPLA1 y ZmDMP, generando haploides exitosos y proporcionando un enfoque para desentrañar los mecanismos moleculares de la inducción haploide (Jacquier et al., 2020; Jacquier et al., 2021; Jiang et al., 2022; Wang et al., 2022).
Otro ejemplo es la inducción de esterilidad masculina, que juega un papel crucial en la producción de semillas híbridas. CRISPR-Cas ha facilitado la creación de nuevas líneas masculinas estériles, mediante la edición de genes de fertilidad masculina como ZmTMS5 (Li et al., 2017), ZmMs7, MS8 (Chen et al., 2018), Ms26 y Ms45 (Liu et al., 2022b). Estas innovaciones permiten un mejoramiento de cultivos más rápido y preciso, esencial para enfrentar los desafíos agrícolas actuales en México, donde la mejora de la eficiencia y la rapidez en el desarrollo de nuevas variedades de maíz puede contribuir significativamente a la sostenibilidad y la seguridad alimentaria.
Nuevo germoplasma de maíz generado por CRISPR
Maíz con mejor rendimiento
El rendimiento del maíz está relacionado con múltiples rasgos de la planta, incluidos el porte de la planta, las dimensiones de la mazorca, y el número y peso de los granos por mazorca. La edición de genes clave asociados con estos rasgos puede contribuir significativamente a mejorar el rendimiento del grano de maíz, un objetivo crucial para enfrentar los desafíos agrícolas en México (Figura 2). Por ejemplo, la edición de los genes ZmCEP1 (Xu et al., 2021) y ZmACO2 (Ning et al., 2021), ha demostrado mejorar la altura de la planta, la longitud de las mazorcas, el número de granos por hilera, así como el tamaño y peso del grano en híbridos de maíz, lo que resulta en mejores rendimientos.
También se ha descubierto que la edición de los promotores en los genes ZmCLE7, ZmFCP1 y ZmCLE1E5 incrementan el tamaño del meristemo, mejorando los rasgos relacionados con el rendimiento del grano (Liu et al., 2021). Además, la eliminación del gen Zm00001d016075, un regulador negativo del número de filas de granos ha aumentado la cantidad de granos por mazorca y el rendimiento del grano (An et al., 2022).
La arquitectura vegetal (disposición y estructura de las partes de la planta, como hojas, tallos y mazorcas), también es un factor crítico para maximizar el rendimiento en condiciones de siembra de alta densidad. La edición del gen ZmRAVL1, un regulador positivo del ángulo de la hoja ha producido plantas con una arquitectura foliar erguida, optimizando el rendimiento en estos sistemas de cultivo (Tian et al., 2019).
Maíz resistente a enfermedades
El cambio climático ha incrementado la severidad de los daños ocasionado por el estrés biótico (plagas) en el cultivo del maíz en México y alrededor del mundo. La resistencia a estrés biótico del maíz es un rasgo cuantitativo complejo, determinado por múltiples genes y diversos factores ambientales. La tecnología de CRISPR ha resultado ser un éxito para incrementar la resistencia del maíz a las enfermedades (Figura 2).
Por ejemplo, la edición dirigida con CRISPR-Cas9 del gen ZmGDIa aumenta la resistencia del maíz contra el virus del enanismo áspero del maíz sin penalización agronómica (Liu et al., 2022a). De manera similar, la eliminación del gen ZmCOIa mejora la resistencia del maíz a la pudrición del tallo por Gibberella zeae (Ma et al., 2021). Otro ejemplo es la eliminación del gen LOX3, lo que mejora la resistencia del maíz a Ustilago maydis (Pathi et al., 2020).
Maíz tolerante al estrés abiótico
El cambio climático también ha incrementado la incidencia de sequías, afectando gravemente los rendimientos del maíz. De la misma manera, la tecnología CRISPR está siendo utilizada con éxito para mejorar la tolerancia a la sequía en maíz. Por ejemplo, Shi et al. (2017) editaron el gen ARGOS8, que regula la respuesta al etileno, una hormona involucrada en el estrés por sequía (Figura 2). Las plantas de maíz con el gen ARGOS8 editado en la secuencia promotora muestran una mayor expresión de ARGOS8, lo que aumenta su tolerancia a la sequía sin comprometer el rendimiento.
Otro caso de éxito ha sido el uso de CRISPR para editar el gen stiff1 (Zhang et al., 2020a), el cual es un regulador negativo de la fuerza del tallo del maíz. La inactivación de stiff1 confirió a las plantas un tallo más fuerte, beneficioso para la siembra de alta densidad y para prevenir el acame. También se han generado plantas de maíz semi-enanas mediante la edición del gen ZmGA20ox3 (Zhang et al., 2020b), lo que contribuye a la resistencia al acame, un problema ocasionado por fuertes vientos.
Maíz con mejoras nutricionales y características especiales de mercado
En la actualidad, la demanda de maíz especial, como maíz dulce, ceroso o tierno, está aumentando, y la tecnología CRISPR-Cas proporciona formas efectivas para crear estos germoplasmas. Recientemente se desarrollaron híbridos de maíz CRISPR-wx con mayor rendimiento mediante la edición de un alelo ceroso en 12 líneas endogámicas (Figura 2). Estas líneas exhibieron mayores contenidos de amilopectina en el almidón del endospermo, en comparación con los controles de tipo silvestre, manteniendo un rendimiento agronómico similar (Gao et al., 2020). Es importante destacar que estos maíces CRISPR-wx son superiores a los híbridos con alelos de wx introgresados y están exentos de la supervisión regulatoria sobre organismos genéticamente modificados en países como Estados Unidos, Argentina, Brasil y Chile, es decir están aprobados para su uso comercial, y no son considerados transgénicos.
Otro ejemplo de variedades de maíz con características especiales, todavía en proceso de liberarse al mercado, es el maíz aromático, similar al arroz. Esto se logra mediante la edición simultánea de los genes ZmBADH2a y ZmBADH2b, lo que genera un maíz aromático atractivo para el mercado al aumentar la acumulación de 2-acetil-1-pirrolina (Wang et al., 2021a). En el contexto mexicano, donde el maíz tiene un valor cultural y económico significativo, la capacidad para desarrollar variedades con mejoras nutricionales y características especiales podría abrir nuevos mercados.
Desafíos y perspectivas
Como muchos productos de la biotecnología están concebidos y desarrollados en el laboratorio, es de suma importancia probar líneas editadas por CRISPR en condiciones reales del campo, antes de concluir que la línea editada tendrá un beneficio agronómico (Khaipho-Burch et al., 2023). Hasta ahora, solamente los híbridos de maíz ceroso CRISPR han sido probadas a gran escala y lanzados para su comercialización (Gao et al., 2020). A nivel mundial, el desarrollo de variedades de maíz editado está en auge, y la investigación en campo para su uso en la agricultura en marcha. En México los avances sobre la edición de maíz son mínimos, lo que coloca a nuestro país en un rezago tecnológico. Este hecho subraya la necesidad de más investigaciones y pruebas para llevar las mejoras genéticas del laboratorio al campo y, finalmente, al mercado mexicano que proteja el maíz de México.
Otro aspecto importante a considerar es que la edición con CRISPR-Cas9 en maíz, enfrenta tres desafíos principales: la baja frecuencia de edición de genes, la baja eficiencia de la transformación genética, y la limitada cantidad de materiales de maíz susceptibles de transformación. Superar estos obstáculos es esencial para maximizar el potencial de CRISPR-Cas en el mejoramiento del maíz. En México, donde la biodiversidad del maíz es crucial para la seguridad alimentaria y la cultura, abordar estos desafíos podría facilitar la adopción de tecnologías avanzadas y asegurar la sostenibilidad y la productividad de los cultivos de maíz en el futuro.
Regulación y aceptación pública
El uso de CRISPR en cultivos plantea cuestiones regulatorias y de aceptación pública. Es crucial desarrollar marcos regulatorios que garanticen la seguridad de los organismos editados genéticamente, y promover una comunicación clara y transparente sobre los beneficios y riesgos de la tecnología CRISPR para ganar la confianza del público. En México, donde las políticas públicas sobre organismos genéticamente modificados son estrictas, la adopción de CRISPR podría beneficiarse con un enfoque regulatorio más flexible, similar al de Estados Unidos, Canadá o Japón, donde la legislación sobre CRISPR es menos restrictiva que para los transgénicos.
La aceptación pública de los cultivos editados genéticamente también es un desafío significativo. Es esencial fomentar un diálogo abierto y basado en la evidencia científica. Esto ayudará a construir una comprensión más profunda y una mayor aceptación de esta tecnología innovadora.
Conclusión
La tecnología CRISPR-Cas9 ofrece un potencial significativo para la mejora genética del maíz, permitiendo desarrollar variedades más resistentes a enfermedades, tolerantes a la sequía y con mejores características nutricionales. Además, CRISPR puede acelerar el proceso de mejoramiento, permitiendo a los fitomejoradores desarrollar nuevas variedades de maíz de manera más rápida y eficiente. En el contexto mexicano, donde el maíz es un recurso vital tanto cultural como económicamente, la adopción de CRISPR podría ser clave para enfrentar los retos del cambio climático y la demanda creciente de alimentos. A medida que la tecnología avance y se aborden los desafíos actuales, CRISPR podría contribuir a la agricultura del maíz, fomentando la seguridad alimentaria y la sostenibilidad de México y el mundo.
Referencias
An, Y., Chen, L., Li, Y. X., Li, C., Shi, Y., Zhang, D., Li, Y., & Wang, T. (2022). Fine mapping qKRN5.04 provides a functional gene negatively regulating maize kernel row number. Theoretical and Applied Genetics, 135(6), 1997–2007. https://doi.org/10.1007/s00122-022-04089-w
Chen, R., Xu, Q., Liu, Y., Zhang, J., Ren, D., Wang, G. and Liu, Y. (2018). Generation of Transgene-Free Maize Male Sterile Lines Using the CRISPR/Cas9 System. Front. Plant Sci. 9, 1180. https://doi.org/10.3389/fpls.2018.01180
Gao, H., Gadlage, M. J., Lafitte, H. R., Lenderts, B., Yang, M., Schroder, M., Farrell, J., Snopek, K., Peterson, D., Feigenbutz, L., Jones, S., St Clair, G., Rahe, M., Sanyour-Doyel, N., Peng, C., Wang, L., Young, J. K., Beatty, M., Dahlke, B., … Meeley, R. B. (2020). Superior field performance of waxy corn engineered using CRISPR–Cas9. Nature Biotechnology, 38(5), 579–581. https://doi.org/10.1038/s41587-020-0444-0
Horvath, P. & Barrangou, R. (2010). CRISPR/Cas, the Immune System of Bacteria and Archaea. Science 327, 167–170 https://doi.org/10.1126/science.1179555
Jacquier, N. M. A., Gilles, L. M., Pyott, D. E., Martinant, J.-P., Rogowsky, P. M. and Widiez, T. (2020). Puzzling out plant reproduction by haploid induction for innovations in plant breeding. Nature Plants 6, 610–619. https://doi.org/10.1038/s41477-020-0664-9
Jacquier, N. M. A., Gilles, L. M., Martinant, J.-P., Rogowsky, P. M. and Widiez, T. (2021). Maize In Planta Haploid Inducer Lines: A Cornerstone for Doubled Haploid Technology. Methods Mol. Biol. (Clifton, NJ) 2288, 25–48. https://doi.org/10.1007/978-1-0716-1335-1_2
Jiang, Y., Sun, K., & An, X. (2022). CRISPR/Cas System: Applications and Prospects for Maize Improvement. In ACS Agricultural Science and Technology Vol. 2, Issue 2, pp. 174–183. American Chemical Society. https://doi.org/10.1021/acsagscitech.1c00253
Khaipho-Burch, M., Cooper, M., Crossa, J., de Leon, N., Holland, J., Lewis, R., McCouch, S., Murray, S.C., Rabbi, I., Ronald, P., Ross-Ibarra, J., Weigel D., and Buckler, E.S. (2023) Scale up trials to validate modified crops’ benefits. Nature 621, 470-473. https://doi.org/10.1038/d41586-023-02895-w
Li, J., Zhang, H., Si, X., Tian, Y., Chen, K., Liu, J., Chen, H. and Gao, C. (2017). Generation of thermosensitive male-sterile maize by targeted knockout of the ZmTMS5 gene. J. Genet. Genom. 44, 465–468. https://doi.org/10.1016/j.jgg.2017.02.002
Liu, L., Gallagher, J., Arevalo, E. D., Chen, R., Skopelitis, T., Wu, Q., Bartlett, M., & Jackson, D. (2021). Enhancing grain-yield-related traits by CRISPR–Cas9 promoter editing of maize CLE genes. Nature Plants, 7(3), 287–294. https://doi.org/10.1038/s41477-021-00858-5
Liu, C., Kong, M., Yang, F., Zhu, J., Qi, X., Weng, J., Di, D., & Xie, C. (2022a). Targeted generation of Null Mutants in ZmGDIα confers resistance against maize rough dwarf disease without agronomic penalty. Plant Biotechnology Journal, 20(5), 803–805. https://doi.org/10.1111/pbi.13793
Liu, X., Zhang, S., Jiang, Y., Yan, T., Fang, C., Hou, Q., Wu, S., Xie, K., An, X., & Wan, X. (2022b). Use of CRISPR/Cas9-Based Gene Editing to Simultaneously Mutate Multiple Homologous Genes Required for Pollen Development and Male Fertility in Maize. Cells, 11(3). https://doi.org/10.3390/cells11030439
Ma, X., Zhang, X., Liu, H. and Li, Z. (2020). Highly efficient DNA-free plant genome editing using virally delivered CRISPR–Cas9. Nat. Plants 6, 773–779. https://doi.org/10.1038/s41477-020-0704-5
Ma, L., Sun, Y., Ruan, X., Huang, P. C., Wang, S., Li, S., Zhou, Y., Wang, F., Cao, Y., Wang, Q., Wang, Z., Kolomiets, M. v., & Gao, X. (2021). Genome-wide characterization of jasmonate signaling components reveals the essential role of ZmCOI1a-ZmJAZ15 action module in regulating maize immunity to gibberella stalk rot. International Journal of Molecular Sciences, 22(2), 1–23. https://doi.org/10.3390/ijms22020870
Ning, Q., Jian, Y., Du, Y., Li, Y., Shen, X., Jia, H., Zhao, R., Zhan, J., Yang, F., Jackson, D., Liu, L., & Zhang, Z. (2021). An ethylene biosynthesis enzyme controls quantitative variation in maize ear length and kernel yield. Nature Communications, 12(1). https://doi.org/10.1038/s41467-021-26123-z
Pathi, K. M., Rink, P., Budhagatapalli, N., Betz, R., Saado, I., Hiekel, S., Becker, M., Djamei, A., & Kumlehn, J. (2020). Engineering Smut Resistance in Maize by Site-Directed Mutagenesis of LIPOXYGENASE 3. Frontiers in Plant Science, 11. https://doi.org/10.3389/fpls.2020.543895
Rodríguez-Leal, D., Lemmon, Z. H., Man, J., Bartlett, M. E. & Lippman, Z. B. Engineering Quantitative Trait Variation for Crop Improvement by Genome Editing. Cell 171. 470-480.e8 (2017). https://doi.org/10.1016/j.cell.2017.08.030
Shi, J., Gao, H., Wang, H., Lafitte, H. R., Archibald, R. L., Yang, M., Hakimi, S. M., Mo, H., & Habben, J. E. (2017). ARGOS8 variants generated by CRISPR-Cas9 improve maize grain yield under field drought stress conditions. Plant Biotechnology Journal, 15(2), 207–216. https://doi.org/10.1111/pbi.12603
Tian, J., Wang, C., Xia, J., Wu, L., Xu, G., Wu, W., Li, D., Qin, W., Han, X., Chen, Q., Jin, W., & Tian, F. (2019). Teosinte ligule allele narrows plant architecture and enhances high-density maize yields. Science 365, 658–664. https://www.science.org/doi/10.1126/science.aax5482
Wang, Y., Liu, X., Zheng, X., Wang, W., Yin, X., Liu, H., Ma, C., Niu, X., Zhu, J. K., & Wang, F. (2021a). Creation of aromatic maize by CRISPR/Cas. Journal of Integrative Plant Biology, 63(9), 1664–1670. https://doi.org/10.1111/jipb.13105
Wang, Y., Tang, Q., Pu, L., Zhang, H. and Li, X. (2022). CRISPR-Cas technology opens a new era for the creation of novel maize germplasms. Front. Plant Sci. 13, 1049803. https://doi.org/10.3389/fpls.2022.1049803
Weiss, T., Kamalu, M., Shi, H., Li, Z., Amerasekera, J., Zhong, Z., Adler, B. A., Song, M. M., Vohra, K., Wirnowski, G., et al. (2025). Viral delivery of an RNA-guided genome editor for transgene-free germline editing in Arabidopsis. Nat. Plants 11, 967–976. https://doi.org/10.1038/s41477-025-01989-9
Xu, R., Li, Y., Sui, Z., Lan, T., Song, W., Zhang, M., Zhang, Y., & Xing, J. (2021). A C-terminal encoded peptide, ZmCEP1, is essential for kernel development in maize. Journal of Experimental Botany, 72(15), 5390–5406. https://doi.org/10.1093/jxb/erab224
Zhang, Z., Zhang, X., Lin, Z., Wang, J., Liu, H., Zhou, L., Zhong, S., Li, Y., Zhu, C., Lai, J., Li, X., Yu, J., & Lin, Z. (2020a). A Large Transposon Insertion in the stiff1 Promoter Increases Stalk Strength in Maize. Plant Cell, 32(1), 152–165. https://doi.org/10.1105/tpc.19.00486
Zhang, J., Zhang, X., Chen, R., Yang, L., Fan, K., Liu, Y., Wang, G., Ren, Z., & Liu, Y. (2020b). Generation of Transgene-Free Semidwarf Maize Plants by Gene Editing of Gibberellin-Oxidase20-3 Using CRISPR/Cas9. Frontiers in Plant Science, 11. https://doi.org/10.3389/fpls.2020.01048
*Foto de portada: stockking