El espermatozoide es la célula masculina que interviene en la generación de un nuevo organismo. Se compone de una cabeza, que contiene el material genético y enzimas hidrolíticas que se liberan cuando la célula penetra en el ovocito; una zona intermedia compuesta por mitocondrias, que producen la energía que la célula necesita, y un flagelo que le permite desplazarse.
Para lograr la fertilización, el espermatozoide experimenta cambios en la motilidad acompañados de reacciones químicas, lo que se conoce como capacitación. Con el objetivo de analizar y optimizar este proceso, diversos grupos de investigación han realizado experimentos con espermatozoides de varias especies animales (peces, cebras, conejos, búfalos, jabalíes, y ratones), exponiéndolos a luz roja, azul, verde y una combinación de todas (luz blanca). El resultado ha sido el incremento tanto en la concentración de calcio intracelular, como en la producción de especies reactivas de oxígeno (ROS), lo que a su vez se asocia con un aumento en la capacidad de fertilización de la célula. De hecho, esto último ha sido la motivación para tratar el problema de astenozoospermia (disminución del porcentaje de espermatozoides mótiles) y para mejorar el proceso de inseminación artificial.
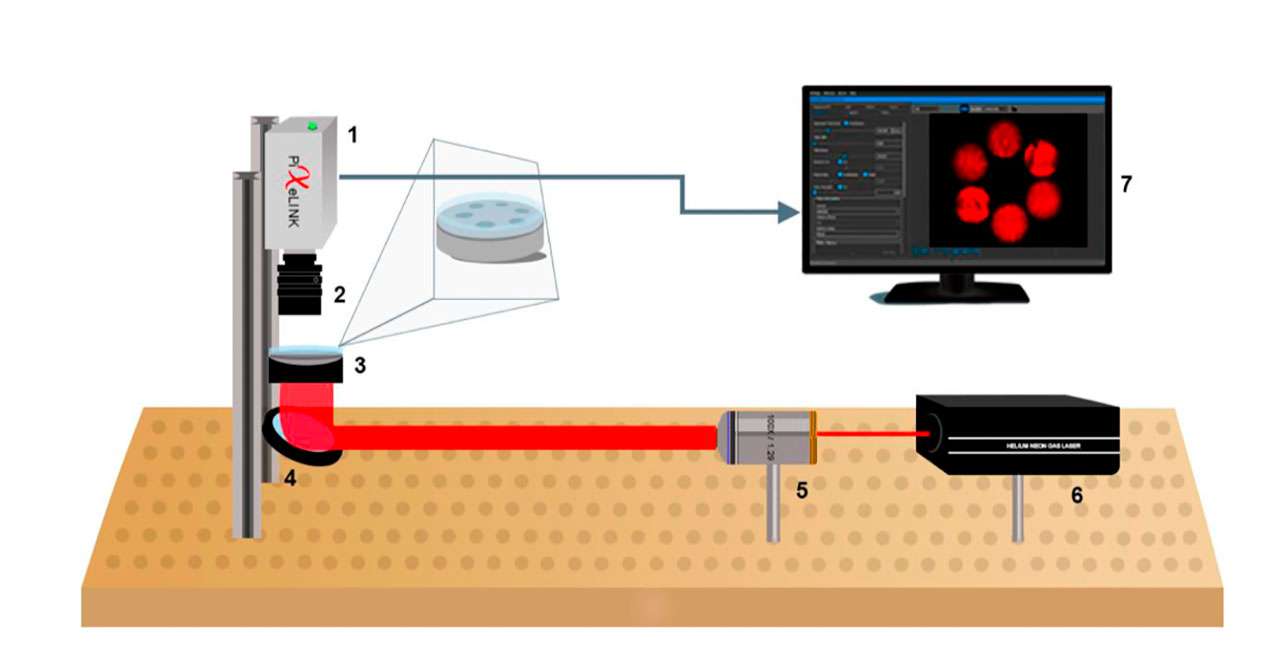
En años recientes, en el CINVESTAV-Monterrey hemos estudiado la motilidad de espermatozoides de ratón en condiciones térmicas variadas, exponiéndolos a luz visible proveniente tanto de láseres como de diodos emisores de luz (LEDs). Los espermatozoides se extraen usando protocolos aprobados por la autoridad institucional encargada. Una vez que a las células se le suministra un medio especial de características similares a las fisiológicas, la suspensión se reparte en seis pozos de un porta muestras de acrílico con geometría concéntrica. Después, usando un arreglo óptico diseñado en el laboratorio, las muestras se exponen a luz visible de diferente longitud de onda, midiendo su motilidad inmediatamente después de la irradiación. El procedimiento consiste en tomar 180 imágenes simultáneas de las seis muestras, cada 30 segundos, durante diferentes periodos de tiempo, que varían dependiendo de la temperatura del experimento. Las imágenes adquiridas se analizan mediante una función de autocorrelación temporal y son graficadas para su interpretación.
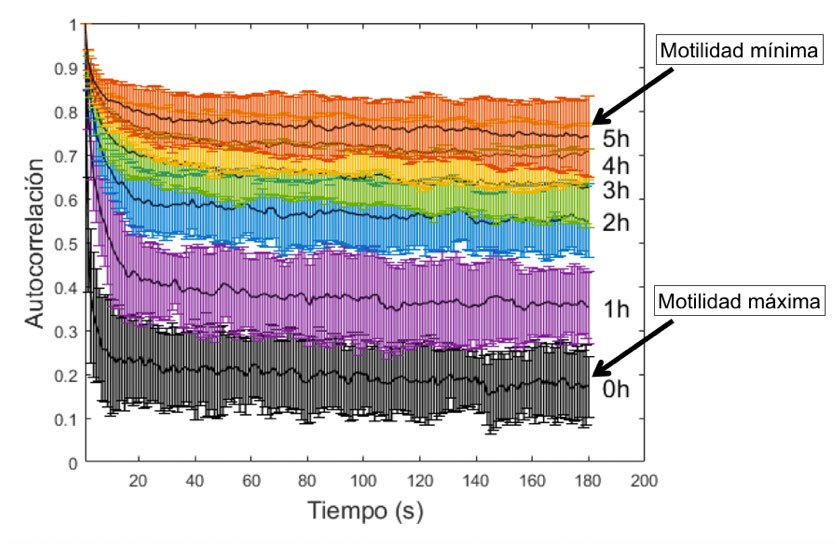
Cuando los espermatozoides se encuentran a una temperatura de 37oC sin ser expuestos a radiación (caso control), la motilidad baja cinco órdenes de magnitud después de dos horas de medición. Si la temperatura del experimento se disminuye a 10oC, la motilidad se extiende hasta 25 horas, presumiblemente porque el metabolismo de las células se hace más lento. Luego, se aplica luz verde a la muestra espermática. Lo que se observa es que las células que se encuentran a 37oC incrementan de tres a cuatro veces más el tiempo que permanecen mótiles, respecto del control. Estos resultados nos inducen a pensar que, a una temperatura tan baja como 10oC, la luz verde provocará un aumento en la motilidad celular, lo que pudiera aprovecharse para la preservación de espermatozoides, en donde se busca evitar el daño ocasionado por el proceso de congelamiento y descongelamiento de las células. Sin embargo, inesperadamente, lo que se encuentra es que la motilidad disminuye tres a cuatro veces con respecto al control. Para entender el mecanismo de interacción de la luz visible con los espermatozoides, es necesario conocer el efecto que ésta produce en los fotosensibilizadores (FS) endógenos. Éstos son moléculas que se encuentran en las células y se estimulan con la luz visible, generando diferentes tipos de ROS y modificando el flujo de calcio intracelular. Las principales moléculas endógenas son las porfirinas, el citocromo c oxidasa, las flavinas y los nucleótidos adenina y nicotidamina (NADH y NADPH) [1].
Dentro de la mitocondria se encuentran algunos de estos FS endógenos, como el citocromo c oxidasa, que al absorber radiación de longitud de onda en el rango de 370-440 nm, aumenta la síntesis de ATP, molécula que produce la energía para que la célula funcione. El resultado es que el espermatozoide permanece mótil por más tiempo.
En la membrana plasmática se ubican otros FS endógenos, las flavinas, que producen el anión superóxido, un tipo de ROS muy débil, pero capaz de provocar una cascada de reacciones de oxidación, que eventualmente dañan algunas estructuras celulares. Las ROS son moléculas tan activas que su vida media es muy corta (del orden de nanosegundos), y por ende, su radio de acción es limitado. Sin embargo, si se producen en gran cantidad, el daño biológico puede ser considerable. Cabe señalar que el espermatozoide, al igual que otras células, genera ROS como parte de su metabolismo normal, aunque existe un sistema de limpieza que depura o atrapa las ROS del medio, y mantiene una condición de equilibrio celular. Este sistema está constituido por moléculas conocidas como scavengers. Son los antioxidantes de las células. Cuando hay un desequilibrio en la dinámica de la producción de ROS y su eliminación por la acción de los antioxidantes, la célula entra en una situación de estrés oxidativo.
De acuerdo con esto, la medición de ROS en nuestros experimentos con espermatozoides es una tarea esencial. Lo primero que se observó al realizarla fue que cuando no se aplica radiación al sistema, no hay cambios en la producción de estas moléculas en ninguna de las dos temperaturas consideradas. Sin embargo, al aplicar luz verde a las células, la producción de ROS aumenta, lo cual coincide con la prolongación en la prevalencia de la motilidad espermática. Además, el aumento de las ROS depende del tiempo de irradiación y es mayor a 10oC, lo que indica que a 37oC las ROS generadas son usadas por el espermatozoide para moverse por más tiempo. En contraste, a 10oC la luz rompe el balance en la producción y el uso de las ROS; es decir, la célula sufre una situación de estrés oxidativo, y la motilidad disminuye.
La siguiente pregunta que nos hicimos fue: ¿qué ocurre si se agrega un FS externo a la célula? ¿El efecto se potencia? El fotosensibilizador elegido fue la curcumina, cuyo pico de máxima absorción se encuentra aproximadamente en 450 nm (luz azul). La curcumina es una molécula que se extrae de la raíz de la planta de cúrcuma (Curcuma longa), una especie muy utilizada en la cocina hindú. La curcumina posee propiedades antioxidantes y antiinflamatorias, y se utiliza con terapia fotodinámica en la prevención y tratamiento de diversos tipos de cáncer.
Para emplear la curcumina en nuestros experimentos de fotoinactivación, las muestras espermáticas fueron incubadas a 37oC y luego expuestas a luz azul por 3 minutos. Enseguida se midió su motilidad durante 180 s, y se irradió nuevamente por otros 3 minutos. El proceso se repitió durante 5 horas. El efecto fue comparado con tres tipos de muestras controles: una que contenía solamente espermatozoides, otra, incubada con curcumina sin irradiar, y una tercera irradiada, pero sin curcumina. El resultado fue que los espermatozoides con curcumina y luz mostraban un descenso en la motilidad desde la primera hora de irradiación, y prácticamente dejaban de moverse después de 5 horas, un efecto muy parecido al tercer control. Mientras que, en los otros dos casos, los resultados fueron similares, sin efecto apreciable. Estos hallazgos mostraron que no es necesario usar luz azul junto con curcumina para lograr la fotoinactivación de los espermatozoides. La luz azul reduce la motilidad espermática por si sola, presumiblemente porque el FS endógeno, citocromo c oxidasa, es fotosensible a la luz de 450 nm, en tanto que el FS externo no tiene ningún efecto [2].
El uso de la radiación ultravioleta y visible como estrategia alterna para inactivar microorganismos patógenos y tratar diversos tipos de cáncer, ha ido en aumento en las últimas décadas. Es interesante observar que la motilidad de algunas células, como los espermatozoides, puede modificarse y estudiarse también con esta estrategia considerando los fotosensibilizadores endógenos presentes en ellas.
Referencias:
[1] M. Ríos-Ramírez, J. Horacio Espinoza, J.C. Ruiz-Suárez and H. Mercado-Uribe, The effect of green light on the motility of mouse sperm at two different temperatures, Photochemical & Photobiological Sciences, 2019, DOI: 10.1039/c9pp00258h [2] Tesis de Licenciatura en Ingeniería Biomédica por presentar, Diana Estéfany Santos Aguirre, CUCEI, Universidad de Guadalajara.
Imagen tomada de UNOCERO
23 de septiembre 2017