Mitocondrias
Las mitocondrias son organelos celulares microscópicos que funcionan como fábricas altamente organizadas y eficientes. Es decir, actúan como unidades de producción que mediante reacciones químicas, transforman diversos sustratos o materias primas provenientes de los alimentos (glucosa, ácidos grasos y aminoácidos), en energía y múltiples productos que satisfacen los requerimientos de las células. Cuando las mitocondrias dejan de funcionar adecuadamente, se produce el caos, y con frecuencia, esta disfuncionalidad puede ser origen del daño en los tejidos y del desarrollo de enfermedades.
Estructura
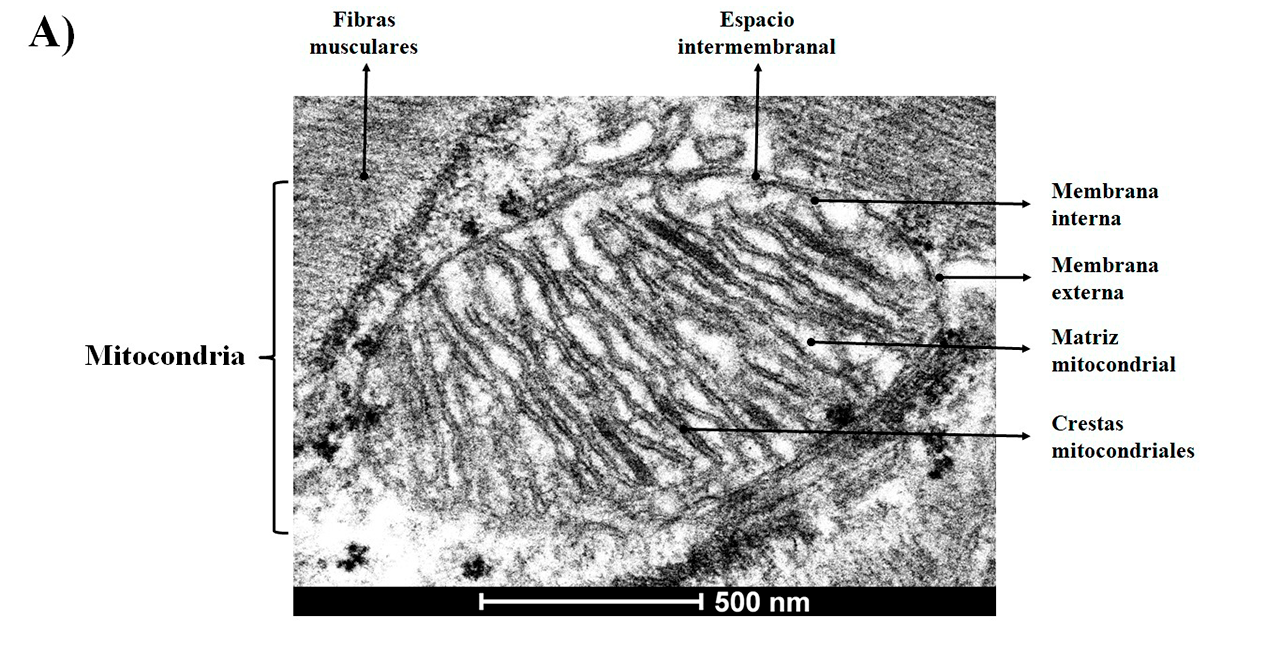
Estas “micro-fábricas” se organizan en cuatro compartimentos (Figura 1A): 1) Membrana externa. Bicapa de fosfolípidos que funciona como los muros que rodean la planta industrial. Tiene diversas puertas de acceso o conductos que atraviesan la membrana mitocondrial externa, las cuales son proteínas llamadas porinas, y que permiten el intercambio de iones, metabolitos, proteínas e información entre la mitocondria y el resto de la célula. 2) Espacio intermembranal. Funciona como una sala de espera, en donde las moléculas son seleccionadas o censadas a través de la formación de gradientes electroquímicos para su ingreso o expulsión al siguiente sector. 3) Membrana interna. Segunda bicapa lipídica que representaría las paredes de la planta industrial. Tiene múltiples pliegues y ondulaciones denominadas crestas. Además, cuenta con puestos de vigilancia que selectivamente permiten el acceso y salida de sustratos, por ejemplo, canales iónicos que regulan el paso de moléculas con cargas negativas (aniones) o positivas (cationes), o proteínas transportadoras que movilizan metabolitos, como los ácidos grasos. Este sector es de suma importancia porque aquí se encuentran inmersas y distribuidas numerosas centrales productoras de energía química. Cada central se compone de cuatro complejos de proteínas que forman la cadena respiratoria, acoplados a la enzima ATP sintetasa para producir trifosfato de adenosina (ATP), la moneda energética indispensable para satisfacer los requerimientos metabólicos de las células. 4) Matriz mitocondrial. En este sector se resguarda el archivo general de la mitocondria, codificado en moléculas circulares de ácido desoxirribonucleico (ADN), el cual contiene información importante para construir los complejos de la cadena respiratoria y posiblemente algún secreto industrial que aún no ha sido revelado. También aquí se encuentra gran parte de la maquinaria especializada o enzimas, responsables de la transformación de los sustratos en diversos productos. Además, este sector puede funcionar como un gran almacén de iones de calcio (Ca2+), y participar en la regulación de procesos fisiológicos tan importantes como la contracción y relajación muscular (Ilovine y cols., 2021) (Figura 1B).
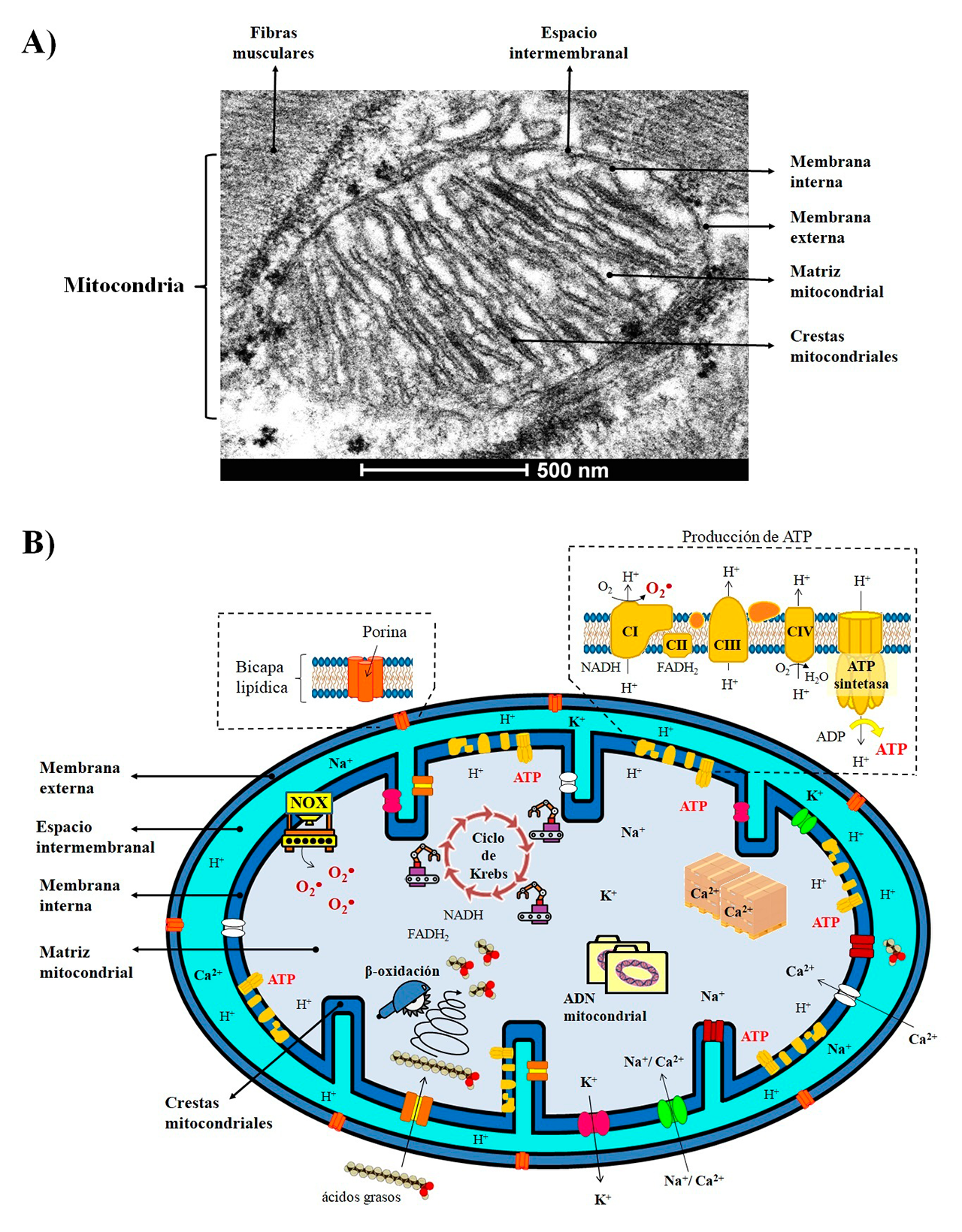
Producción
La principal función de las mitocondrias es la producción de energía mediante la respiración celular. En este proceso, los sustratos derivados de la glucosa son metabolizados en el ciclo de Krebs, generando grandes cantidades de electrones y protones (H+) que son transportados hacia la cadena respiratoria, a través de los acarreadores dinucleótido de nicotinamida y adenina (NADH) o el dinucleótido de flavina y adenina (FADH2). Los complejos de la cadena respiratoria toman los electrones y los transfirieren al oxígeno molecular (O2), creando un gradiente de protones en el espacio intermembranal que es utilizado por la ATP sintetasa para la producción del ATP. Otro ruta metabólica importante es la beta-oxidación de los ácidos grasos, en la cual, la maquinaria enzimática se encarga de romper cadenas largas de ácidos grasos en cadenas más pequeñas para que puedan utilizarse como materia prima (Figura 1B). También, estos organelos son cruciales en la producción de compuestos que contienen átomos de nitrógeno en su estructura, como los aminoácidos, la urea o los grupos hemo, que forman parte de la hemoglobina en la sangre. Por otro lado, la mitocondria es la principal fuente de especies reactivas de oxígeno, que son moléculas inestables que contienen oxígeno y reaccionan fácilmente con otras moléculas. Éstas incluyen al anión superóxido (O2•–), el radical hidroxilo (OH•) o el peróxido de hidrógeno (H2O2). En la mitocondria son principalmente producidas por la fuga de electrones de los complejos de la cadena respiratoria, o pueden ser generadas por otras enzimas, como las NADPH oxidasas (NOX) (Figura 1B).
Control de calidad
En ocasiones, las fábricas no cumplen con los estándares de calidad que el mercado exige, lo que puede originar fallas en el diseño de los productos y la disminución de la productividad. De manera similar, cuando las mitocondrias son defectuosas, las células no tienen suficiente energía, los productos metabólicos presentan alteraciones o son insuficientes, mientras que la generación de productos nocivos se incrementa, acumulándose en las células y causando daños considerables. En respuesta, las células han desarrollado sistemas de control de calidad mitocondrial finamente regulados, cuyo propósito es mantener una población de mitocondrias altamente eficiente, preservar la estructura y función de estos organelos, eliminar errores o defectos en los procesos de producción y asegurar la supervivencia de las células. Los sistemas de control de calidad mitocondrial incluyen: la biogénesis, fusión y fisión mitocondriales, mitofagia, mitocitosis y apoptosis.
- Biogénesis mitocondrial: el surgimiento de un poderoso organelo
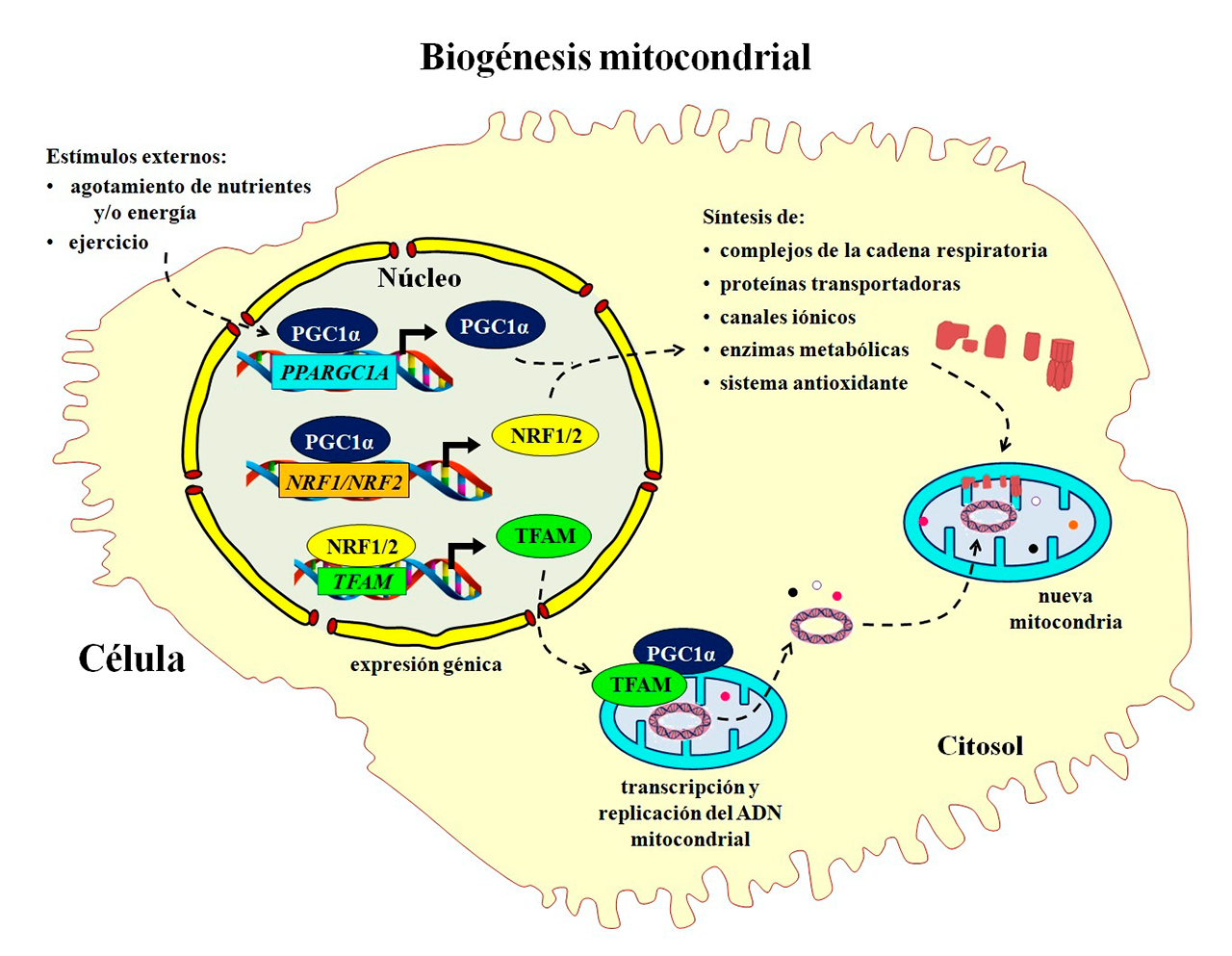
Cuando la capacidad de producción de una fábrica se rebasa y no puede satisfacer la demanda, se requiere ampliar su capacidad o se hace necesario construir nuevas fábricas para atender las exigencias. En las células, la expansión y recambio del número de mitocondrias se llama biogénesis mitocondrial (Figura 2). Este proceso requiere la expresión coordinada de genes tanto del genoma nuclear como del mitocondrial, junto con la síntesis de los componentes lipídicos de las membranas y el ADN mitocondrial. El principal orquestador de la biogénesis es el coactivador-1 alfa del receptor gamma activado por el proliferador de peroxisomas (PGC-1α), el cual se une y activa a diferentes factores de transcripción, entre los que destacan los factores nucleares respiratorios 1 y 2 (NRF1 y NRF2) que estimulan la expresión de enzimas mitocondriales involucradas en la cadena respiratoria, la β-oxidación de los ácidos grasos, o el sistema antioxidante. También, NRF1 y NRF2 activan al factor de transcripción mitocondrial A (TFAM), la proteína responsable de copiar, transcribir, reparar y empaquetar el ADN mitocondrial (Popov, 2020).
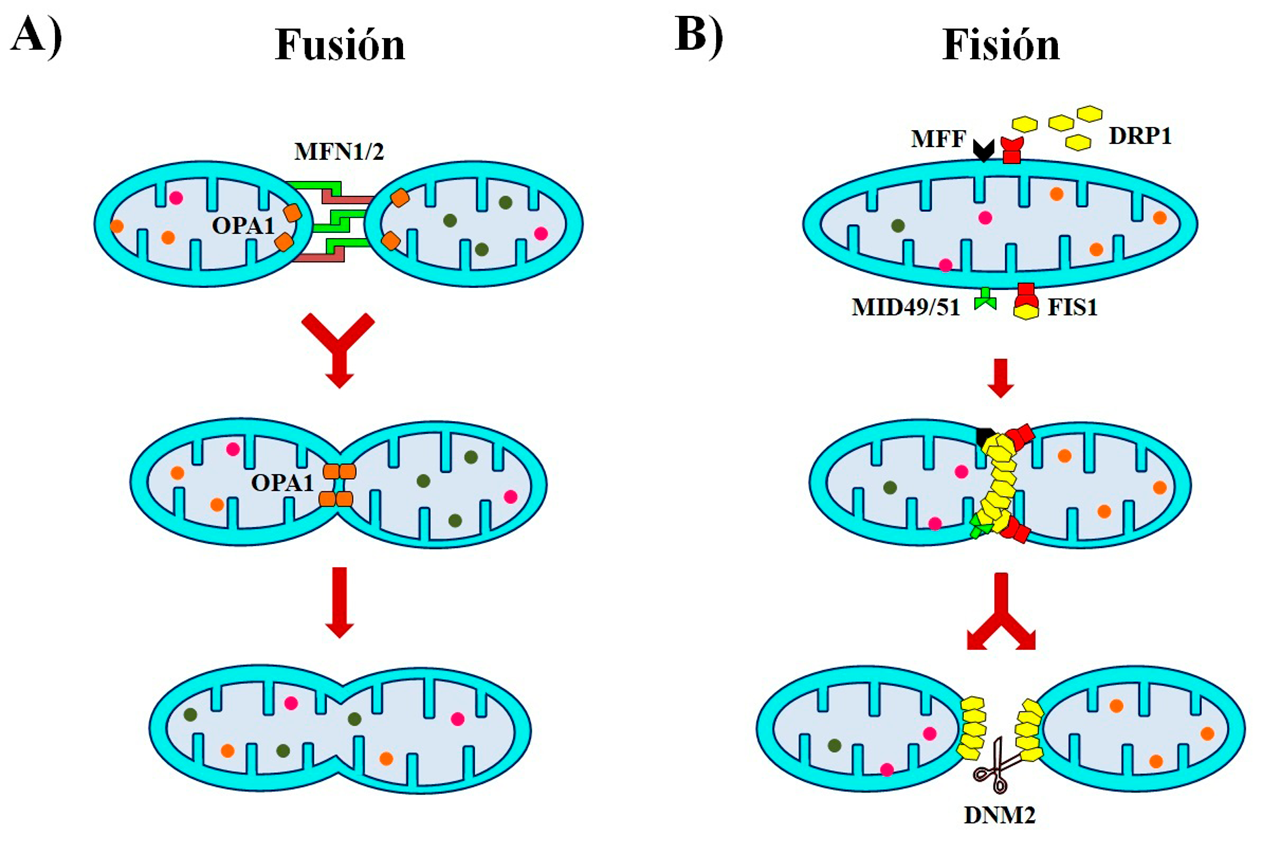
- Fusión: la unión, es poder
Las fusiones son operaciones en las que una o más industrias se unen o combinan sus recursos y procedimientos, dando lugar a otra de mayor tamaño o capacidad y ganando competitividad. En este sentido, las mitocondrias como entidades productivas utilizan esta misma táctica, uniendo sus membranas externas e internas, así como la matriz mitocondrial para producir una mitocondria más grande o formar redes (Figura 3A). Esto les permite el intercambio de componentes mitocondriales, aumentar su eficiencia, facilitar la comunicación, además de amortiguar defectos transitorios en la función o el abastecimiento de nutrientes. La fusión mitocondrial está regulada por las proteínas mitofusinas 1 y 2 (MFN1 y MFN2) que interactúan para coordinar la fusión de las membranas externas entre mitocondrias vecinas. Mientras que la proteína de atrofia óptica 1 (OPA1) se encarga de la fusión de las membranas internas (Gao y Hu, 2021).
- Fisión: divide y vencerás, segmentación al rescate
En esta estrategia, una industria se divide en otras más pequeñas y manejables para mejorar su gestión, prescindir de un área que ya no es rentable, o por el contrario, maximizar la eficiencia de sectores que crecen más que la matriz. En el caso de las mitocondrias, el proceso de fisión crea mitocondrias pequeñas desconectadas de la red mitocondrial, que son necesarias para la división celular o la eliminación de segmentos de mitocondrias que presentan daños estructurales o funcionales (Figura 3B). La proteína 1 relacionada con la dinamina (DRP1) es reclutada del citosol a los sitios de fisión en la superficie de la membrana mitocondrial externa, donde se une al factor de fisión mitocondrial (MFF), a la proteína de fisión 1 (FIS1), o a las proteínas de la dinámica mitocondrial MID49 y MID51, para formar una estructura en espiral que da lugar a un anillo de unidades repetidas de DRP1. Este anillo poco a poco se va cerrando, constriñendo las membranas externa e interna. Por último, la proteína dinamina 2 (DNM2) se ensambla en el cuello de la constricción para terminar la separación de las mitocondrias (Kraus y Ryan, 2017).
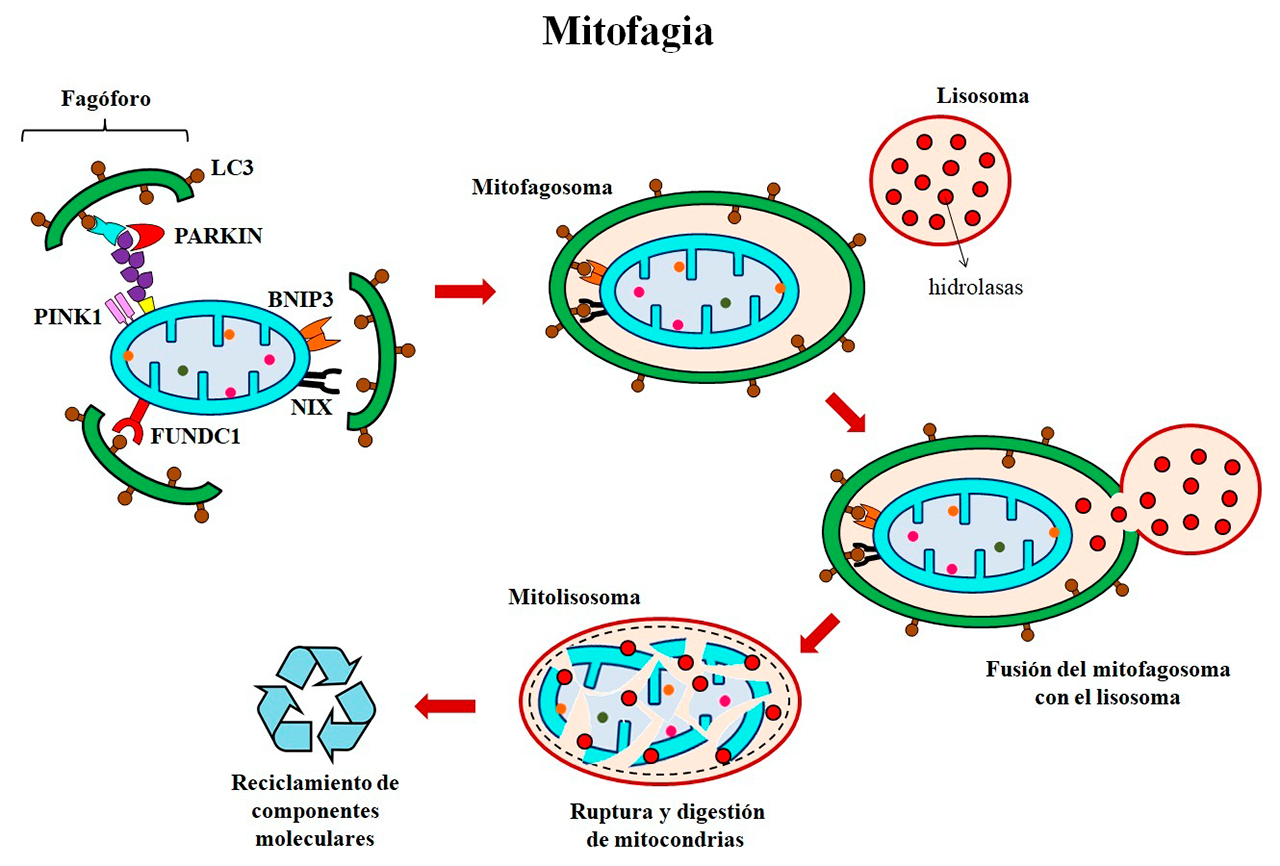
- Mitofagia: desmantelamiento mitocondrial y recuperación de activos
El desmantelamiento de fábricas ocurre cuando dejan de ser productivas. Este proceso consiste en el desmontaje o demolición de las instalaciones de la planta industrial, así como el desarmado de las maquinarias, para aprovechar el valor de sus activos. De manera análoga, la mitofagia es un mecanismo que elimina selectivamente y por degradación lisosomal, aquellas mitocondrias dañadas o disfuncionales; así como las que están en exceso o no son esenciales. Su desmantelamiento, limita la producción de especies reactivas de oxígeno, previene la propagación de daño a mitocondrias vecinas, evita la activación de mecanismos de muerte celular, además de favorecer la recuperación o reciclaje de sustratos metabólicos (Figura 4). La mitofagia comienza con la formación en el retículo endoplásmico de una doble membrana en forma de media luna llamada fagóforo, donde se reclutan las proteínas asociadas a microtúbulos 1A/1B de cadena ligera 3B (LC3), las cuales facilitan la captura y engullimiento de las mitocondrias que serán desmanteladas. De manera simultánea, se reclutan las proteínas cinasa 1 inducida por el homólogo de fosfatasa y tensina (PINK1) y PARKIN en la membrana mitocondrial externa, las cuales se encargan de reclutar, activar o modificar a otras proteínas para que puedan ser reconocidas por LC3 en el fagóforo. Esta interacción promueve el alargamiento de la membrana del fagóforo, que engulle a las mitocondrias y se cierra sobre sí mismo para formar el mitofagosoma. Por otra parte, la interacción de los receptores FUNDC1, BNIP3 y NIX en la membrana mitocondrial externa con LC3, también facilita la captura de las mitocondrias y la formación de los mitofagosomas. Finalmente, el mitofagosoma se fusiona con los lisosomas para formar mitolisosomas, cuyo contenido ácido e hidrolasas promueven la digestión de su contenido para ser reutilizado por la célula (Choubey y cols., 2021).
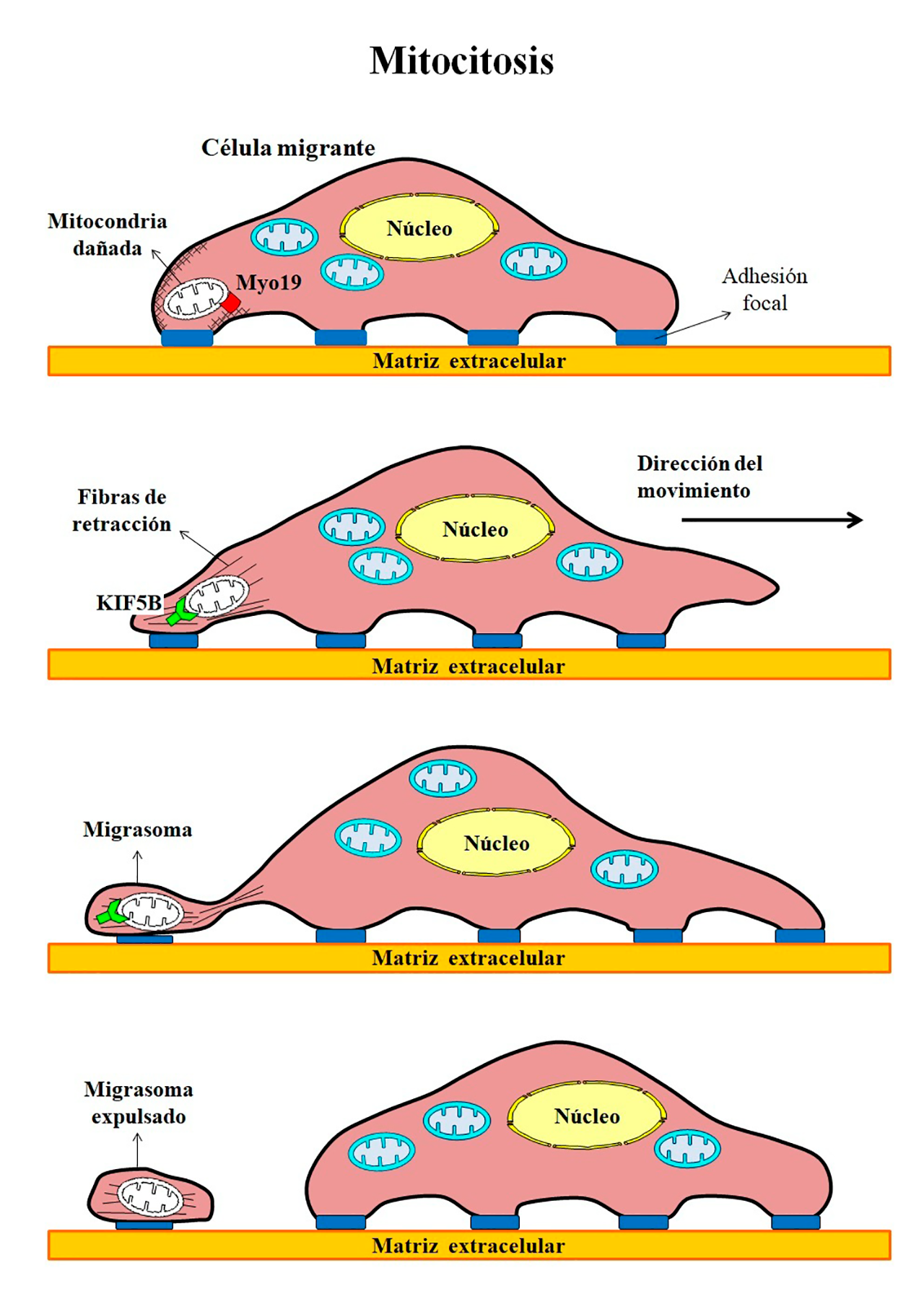
- Mitocitosis: eliminando daños durante la mudanza
El traslado de una fábrica a una nueva ubicación, ya sea por aumento de capacidad en la planta industrial o por reducción de costos, implica el uso de recursos y equipamientos especiales, así como enfrentar problemas técnicos y desperfectos. En el caso de los organismos, las células tienen la capacidad de mudarse o migrar de un lugar a otro debido a diversos estímulos, como son la respuesta inmune, el desarrollo embrionario o la reparación de tejidos. Sin embargo, durante su traslado, las células migrantes pueden estar sujetas a condiciones de estrés y sufrir daño mitocondrial. Cuando la disfunción mitocondrial es severa, se interrumpe la migración celular y se induce la mitofagia para eliminar a las mitocondrias dañadas. En cambio, si la disfunción es moderada, las células migrantes activan un mecanismo denominado mitocitosis, a través del cual arrojan las mitocondrias defectuosas en estructuras vesiculares llamadas migrasomas (Figura 5). Los migrasomas son extensiones de la membrana plasmática enriquecidos en tetraspaninas, que se forman en las fibras de retracción en la parte posterior de las células migratorias. La miosina 19 (Myo19) une las mitocondrias dañadas a la red de actina en la membrana plasmática, mientras que las proteínas de la familia de las kinesinas 5B (KIF5B) jalan a las mitocondrias para entrar al migrasoma. Cuando las células avanzan, las fibras de retracción se rompen y los migrasomas son expulsados del resto de la célula, dejando a las mitocondrias dañadas en el camino (Jiao y cols., 2021).
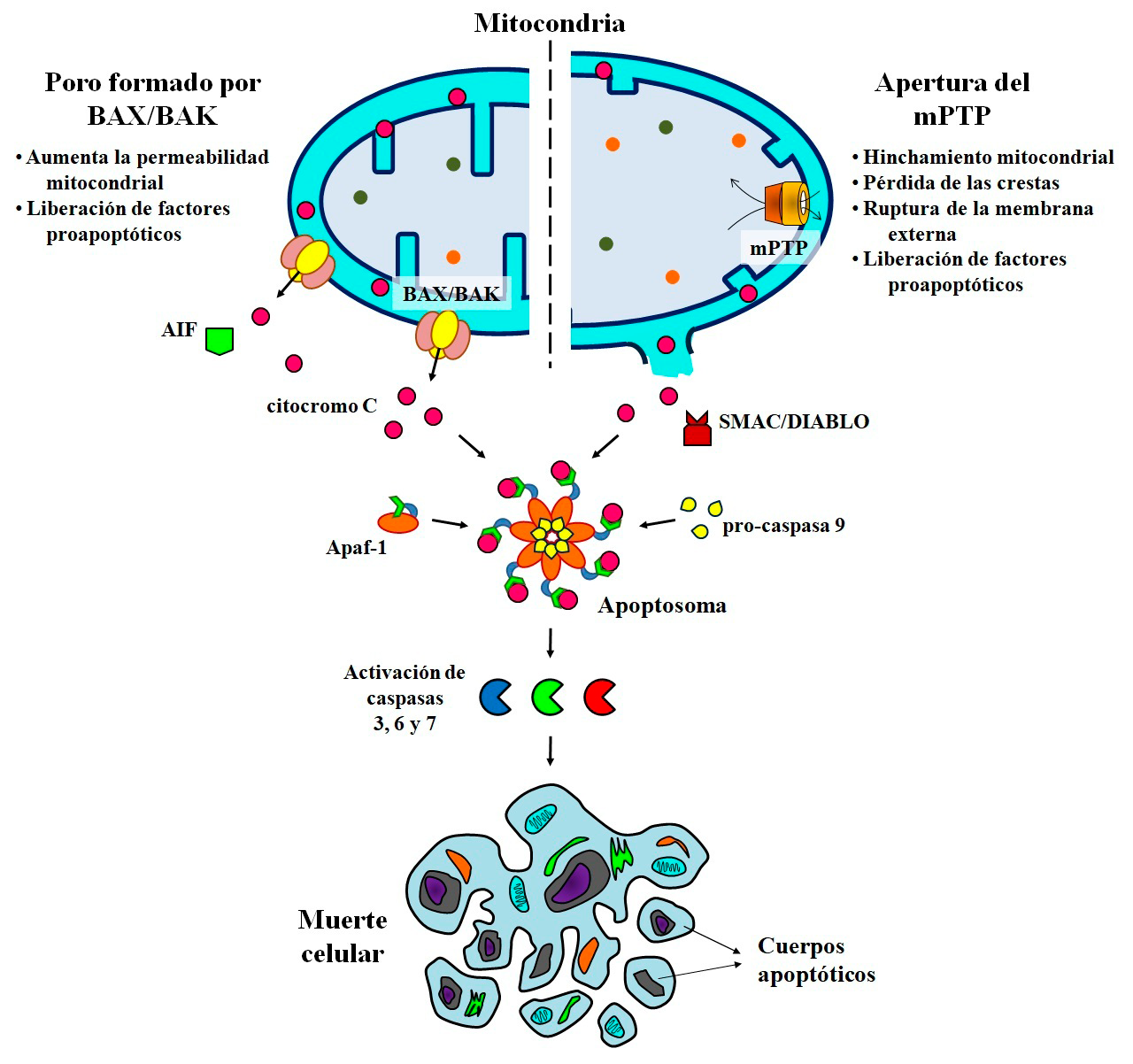
- Apoptosis: muerte celular dirigida por mitocondrias
El cierre de fábricas provoca perturbaciones en las cadenas de suministro y distribución de materias primas; así como escasez de productos manufacturados. Más importante, en algunos casos provoca el colapso o desaparición de comunidades o pequeñas ciudades que dependen social y económicamente de estas industrias. Algo similar ocurre en la apoptosis dirigida por mitocondrias, o también llamada intrínseca. En esta vía de muerte celular programada, las mitocondrias son inhabilitadas (permeabilizadas) a través de la formación de poros o agujeros que provocan su ruptura, y la liberación de proteínas que conducirán a la muerte de la célula. El aumento de la permeabilidad se debe a la activación y translocación de la proteína antagonista de linfoma de células B-2 (BCL-2)/Asesino 1 (BAK) y la proteína X asociada a BCL-2 (BAX), las cuales forman poros en la membrana mitocondrial externa. Un segundo mecanismo involucra la apertura del poro de transición de la permeabilidad mitocondrial (mPTP), un canal no específico formado en la membrana interna (Figura 6). En ambos casos, se pierde la estructura de las mitocondrias y se liberan proteínas con funciones proapoptóticas como el citocromo c, el factor inductor de apoptosis (AIF) o SMAC/DIABLO. El citocromo c dispara la formación del apoptosoma, un complejo multimérico formado por el factor activador de proteínas apoptóticas (Apaf-1) y la pro-caspasa 9. Esta caspasa en su forma activa, segmenta y activa a las caspasas efectoras 3, 6 y 7, quienes se encargan de hidrolizar o desmantelar a las proteínas y de fragmentar al ADN; para luego ser envueltos por la membrana celular y dar origen a los cuerpos apoptóticos (Bock y Tait, 2020).
Fallas en los sistemas de control de calidad mitocondrial
Estos sistemas, dinámicos e interconectados, son regulados por numerosas proteínas. Algunas de ellas pueden participar en más de un proceso, o incluso, tener efectos opuestos; por ejemplo, la proteína PARKIN que promueve la mitofagia, también activa la fisión mitocondrial, a la vez que evita la fusión de las mitocondrias. De allí que, cualquier defecto o falla en los sistemas de control, conducirá a la acumulación de mitocondrias dañadas y a daño celular, activando la maquinaria que contribuya al desarrollo de muchas enfermedades, como las cardiovasculares, neurodegenerativas, metabólicas o el cáncer. Por ejemplo; alteraciones en la biogénesis mitocondrial debido a la represión en la expresión de PGC-1α, es uno de los mecanismos subyacentes en modelos experimentales de hipertrofia e insuficiencia cardíaca (Pisano y cols., 2016). En la enfermedad de Alzheimer, existe un desbalance entre la fusión y fisión mitocondrial; es decir, los niveles de las proteínas MFN1/2 y OPA1 están disminuidos; mientras que las proteínas FIS1 y DRP1 están aumentadas, lo que promueve la acumulación de proteínas Tau en las neuronas (Joshi y cols., 2018). Por otra parte, la inhibición de la mitofagia en células epiteliales de pulmón, estimula la apoptosis y la senescencia celular, favoreciendo el avance de la fibrosis pulmonar idiopática (Kurita y cols., 2017). También, en un modelo de nefropatía diabética se identificaron alteraciones en la mitofagia, causadas por la disminución en la expresión de PINK1, PARKIN y NIX (Sherkane y cols., 2022). Otro ejemplo interesante de mencionar, es el de las células cancerosas, las cuales han desarrollado una variedad de mecanismos para escapar o incluso manipular los sistemas de control de calidad mitocondrial. Al respecto, las células cancerosas activan la fisión mitocondrial mediada por DRP1 para incrementar su proliferación o adquirir resistencia a la quimioterapia, inhiben la mitofagia activada por FUNDC1 para promover la carcinogénesis; además, bloquean la apoptosis mediante la regulación positiva de las proteínas antiapoptóticas BCL-2, inactivan a BAX/BAK; e inhiben la función de las caspasas, para escapar de la muerte celular (López y Tait, 2015; Denisenko y cols., 2021).
Fabricando el futuro
A pesar del avance en el estudio de estos sistemas de control, aún queda mucho campo por explorar y mecanismos por entender. No obstante, la evidencia científica ha dejado en claro que la disfunción mitocondrial y las alteraciones en los sistemas de control de calidad mitocondrial juegan un papel crítico en el envejecimiento y el desarrollo de diversos padecimientos. En consecuencia, la comprensión de estos sistemas es crucial para la búsqueda de estrategias terapéuticas novedosas que mantengan el rendimiento de estas “micro-fábricas”, activen o repriman blancos moleculares involucrados en diversas vías relacionadas con el control de calidad mitocondrial, y prevengan la progresión de las enfermedades.
Referencias
Bock, F, y Tait, S. (2020). Mitochondria as multifaceted regulators of cell death. Nature Reviews. Molecular Cell Biology, 21(2), 85-100.
Choubey, V., Zeb, A, y Kaasik, A. (2021). Molecular mechanisms and regulation of mammalian mitophagy. Cells, 11(1), 38.
Denisenko, T., Gogvadze, V, y Zhivotovsky, B. (2021). Mitophagy in carcinogenesis and cancer treatment. Discover Oncology, 12, 58.
Gao, S, y Hu, J. (2021). Mitochondrial fusion: the machineries in and out. Trends in Cell Biology, 31(1), 62-74.
Iovine, J., Claypool, S, y Alder, N. (2021). Mitochondrial compartmentalization: emerging themes in structure and function. Trends in Biochemical Sciences, 46(11), 902-917.
Jiao, H., Jiang, D., Hu, X., et al. (2021). Mitocytosis, a migrasome-mediated mitochondrial quality-control process. Cell, 184(11), 2896-2910.
Joshi, A., Saw, N., Shamloo, M, y Mochly-Rosen, D. (2018). Drp1/Fis1 interaction mediates mitochondrial dysfunction, bioenergetic failure and cognitive decline in Alzheimer’s disease. Oncotarget, 9, 6128-6143.
Kraus, F, y Ryan, M. (2017). The constriction and scission machineries involved in mitochondrial fission. Journal of Cell Science, 130(18), 2953-2960.
Kurita, Y., Araya, J., Minagawa, S., et al. (2017). Pirfenidone inhibits myofibroblast differentiation and lung fibrosis development during insufficient mitophagy. Respiratory Research, 18(1), 114.
López, J, y Tait, S. (2015). Mitochondrial apoptosis: killing cancer using the enemy within. British Journal of Cancer, 112(6), 957-962.
Pisano, A., Cerbelli, B., Perli, E., et al. (2016). Impaired mitochondrial biogenesis is a common feature to myocardial hypertrophy and end-stage ischemic heart failure. Cardiovascular Pathology, 25(2), 103-112.
Popov, L. (2020). Mitochondrial biogenesis: an update. Journal of Cellular and Molecular Medicine, 24(9), 4892-4899.













Comentarios no permitidos.