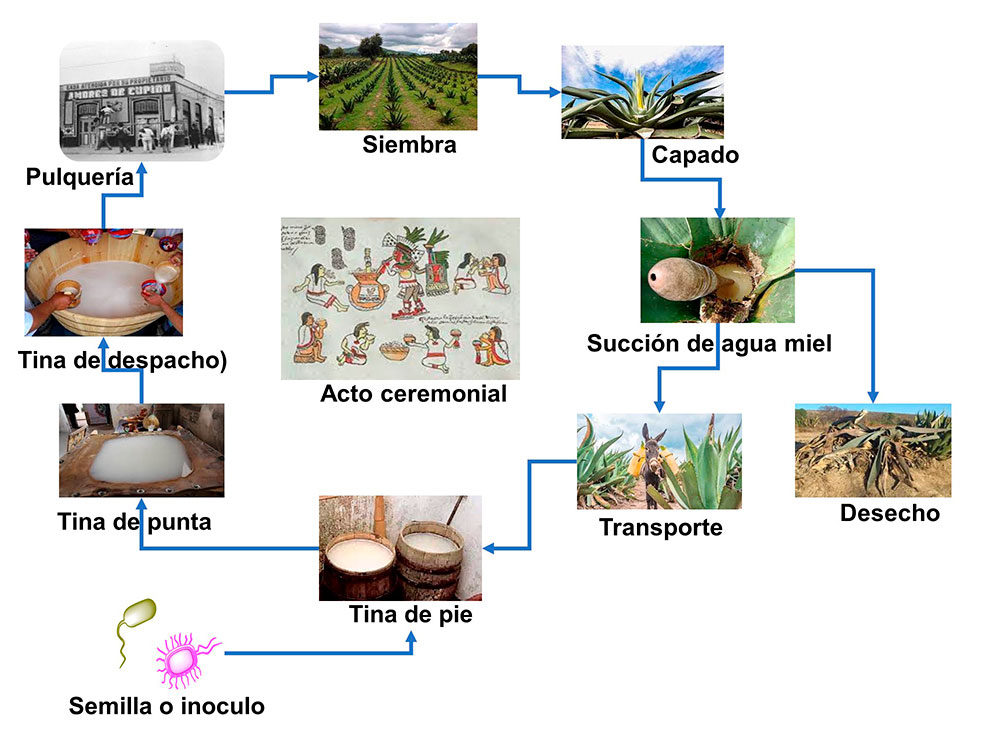
El pulque es una bebida ancestral de mayor popularidad en México que ha subsistido hasta la actualidad. Esta bebida es viscosa, su contenido de etanol oscila de 4 a 7%, su pH de 3.5 a 4.3, y se produce a través de la fermentación del aguamiel extraída de los agaves (A) pulqueros como la A. salmiana, A. americana, A. mapisaga y de A. hookerii, A. marmorata, A. inaequidens (García-Mendoza, 1998). Los mexicas nombraban a esta bebida según sus propiedades físicas o gustativas como: iztacoctli (pulque blanco), necoctli (pulque mínimamente fermentado), teoctli (bebida de los dioses) y metoctli (vino de maguey). Esta última, al adquirir un olor y sabor desagradable en su proceso de descomposición, era nombrada poliuhquioctli, por lo que fue llamada por los españoles pulque (Cabrera, 1992). Esta bebida en la época prehispánica fue difundida desde la Huasteca hasta Yucatán, y fue de gran importancia para los pueblos indígenas en su dieta diaria y ceremonial (Lappe-Oliveras et al., 2008).
A lo largo de la época colonial, la elaboración y comercialización del pulque fueron fundamentales en la economía mexicana. En 1810 el levantamiento armado de independencia provoca el cese del crecimiento económico. Sin embargo, durante el siglo XIX con el inicio del ferrocarril, el pulque retoma su importancia e inicia el crecimiento de las haciendas como industrias pulqueras, tal es el caso de San Juan Tlacatecpan, San Antonio Ometusco, Zuapayuca y Venta de Cruz en el Estado de México; Santa María Tecajete, San Lorenzo, Tetlapayac, Arcos, Espejel y Chavarría en Hidalgo; San Lorenzo Soltepec, San Bartolomé del Monte e Ixtafiayuca en Tlaxcala. El mercado principal de pulque producido por estas haciendas fue el centro de México y la ciudad de Puebla, hasta el siglo XX (Monterrubio, 2007). Actualmente, el pulque es una bebida que se produce para autoconsumo, también se vende en expendios denominados “pulcatas”, se caracteriza por ser afrodisiaco y forma parte de la dieta diaria (Escalante et al., 2012; Ramírez- Rancaño, 2000).
La siembra de maguey pulquero se lleva a cabo durante el cuarto creciente de la luna llena, el cuidado del cultivo es de 8 a 12 años para producir agua miel. Una vez llegado a la edad indicada se procede al capado, 4 días antes o 4 días después de luna llena, esta actividad consiste en eliminar el quiote central del maguey, se realiza una perforación en el centro, induciendo a la secreción del agua miel, posteriormente se cubre con ramas y piedras para evitar la introducción de animales. El raspado del centro del maguey es realizado por la mañana o tarde por el tlachiquero. En náhuatl “Tlachiqui” significa raspador y “ero” es la persona que hace la acción de raspar. Una vez raspada la corteza de la piña, inicia la exudación del aguamiel y su almacenamiento en el orificio, por lo que, se procede a su extracción a través de un acocote; se extrae de 3 a 4 L/día durante 3 a 4 meses y posteriormente inicia su disminución hasta secarse el maguey. El transporte del aguamiel colectado al lugar de proceso es mediante un burro o a pie.
Para iniciar la fermentación del aguamiel y producir el pulque se adiciona pulque fermentado, llamado inoculo o semilla, compuesto por un consorcio de bacterias como Zimomonas mobilis, Leuconostoc, Lactobacillus, Lactococcus, Acinetobacter y S. cerevisiae (Chacón-Vargas et al., 2020). Una vez iniciado el proceso fermentativo, se pasa a una tina de pie (barril de madera), donde se obtiene de 2 a 3 grados de alcohol y luego se traslada a la tina de la punta (bateas de madera) durante 15 días; posteriormente es llevado a la tina de despacho (tinas de madera) donde se obtiene un pulque con 7 a 8 grados de alcohol que está listo para su venta. Sin embargo, si se continúa fermentado la bebida puede alcanzar hasta 14 grados de alcohol y la bacteria inicia una etapa de etanólisis, en la cual comienza su deceso debido a la concentración alta de alcohol. El pulque en la antigüedad se bebía mediante pencas de magueyes cortos llamadas “Xoma”, ahora se utilizan recipientes de barro. Lo recomendable para dar el primer trago de esta bebida es retenerlo debajo de la lengua unos segundos y luego ingerirlo. En la actualidad también existe el pulque curado. Esta bebida es el aprovechamiento del pulque natural cuando el tinajero observa que el pulque no está en condiciones de venderse (fermentado), se procede a combinarlo con diferentes frutas y se endulza con agua miel.
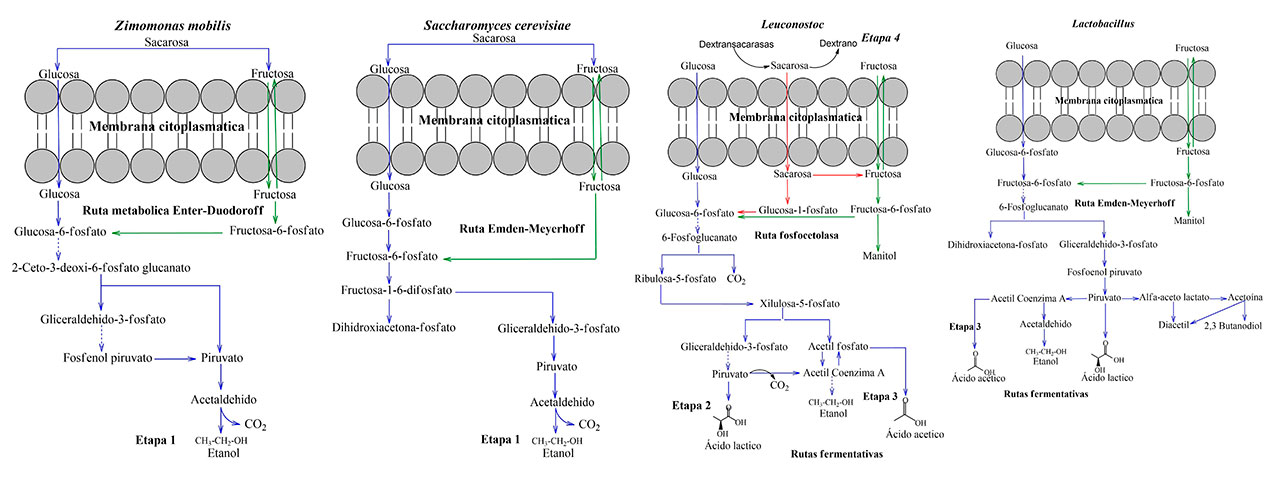
Escalante et al. (2016) reportan que las rutas metabólicas durante el proceso fermentativo del pulque consisten en 4 etapas. En la primera etapa, se lleva a cabo una fermentación alcohólica realizada por Z. mobilis y S. cerevisiae, en la que se degradan azúcares presentes en el aguamiel como sacarosa, fructosa y glucosa. En la segunda etapa, se da inicio a una fermentación láctica mediante Leuconostoc, Lactobacillus y Lactococcus, obteniendo ácido láctico, ácido acético, acetoina, diacetilo y butanodiol. En la tercera etapa, las bacterias acéticas como acetobacter y gluconobacter causan la fermentación del ácido acético. Por último, en la cuarta etapa se activa la producción del dextrano mediante las enzimas dextransacarasas del Leuconostoc mesenteroides. Estos exopolisacaridos brindan la viscosidad característica al pulque. Por tanto, las propiedades sensoriales del pulque varían con base en la etapa fermentativa del proceso. La figura 2 muestra los productos terminales (etanol, ácido láctico, ácido acético, CO2 y dextrano) de las actividades metabólicas en cada etapa de fermentación. Esto se considera como una línea basal para el desarrollo de un inóculo bien definido en la fermentación del pulque.
Aplicaciones
El pulque, debido a su popularidad y tradición en México, se considera parte del acervo cultural de nuestro país y representa una alternativa económica que contribuye al desarrollo sustentable de comunidades rurales. Estudios recientes han demostrado que los microorganismos aislados del aguamiel y pulque generan beneficios probióticos. Leuconostoc mesenteroides NRRL B‐512F puede sintetizar exopolisacáridos llamados dextrano (Etapa 4). Este exopolisacárido es uno de los principales biopolímeros obtenidos a escala industrial aplicados a la biotecnología y medicina. Las enzimas dextransacarasas son las responsables de la síntesis de dextranos. La primera aplicación industrial de los dextranos producidos por Leuconostoc mesenteroides fue reemplazar al suero sanguíneo.
Los dextranos más utilizados son de 40,000 a 100,000 Dalton (Da). Por ejemplo, Leuconostoc mesenteroides NRRL B‐512F produce dextranos de 40,000, 60,000 y 70.000 Da. Además, los dextranos de alto peso molecular (mayor a 100,000 Da) aumentan la posibilidad de causar reacciones alérgicas, por lo que no pueden usarse (Naessens et al., 2005). Así también, el dextrano se ha utilizado como tamiz molecular. La compañía Pharmacia Fine Chemicals (Uppsala, Sweden) en 1959 inicio la purificación y separación de macromoléculas como proteínas, ácidos nucleicos y polisacáridos. En la actualidad, esta farmacéutica se conoce como Sephadex (Separation Pharmacia Dextran). Además, el dextrano de hierro es utilizado para afrontar la falta de hierro en personas anémicas; mientras que el dextrano sulfato se utiliza como antiviral contra el virus de la gripe y el dengue (Marijke et al., 2012; Yamada et al., 2012). Por otro lado, en la industria alimentaria el dextrano se aplica en jarabes de fructosa, helados, cremas y productos de panadería (Naessens et al., 2005). No obstante, los dextranos no son aceptados como aditivos alimentarios en Estados Unidos y Europa.
En la actualidad han incrementado los registros de patentes sobre la producción de dextrano generados por microorganismos y sus recientes aplicaciones como agentes bioactivos, probióticos en alimentos funcionales, panificación y cosméticos. La cepa P45 de Leuconostoc mesenteroides muestra actividad antimicrobiana contra bacterias patógenas como Listeria monocytogenes, Salmonella Typhi, Salmonella Typhimurium y Escherichia coli, tanto en modelos in vitro como in vivo (Giles et al., 2016). Por otra parte, Torres et al., (2016) reportaron que el Lactobacillus sanfranciscensis cepa LBH1068 mejora la pérdida de peso, decrece la permeabilidad intestinal y la modulación de citoquinas en ratones. Así también, los Lactobacillus sp. y Pediococcus sp. muestran actividad antimicrobiana in vitro frente a Helicobacter pylori y Staphylococcus aureus (Cervantes et al., 2019).
En conclusión, los metabolitos secundarios y microorganismos involucrados durante la producción del pulque tienen una potencial aplicación en salud y alimentación. Durante el bioproceso de producción de pulque se desarrollan microrganismos que pueden mejorar la microflora humana al actuar como probióticos. Así también, se ha demostrado que algunos de sus metabolitos podrían ser empleados como potenciales terapéuticos para mejorar la salud. Por tanto, el pulque, más allá de ser considerado una bebida alcohólica ancestral, también puede ofrecer un área de oportunidad para nuevas investigaciones en bioprocesos aplicados a la salud y la alimentación.
Referencias
Cabrera, L. G. (1992). Diccionario de aztequismos (No. 463 C32 1992).
Cervantes-Elizarrarás, A., Cruz-Cansino, N., Ramírez-Moreno, E., Vega-Sánchez, V., Velázquez-Guadarrama, N., Zafra-Rojas, Q., et al. (2019). In vitro probiotic potential of lactic acid bacteria isolated from aguamiel and pulque and antibacterial activity against pathogens. Appl. Sci. 9:601. doi: 10.3390/app9030601
Chacón-Vargas, K., Torres, J., Giles-Gómez, M., Escalante, A., and Gibbons, J. G. (2020). Genomic profiling of bacterial and fungal communities and their predictive functionality during pulque fermentation by whole-genome shotgun sequencing. Sci. Rep. 10:15115. doi: 10.1038/s41598-020-71864-4
Escalante A., Giles-Gómez M., Esquivel Flores G., Matus Acuña V., Moreno-Terrazas R., López-Munguía A., et al. (2012). Pulque fermentation, in Handbook of Plant-Based Fermented Food and Beverage Technology, ed Hui Y. H. (Boca Raton, FL: CRC Press;), 691–706.
Escalante, A., López Soto, D. R., Velázquez Gutiérrez, J. E., Giles-Gómez, M., Bolívar, F., and López-Munguía, A. (2016). Pulque, a traditional Mexican alcoholic fermented beverage: historical, microbiological, and technical aspects. Front. Microbiol. 7:1026. doi: 10.3389/fmicb.2016.01026
García Mendoza, A. (1998). Con sabor a maguey: Guía de la colección nacional de Agaváceas y Nolináceas del Jardín Botánico, Instituto de Biología-UNAM. Universidad Nacional Autónoma de México.
Giles-Gómez, M., Sandoval García, J. G., Matus, V., Campos Quintana, I., Bolívar, F., and Escalante, A. (2016). In vitro and in vivo probiotic assessment of Leuconostoc mesenteroides P45 isolated from pulque, a Mexican traditional alcoholic beverage. Springer Plus 5:708. doi: 10.1186/s40064-016-2370-7
Lappe-Oliveras, P., Moreno-Terrazas, R., Arrizon-Gavino, J., Herrera-Suarez, T., García-Mendoza, A., & Gschaedler-Mathis, A. (2008). Yeasts associated with the production of Mexican alcoholic nondistilled and distilled Agave beverages. FEMS yeast research, 8(7), 1037-1052.
Marijke, M.F.A., Schols, D. (2012). Dengue Virus Entry as Target for Antiviral Therapy. Journal of Tropical Medicine. 2012: 628475.
Monterrubio, A. L. (2007). Las haciendas pulqueras de México (Vol. 35). Universidad Nacional Autónoma de México. UNAM
Naessens, M., Cerdobbel, A., Soetaert, W., Vandamme, E.J. (2005). Leuconostoc dextransucrase and dextran: production, properties and applications. Journal of Chemical Technology & Biotechnology. 80: 845‐860.
Ramírez-Rancaño, M. (2000). Ignacio Torres Adalid y la industria pulquera. Instituto de Investigaciones Sociales- Universidad Nacional Autónoma de México. Plaza & Valdés, México.
Torres-Maravilla, E., Lenoir, M., Mayorga-Reyes, L., Allain, T., Sokol, H., Langella, P., et al. (2016). Identification of novel anti-inflammatory probiotic strains isolated from pulque. Appl. Microbiol. Biotechnol. 100, 385–396. doi: 10.1007/s00253-015-7049-4
Yamada, H., Moriishi, E., Haredy, A.M., Takenaka, N., Mori, Y., Yamanishi, K., Okamoto, S. (2012). Influenza virus neuraminidase contributes to the dextran sulfatedependent suppressive replication of some influenza A virus strains. Antiviral Research. 96: 344‐352.