La inmunología tiene su origen en el estudio de cómo el cuerpo nos protege frente a las enfermedades infecciosas causadas por microorganismos y otros parásitos. Sin embargo, el concepto fundamental que la define es su extraordinaria capacidad para distinguir entre lo propio y lo ajeno. Esta discriminación es la base para cómo los organismos se defienden de las amenazas y mantienen su salud.
El sistema inmunitario debe ser capaz de identificar y atacar a los agentes externos que pueden perjudicar al organismo. Estos agentes se conocen como antígenos e incluyen tanto patógenos como sustancias extrañas capaces de causar daño. Un caso especial lo constituyen las células tumorales, que, si bien son propias del organismo, dejan de ser reconocidas como tales al presentar comportamientos anómalos, como el crecimiento descontrolado y la pérdida de sus funciones fisiológicas. Así, la inmunología requiere una extraordinaria y exquisita capacidad para diferenciar entre el “yo” y “lo demás” (y aquello deja de comportarse como “yo”), y responder adecuadamente para mantener la homeostasis y la integridad del organismo.
Otros conceptos, igualmente fundamentales en inmunología y en sintonía con la capacidad de discriminar entre propio y extraño, son la especificidad y la memoria. El concepto de memoria fue el primero en reconocerse desde la antigüedad y se derivó de la observación de que los individuos enfermos que lograban superar una enfermedad (infecciosa) quedaban exentos de sufrirla nuevamente, esto es, inmunes. La especificidad se pudo reconocer en toda su extensión gracias al estudio de los anticuerpos, que constituyen uno de los mecanismos efectores de la inmunidad adquirida o adaptativa. La primera mitad del siglo XX estuvo dedicada casi exclusivamente al estudio de la naturaleza y de la especificidad de los anticuerpos. A esta época se le denomina la era de la “inmunoquímica”. Sin embargo, la segunda mitad del siglo XX vio el nacimiento de un enfoque radicalmente distinto de la inmunología, centrado en las células que participan en la inmunidad. Así, a mediados de la década de los cincuentas se descubrió el sitio de origen de las dos células fundamentales de la inmunidad adquirida; en los pollos se identificó la bolsa de Fabricio como el sitio de producción de las células precursoras de anticuerpos (en mamíferos es la médula ósea); dichas células recibieron el nombre de linfocitos B (del inglés, Bone marrow). También se identificó el sitio de origen de un tipo de linfocitos con capacidad de rechazar injertos y de colaborar con los linfocitos B. Dichos linfocitos se denominaron T porque su sitio de maduración es el timo.
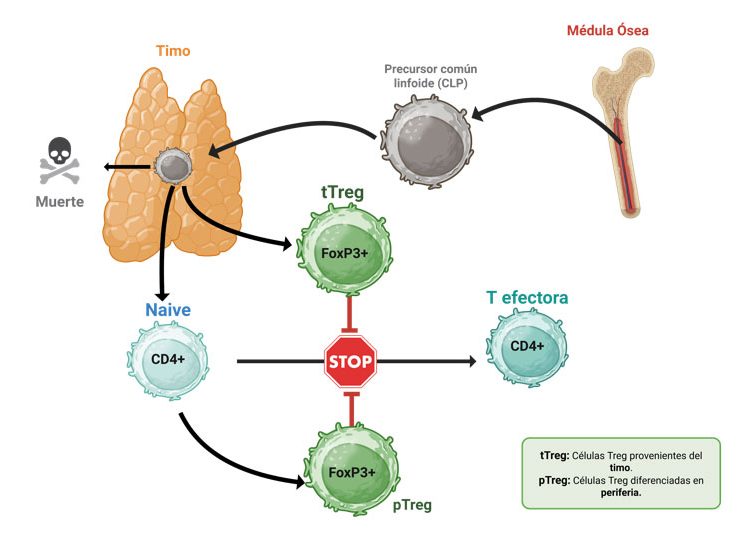
Dos investigadores recibieron el premio Nobel de Fisiología o Medicina en 1960, otorgado conjuntamente a Sir Frank Macfarlane Burnet y a Peter Brian Medawar, por su descubrimiento de la tolerancia inmunológica. Este descubrimiento demostró que el sistema inmunológico debe aprender a reconocer y aceptar sus propias células, lo que revolucionó la comprensión de la inmunidad y del rechazo de los injertos. De esta manera, se explicaba que el aprendizaje de lo propio y lo extraño por los linfocitos ocurría durante el desarrollo fetal y culminaba alrededor del nacimiento. El concepto explicaba que durante el desarrollo se producen linfocitos capaces de reconocer propio y extraño, pero es durante su maduración cuando los linfocitos que se encuentran con antígenos propios son seleccionados negativamente (eliminados o incapacitados para continuar su desarrollo y alcanzar la madurez) y solo aquellos que no tuvieron contacto con su antígeno se les permitía progresar y llegar a la madurez.
El concepto de tolerancia central marcó un paradigma que sigue vigente hasta hoy; sin embargo, muy pronto demostró ser insuficiente. En 1971, Richard Gershon, investigador de la Universidad de Yale, demostró que era posible inducir un estado de tolerancia (no respuesta) incluso en la etapa adulta. El concepto lo denominó “tolerancia infecciosa” porque demostró que la tolerancia de un ratón podía transferirse a otro animal de la misma cepa mediante linfocitos. Es importante contextualizar que, apenas unos meses antes, se habían descrito moléculas que permitían identificar a los linfocitos provenientes de la médula ósea o del timo. Así que Gershon describió que los linfocitos responsables de esta tolerancia adquirida o inducida en la etapa adulta eran derivados del timo. Este hallazgo inició una carrera frenética para identificar dichas células, que inicialmente se denominaron “linfocitos T supresores”. Sin detallar la historia obscura que se vivió en la década de los setenta, que podría ser motivo de un capítulo aparte, la década concluyó sin consenso sobre dicha población celular, entre otras razones, porque la literatura estaba llena de trabajos poco reproducibles. Durante los ochentas se incorporaron plenamente las técnicas de biología molecular a la inmunología, y surgieron preguntas más urgentes y de mayor interés, por lo que la identificación plena de una población celular con capacidad supresora fue abandonada casi por completo por la mayoría de los grupos de investigación. Los trabajos pioneros de Tim Mossman y Bob Coffman, a mediados de los ochentas, demostraron que los linfocitos T se comunican entre sí a través de proteínas solubles denominadas citocinas (por ejemplo, las interleucinas) y que, según el tipo de citocina, la comunicación puede resultar en sinergia o antagonismo. Así, un mismo linfocito T, dependiendo del tipo de citocina que produce, podría ser simultáneamente cooperador o supresor, por lo que ya no resultó necesario buscar células supresoras.
En 1995, Shimon Sakaguchi y su grupo publicaron un artículo en el Journal of Immunology que marcaría un punto de inflexión en el estudio de las células T supresoras. Ellos descubrieron que la eliminación del timo en ratones de 3 días de edad (en los que la temporalidad fue fundamental para el hallazgo) provocaba la aparición de enfermedades autoinmunes (en las que el sistema inmunológico se rebela y destruye sus propios tejidos), pero el reemplazo de linfocitos T en ratones adultos retardaba o suprimía la autoinmunidad. El trabajo de Sakaguchi y sus colaboradores tuvo dos grandes virtudes: primero, proporcionó un sistema experimental reproducible que podía validarse en cualquier laboratorio; y, enseguida, identificó dos moléculas que se expresan claramente en estas células, lo que permitió su identificación. Las moléculas en cuestión son las proteínas CD4 y CD25 (CD es un acrónimo de Cluster of Differentiation). La proteína CD4 se refiere a moléculas que sirven para identificar células en diversos estadios de desarrollo o distintos linajes, mientras que CD25 constituye la cadena alfa del receptor de interleucina 2, y es una citocina esencial para el desarrollo y la función de esta población celular.
Aquí amerita un breve paréntesis para hablar de las enfermedades autoinmunes. Dichas patologías, como ya se mencionó, son enfermedades del sistema inmunológico en las que las células de la inmunidad se vuelven contra el propio organismo. Las células autorreactivas (es decir, que reconocen a lo propio y no fueron eliminadas durante el desarrollo) deben suprimirse para evitar que causen daño. Esta fue la aportación de Gershon, cuyo destino fue objeto de tan fuertes cuestionamientos. Por esta razón, cuando esta población celular fue “redescubierta” por Sakaguchi y otros grupos de investigación y pudo ser claramente identificada, fue denominada célula “T reguladora” (o Treg) para ocultar su oscuro pasado.
En el campo de las enfermedades autoinmunes, Hans Ochs, un inmunólogo clínico de la Escuela de Medicina de la Universidad de Washington en Seattle, identificó un grupo de pacientes pediátricos con manifestaciones severas de autoinmunidad que se manifestaban pocas semanas después del nacimiento. Los hallazgos clínicos incluían diarrea severa, diabetes tipo 1 a partir del tercer mes de vida, daño a la médula ósea que provocaba pérdida de glóbulos rojos y blancos, y muerte a los pocos meses del nacimiento. Dicha enfermedad no tenía cura y no se habían identificado los mecanismos que la desencadenaban. La enfermedad se denominó “síndrome de desregulación con poliendocrinopatía y enteropatía asociada al cromosoma X” (IPEX, por sus siglas en inglés). Muy pronto, otros investigadores describieron más casos, lo que permitió determinar que se trataba de un defecto genético grave que suprime la capacidad del organismo para producir células T reguladoras.
Una vez reacreditada “bona fide” la función supresora de las células T reguladoras, hubo una explosión en el campo, pues gracias a su definición, se pudieron explicar muchos tipos de patologías en los que se sospechaba una deficiencia en la capacidad reguladora de la respuesta inmune. Campos tan diversos como la inflamación, las alergias, diversos tipos de infecciones, el cáncer, las inmunodeficiencias, además de las ya mencionadas enfermedades autoinmunes, ahora pueden explicarse por defectos en la regulación y, más específicamente, por la función (o falta de ella) de las células T reguladoras.

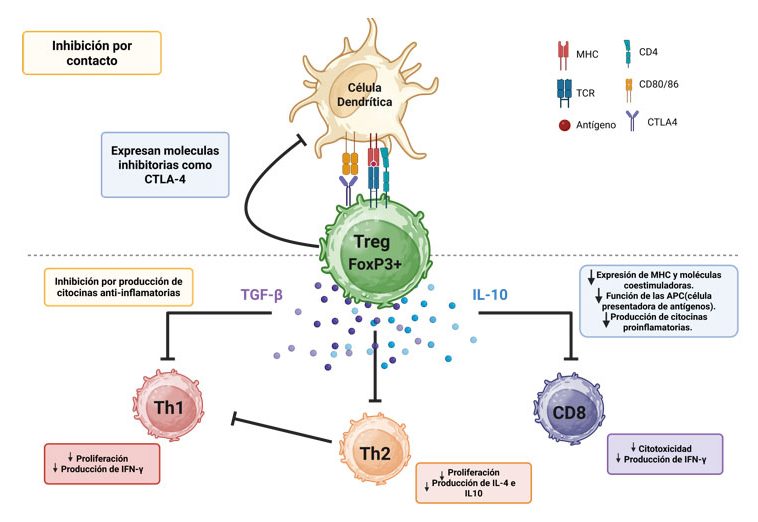
La siguiente pregunta fue (y sigue siendo) cómo regulan las T regs, algo que queda fuera del alcance de esta breve revisión. Solo mencionaré que ejercen su función a través del contacto directo con otras células (eliminándolas o bloqueando su función) por medio de moléculas presentes en su membrana; así como también gracias a algunas citocinas (siendo la interleucina 10 y el factor de crecimiento transformante beta los más prominentes). Quizá lo relevante es que al menos dos de las moléculas reguladoras demostraron su potencial para la intervención farmacológica, lo que derivó en el premio Nobel de Fisiología y Medicina en el 2018 y en terapias exitosas para tratar el cáncer.
El siguiente componente en la definición de las T regs fue el hallazgo de un factor de transcripción que regula su diferenciación. El descubrimiento de FOXP3 fue un proceso colaborativo que se inició con la identificación de las células T reguladoras por Shimon Sakaguchi en los 90 y culminó, de manera independiente, en 2001, con la identificación del gen en ratones con el fenotipo “scurfy” (casposo o escamoso) por Mary Brunkow (Department of Molecular and Medical Genetics, Oregon Health Sciences University) y Fred Ramsdell (Celltech Chiroscience, Inc.). Dichos ratones presentan una proliferación linfocítica grave e incontrolada, así como manifestaciones severas de autoinmunidad. Los ratones con esta mutación desarrollan una enfermedad sistémica fatal debido a una desregulación masiva del sistema inmunitario, muy similar al síndrome de IPEX en humanos.
El factor de transcripción FOXP3 pertenece a la familia de reguladores transcripcionales forkhead/winged-helix y comparte características estructurales generales con otros miembros de la familia FOXP. Los factores de transcripción son moléculas que activan o inhiben la transcripción al unirse a regiones específicas del ADN, favoreciendo o impidiendo la producción de ARN mensajero y, por tanto, de proteínas. Las mutaciones de FOXP3 (cambios en su secuencia de aminoácidos que impiden su unión al ADN y, por lo tanto, su función) alteran su función en humanos y provocan IPEX, mientras que en ratones su deleción causa el fenotipo scurfy, con una patología similar. En 2003, Shimon Sakaguchi logró unir los hallazgos anteriores al demostrar que el gen FOXP3 era el “interruptor maestro” del desarrollo y la función de las células T reguladoras que él había identificado, y finalmente otorgó el certificado de autenticidad a esta población celular. Este grupo demostró que la introducción del gen que codifica la proteína FoxP3 le confiere al linfocito T que la recibe funciones reguladoras, aún cuando dicha célula hubiera tenido una función distinta de la de supresión.
Para concluir este breve repaso, es importante mencionar que hoy en día se han identificado , además de las células T reguladoras del timo, otras células T que pueden ser reconvertidas a una función supresora. No solo eso: la función supresora no se circunscribe a los linfocitos T, ya que también se han identificado linfocitos B e incluso otros leucocitos con funciones supresoras. Así, el campo redescubierto por el trabajo cuidadoso de Shimon Sakaguchi y sus colaboradores ha abierto múltiples avenidas para el reconocimiento de diversas patologías y la identificación de distintos tratamientos para enfermedades tan heterogéneas como algunos síndromes inflamatorios graves, las autoinmunidades, el cáncer, las alergias, etc. Los abordajes terapéuticos incluyen desde el uso de fármacos que favorecen o inhiben la función de FOXP3, hasta el uso de antícuerpos monoclonales contra moléculas expresadas o secretadas por las T regs, la manipulación genética para reconvertir la función de los linfocitos T, e incluso la generación “in vitro” de T regs y su reinfusión en el paciente. Recientemente se ha empezado a mencionar el papel que podrían desempeñar las células T reguladoras durante el envejecimiento, ya que estas células regulan, entre otras cosas, el fenómeno inflamatorio crónico que, en menor grado, se presenta durante la vejez, por lo que todavía hay mucho por aprender sobre estas células.
Referencias.
¿Qué es la inmunología? British Society for Immunology, https://www.immunology.org/es/public-information/inmunolog%C3%ADa-bitesized/special-topics/que-es-la-inmunologia.
Sakaguchi S, Sakaguchi N, Asano M, Itoh M, Toda M. Immunologic self-tolerance maintained by activated T cells expressing IL-2 receptor alpha-chains (CD25). Breakdown of a single mechanism of self-tolerance causes various autoimmune diseases. J Immunol. 1995 Aug 1;155(3):1151-64.
Hori S, Nomura T, Sakaguchi S. Control of regulatory T cell development by the transcription factor Foxp3. Science. 2003 Feb 14;299(5609):1057-61.
Sakaguchi S, Mikami N, Wing JB, Tanaka A, Ichiyama K, Ohkura N. Regulatory T Cells and Human Disease. Annu Rev Immunol. 2020 Apr 26;38:541-566.
Wildin RS, Ramsdell F, Peake J, Faravelli F, Casanova JL, Buist N, Levy-Lahad E, Mazzella M, Goulet O, Perroni L, Bricarelli FD, Byrne G, McEuen M, Proll S, Appleby M, Brunkow ME. X-linked neonatal diabetes mellitus, enteropathy and endocrinopathy syndrome is the human equivalent of mouse scurfy. Nat Genet. 2001 Jan;27(1):18-20.
Brunkow ME, Jeffery EW, Hjerrild KA, Paeper B, Clark LB, Yasayko SA, Wilkinson JE, Galas D, Ziegler SF, Ramsdell F. Disruption of a new forkhead/winged-helix protein, scurfin, results in the fatal lymphoproliferative disorder of the scurfy mouse. Nat Genet. 2001 Jan;27(1):68-73.
Agradecimientos: Agradezco la colaboración de las Maestras en Ciencias, Rubí Ramírez Quintero y Zafiro Juaréz Rivera, en la elaboración de las figuras.
*Foto de portada: Niklas Elmehed © Nobel Prize Outreach











