El cáncer de mama (CaMa) es la neoplasia más común en mujeres en el mundo. La enfermedad constituye el 33% del total de casos de cáncer y es la causa de cerca del 15% de muertes femeninas provocadas por tumores malignos. De acuerdo con la Organización Mundial de la Salud (OMS), se estima que en 2025 habrá más de 20 millones de nuevos casos de CaMa (Rivera-Franco, 2018).
En México, el CaMa presenta un alza tanto en la incidencia como en la mortalidad. Ambos incrementos derivan de un diagnóstico tardío y la baja eficacia de los programas de detección oportuna (Gómez-Dantés, 2016). Por ejemplo, de acuerdo con datos del Instituto Nacional de Estadística, Geografía e Informática (INEGI), se calcula que en el país se diagnostican más de 50 pacientes con CaMa por día laborable y mueren poco más de 10 mexicanas diariamente (INEGI, 2012). Aunado a ello, sólo el 30.8% de los casos son detectados en estadios tempranos, y, por el contrario, más de la mitad (66.4%), son detectados en etapas localmente avanzadas. La deficiencia en la detección oportuna de la enfermedad impacta en las posibilidades de recuperación total, que es de apenas un 35% (Perou, 2000). La alta proporción de pacientes dictaminadas en estadios avanzados de la enfermedad obedece a diversos factores, entre los que se encuentran la falta de información, educación y aplicación de métodos de detección temprana.
Así, el CaMa es una enfermedad compleja con variaciones sustanciales en su desarrollo clínico, aspectos morfológicos y patrones de expresión génica. Un caso sospechoso de CaMa se evalúa con estudios de imagenología como son: mastografía, ecografía y resonancia magnética. Enseguida, se procede a la extirpación del tumor o a la toma de una muestra para establecer el diagnóstico definitivo. A continuación, se define el avance de la enfermedad mediante métodos de estadificación clínica. La herramienta más frecuente es la descripción del estadio mediante el sistema T (Tumor), N (Ganglios linfáticos) y M (Metástasis), del American Joint Committee on Cancer. Estos parámetros se combinan y se determina el avance de la enfermedad. Existen 5 estadios del CaMa: estadio 0 (cero), que es carcinoma ductal in situ no invasivo; y de forma ascendente los estadios del I al IV, que indican CaMa invasivo (Amin, 2017).
Aunado a los parámetros mencionados, el análisis del estado de expresión de los receptores de estrógenos (ER) y progesterona (PR), definido como positivo (+) o negativo (-), mediante ensayos de inmunohistoquímica (IHQ), ayuda a determinar aspectos como el tratamiento a seguir (endocrinológico, terapia con anticuerpos monoclonales o, quimioterapia), el riesgo de recurrencia de la enfermedad y el pronóstico de sobrevivencia (Sørlie, 2001). Además, es importante evaluar la expresión del receptor del factor de crecimiento epidermal 2 (HER2). En este caso, pacientes con cáncer invasivo y positivo en este parámetro (HER2+), podrán ser tratadas con fármacos dirigidos contra dicho receptor. La determinación de la expresión de los 3 marcadores mencionados se emplea para desarrollar una escala de clasificación molecular del CaMa en subtipos: luminal A, luminal B, HER2 positivo (HER+) y triple negativo (Goldhirsch, 2011).
De acuerdo con la clasificación mencionada, los tumores del subtipo luminal A y B, son las neoplasias más comunes, caracterizadas principalmente por la expresión de ER+ y PR+. Estos tumores suelen tener la mejor tasa de supervivencia al expresar los blancos terapéuticos adecuados para aplicar una terapia endócrina (inhibidores de la actividad de los estrógenos). Los CaMa HER2+, se caracterizan por presentar el fenotipo ER-, PR- y HER2+. En estos tumores, se encuentra ampliamente aceptada la aplicación de inhibidores específicos de HER2 (anticuerpos monoclonales o inhibidores enzimáticos). Finalmente, los tumores triples negativos son aquellos con fenotipo ER-, PR- y HER2- (Rexer, 2012). Estas neoplasias presentan un curso agresivo y son de particular interés clínico debido a que sus opciones de tratamiento se limitan a los esquemas con agentes quimioterapéuticos debido a la ausencia de otros blancos farmacológicos. Además, se demuestra que estos tumores son clínicamente más agresivos al presentar una tasa de proliferación celular alta y una baja respuesta a los tratamientos, por lo que generalmente tienen un mal pronóstico. Por ejemplo, durante los primeros cinco años después del diagnóstico en pacientes con este tipo de tumor, hay una alta tasa de metástasis y recurrencia en órganos distantes (Dent, 2010).
A pesar de que actualmente existen diversos métodos para combatir el CaMa, en la mayoría de los casos se genera rápidamente resistencia a los mismos. Sumado a lo anterior, es importante tener en cuenta los casos de las pacientes con tumores triple negativos en los cuales las opciones terapéuticas son muy limitadas.
En nuestro grupo de investigación nos hemos dado a la tarea de buscar nuevos blancos terapéuticos con la finalidad de coadyuvar los esquemas de tratamiento que existen. Para ello, hemos evaluado el impacto de nuevas moléculas dentro de la progresión del CaMa. En este sentido, diversos grupos de investigación estudian algunos biomarcadores como las proteínas BRCA-1 y BRCA-2, ATM, CDH1, CHEK2, NBN, NFI, PALB2, PTEN, STK11 y TP53. Sin embargo, la presencia de sus formas mutantes en la población mundial es extremadamente baja, por lo que su impacto en la progresión del CaMa es limitado. Por ejemplo, la proteína BRCA-1/2, que es la mutación genética más conocida y comúnmente evaluada en familias con cáncer hereditario de mama y ovario, se encuentra en sólo el 0.25% de la población mundial. Por el contrario, las variantes del oncogén KRAS se hallan entre el 6 y el 10% de la población, lo que hace que este gen sea 20 veces más común. Así, se establece que hay una fuerte asociación de las formas mutantes de KRAS con la aparición y progresión de muchos tipos de cáncer, especialmente en cáncer de páncreas (90%), de colon (27-56%), de pulmón (17-30%) y de mama (5-20%) (Jančík, 2010). Otro punto que sustenta el posible papel de KRAS durante la progresión del CaMa es la presencia de proteínas constitutivamente activas, principalmente en tumores triple negativo con las mutaciones G12D (Gly12Asp; GGT> GAT) o G13D (Gly13Asp; GGT> GAT) (Erdogan, 2016).
Con base en lo anterior, la presencia de KRAS mutado en CaMa se asocia con tumores de subtipos moleculares de rápida progresión y mal pronóstico, momento en el cual la elección y efectividad de los tratamientos convencionales se ve comprometida. Por lo tanto, la evaluación de KRAS como posible biomarcador en CaMa podría favorecer el diagnóstico y la selección del tratamiento, así como mejorar la respuesta y el pronóstico de las pacientes.
Con el objetivo de demostrar la asociación de la forma mutada de KRAS con la progresión de CaMa, nos dimos a la tarea de determinar los niveles de expresión del gen de interés en cinco líneas celulares de cáncer de mama. Lo modelos fueron la línea celular MCF -10A, la cual es la línea control de mama no tumorogénica, las líneas celulares MDA-MB-231 y MDA-MB-231RR como células tumorogénicas que expresan la forma mutante de la proteína KRas (G13D) y, finalmente, evaluamos la expresión en las líneas tumorogénica no mutantes de la proteína KRas, MCF-7 y MCF-7RR.
Con estos ensayos, logramos determinar que existe una expresión diferencial del gen KRAS en los modelos de estudio (Figura 1). Considerando los valores de KRAS en la línea celular MCF-10A como los niveles habituales, se observa que las líneas MCF-7 y MCF-7RR (tumorogénicas sin mutación en KRAS), tienden a presentar altos niveles de expresión de KRAS (Figura 1A). Por el contrario, las líneas MDA-MB-231 y MDA-MB-231RR (tumorogénicas con mutación en KRAS), muestran una disminución substancial en los niveles de expresión del gen KRAS (Figura 1A). Para evaluar el efecto que este cambio puede tener sobre otras moléculas, determinamos la expresión de otro gen asociado a KRAS. En este caso seleccionamos a la PDE6∆, molécula responsable de transportar a la proteína KRas a la membrana celular. Los ensayos demostraron que el gen PDE6∆, se expresa de manera inversa a KRAS. Es decir, con respecto al control, hubo un incremento de PDE6∆ tanto en células sin mutación como células con mutación (Figura 1B).
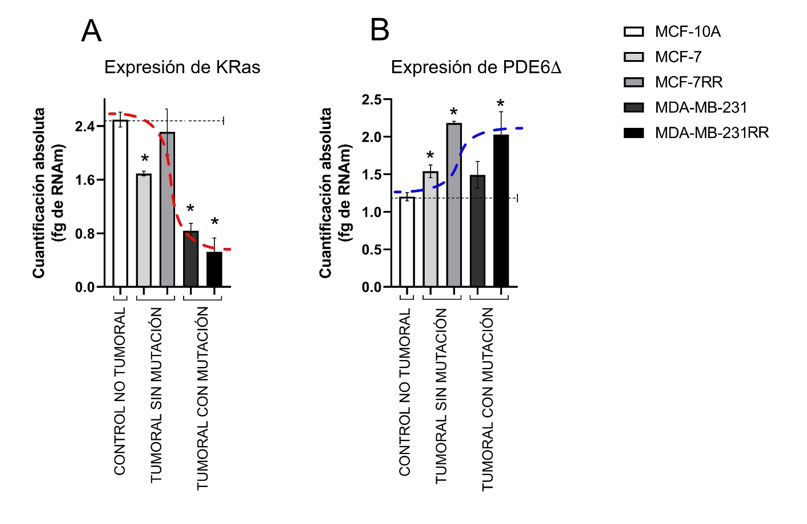
En conclusión, proponemos de manera preliminar que las células tumorales que exhiben las formas mutantes de KRAS presentan niveles bajos de esta molécula. Por el contrario, en las células tumorales sin mutación en el gen KRAS, los niveles de esta molécula son altos. Así mismo, se observó un incremento de expresión de PDE6∆ en las líneas celulares de cáncer de mama triple negativo. Esto puede ser reflejo de un mecanismo compensatorio por la baja en la proteína KRas. De comprobarse la información descrita, podría proponerse el uso de KRAS como un posible marcador pronóstico de CaMa. Quedan por esclarecer los mecanismos por los cuales las mutaciones de KRAS podrían afectar sus niveles de expresión, tanto de la proteína KRAS como de PDE6∆. Aún existen incógnitas por dilucidar como ¿Cuál es la importancia de KRas en la progresión de la enfermedad? o ¿Cómo es la interacción de estas formas mutantes con el resto de las moléculas que participan en la progresión del CaMa?
Rivera-Franco MM, Leon-Rodriguez E. Delays in breast cancer detection and treatment in developing countries. Breast cancer: basic and clinical research 2018; 121178223417752677.
Gómez-Dantés H, Lamadrid-Figueroa H, Cahuana-Hurtado L et al. The burden of cancer in Mexico, 1990-2013. salud pública de méxico 2016; 58118-131.
Instituto Nacional de Estadística y Geografía (INEGI), 2012. Estadística de mortalidad.
Perou CM, Sørlie T, Eisen MB et al. Molecular portraits of human breast tumours. nature 2000; 406747-752.
Amin MB, Greene FL, Edge SB et al. The Eighth Edition AJCC Cancer Staging Manual: Continuing to build a bridge from a population-based to a more “personalized” approach to cancer staging. CA Cancer J Clin 2017; 6793-99.
Sørlie T, Perou CM, Tibshirani R et al. Gene expression patterns of breast carcinomas distinguish tumor subclasses with clinical implications. Proc Natl Acad Sci U S A 2001; 9810869-10874.
Goldhirsch A, Wood WC, Coates AS et al. Strategies for subtypes—dealing with the diversity of breast cancer: highlights of the St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2011. Annals of oncology 2011; 221736-1747.
Rexer BN, Arteaga CL. Intrinsic and acquired resistance to HER2-targeted therapies in HER2 gene-amplified breast cancer: mechanisms and clinical implications. Crit Rev Oncog 2012; 171-16.
Dent R, Trudeau M, Pritchard KI et al. Triple-negative breast cancer: clinical features and patterns of recurrence. Clinical cancer research 2007; 134429-4434.
Jančík, S., Drábek, J., Radzioch, D., & Hajdúch, M. (2010). Clinical relevance of KRAS in human cancers. BioMed Research International, 2010.
Erdogan, G., Ozcan, M., Karaveli, F. S., & Pestereli, H. E. (2016). KRAS, EGFR AND PIK3CA mutation in triple negative breast carcinomas. International Journal of Medical Research & Health Sciences, 5(3), 95-104.