En diciembre de 2019 surgió un nuevo coronavirus en Wuhan, China, que se extendió por todo el mundo y provocó una infección respiratoria que ha causado cientos de miles de muertes.[1] Este nuevo coronavirus fue identificado y catalogado como SARS-CoV-2,[2] mientras que la infección en el tracto respiratorio se ha denominado COVID-19.[3]
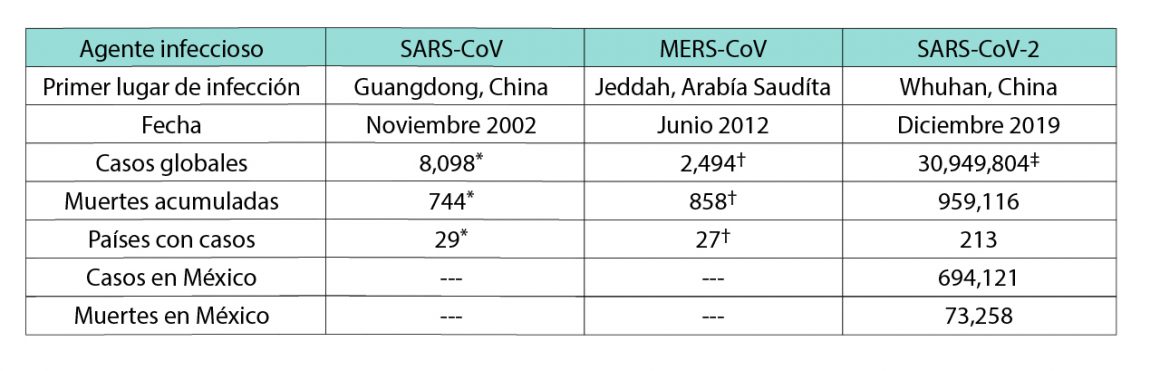
El SARS-CoV-2 se relaciona con el coronavirus SARS-CoV, agente viral causante del Síndrome Respiratorio Agudo Severo (SARS). Dado que comparte alrededor del 80% de identidad en el marco del genoma completo, con hasta un 90% de las proteínas funcionales y estructurales clave,[4] se considera que SARS-CoV-2 pertenece a la misma especie que SARS-CoV y MERS-CoV-2;[5] sin embargo, su tasa de transmisión es mucho mayor (Tabla 1).[6]
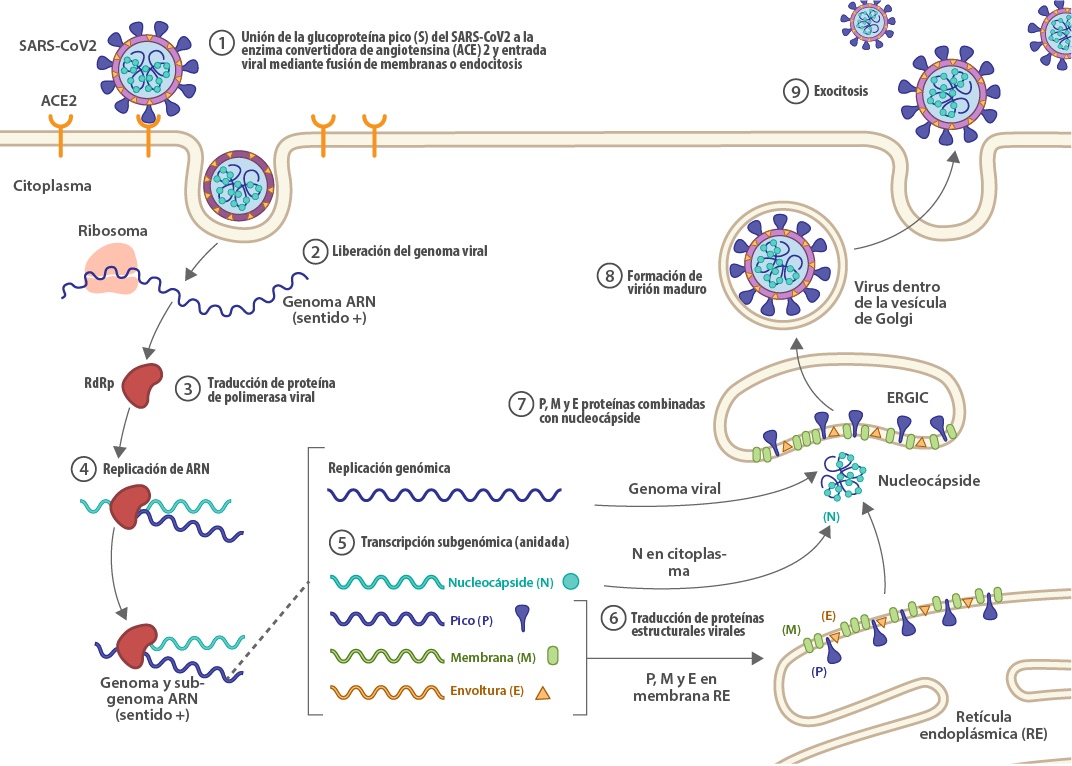
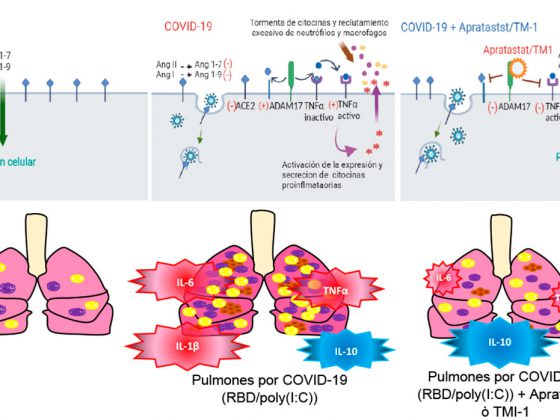
La meta de muchos grupos de investigación es comprender cómo evitar el desarrollo y progreso de la enfermedad clínica del COVID-19, en especial, de aquellos cuadros severos.[10] Dentro de estos esfuerzos, se busca esclarecer el origen, la patogenicidad y estructura genética del virus (Figura 1).[11] Sin embargo, surgen nuevas variantes (mutaciones) que conducen a cuadros infecciosos distintos, como el caso de la mutación en la proteína de unión viral espiga (o spike), donde la variante G614 ha desplazado a la D614.[12] La altísima similitud de secuencia aminoacídica de estas proteínas presentes en SARS-CoV de humano, y de murciélagos, con SARS-CoV-2 (ca. 99%) enfatizan la importancia de una mutación puntual para el desarrollo de nuevos cuadros clínicos, y por ende, la necesidad de nuevos medicamentos.
A pesar de que las proteínas espiga de SARS-CoV y SARS-CoV-2 comparten alta identidad de secuencia, estas mutaciones no solo pudieran traducirse en un problema clínico, sino también reducir la valía de las investigaciones realizadas con variantes “tempranas”, por ser poco prevalentes en el escenario actual de la pandemia. Esto plantea un gran desafío para contar con un tratamiento efectivo para esta enfermedad. Algo similar pudiese suceder con otras proteínas farmacológicamente relevantes como blanco de posibles medicamentos, como las proteasas,[4] cuya identidad de secuencias entres los distintos coronavirus del tipo SAR ronda en el ~96%.
Si bien existen avances en el desarrollo de agentes de inmunización,[13] el panorama de la vacunación profiláctica luce como una solución a mediano y largo plazo.[14] Esto ha llevado a que se reconsideren fármacos, utilizados para otros padecimientos, para su aplicación en nuevas terapias antivirales. A eso se le conoce como “drug repurposing”, que es, el reuso de fármacos y moléculas pequeñas en general para el tratamiento de COVID-19.[15] Estos esfuerzos pueden partir del laboratorio sintético y/o del laboratorio in sílico: en ellos se proponen nuevas y más eficientes rutas de síntesis, así como nuevos derivados basados en una molécula líder, de origen sintético o natural, que ha mostrado eficacia contra coronavirus relacionados, tal es el caso del SARS-CoV y el MERS-CoV.
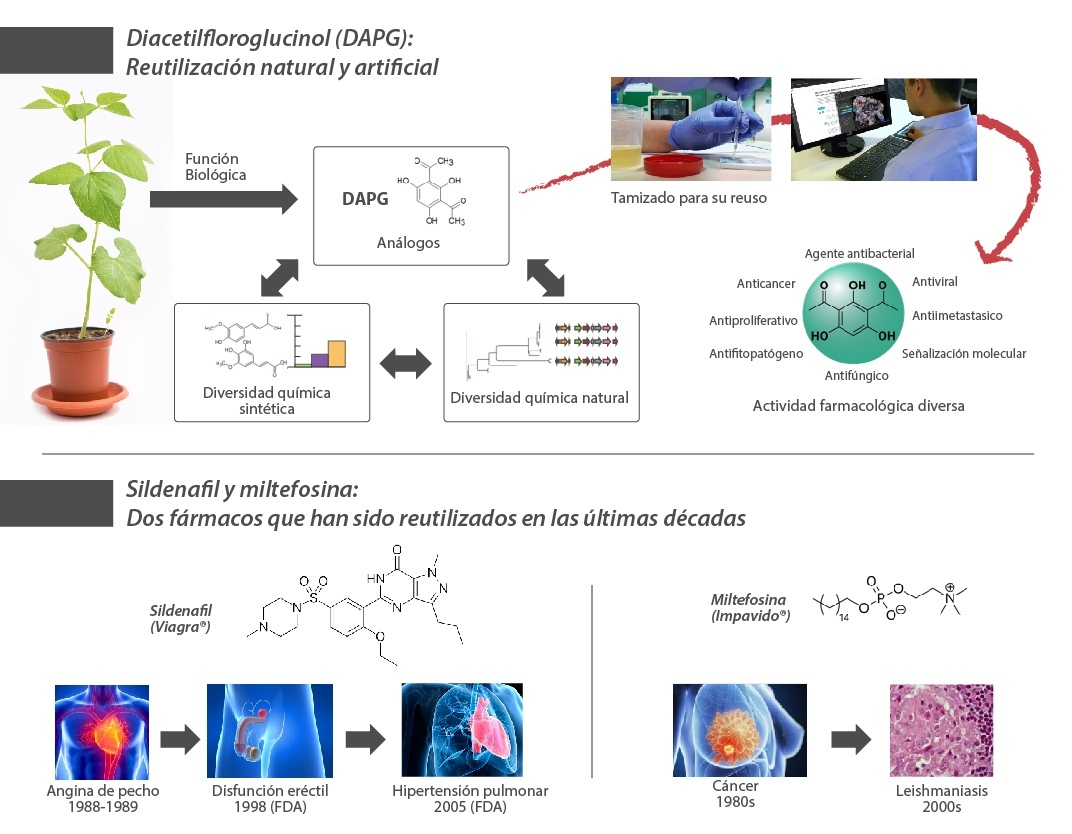
Esta estrategia encuentra un símil en los procesos de evolución natural que derivan en la inmensa diversidad química producida por microbios y bacterias.[16] Por ejemplo, diversos metabolitos secundarios como el compuesto fenólico 2,4-diacetilfloroglucinol producido por bacterias del género Pseudomonas, y cuyo proceso evolutivo ha derivado en una multitud de funciones biológicas y actividades farmacológicas.[17] Por lo tanto, este ensayo tiene como objetivo dar a conocer iniciativas selectas de reutilización de fármacos con naturaleza quimioterapéutica para el tratamiento de pacientes con COVID-19.[18]
Estrategias de reutilización de fármacos contra SARS-CoV-2
El proceso de infección de células sanas se puede dividir en 4 diferentes etapas: unión, fusión, replicación y liberación. Es por ello que el estudio estructural del SARS-CoV-2 y las entidades bioquímicas involucradas en cada una de las etapas que constituyen la infección, han expuesto a los diferentes blancos para combatirlo. Como se anticipaba en párrafos anteriores, la situación de emergencia actual ha llevado a que medicamentos catalogados tradicionalmente como antibióticos, antiparasitarios e inmunoterapéuticos, sean considerados como potenciales disruptores de alguna de las etapas de infección por SARS-CoV-2. En adición a lo anterior, también se está evaluando vigorosamente la aplicabilidad de moléculas que han mostrado actividad contra los coronavirus SARS-CoV y MERS-CoV.[12b]
Inhibidores dirigidos a la unión y la fusión con la célula huésped
Uno de los objetivos que busca inhibir la infección es imposibilitar el ingreso viral a la célula. Dentro de los objetivos que han sido identificados para evitarlo, están las proteínas presentes en la membrana celular: aquella que sirve como receptor para la unión del virus en la célula objetivo, denominada enzima convertidora de Angiotensina 2 (ACE2);[19] así como TMPRSS2 y CatB/L, que son promotoras de la escisión del sitio de reconocimiento S1/S1 de la proteína espiga, permitiendo la unión a membrana e ingreso del material vírico.[20] El losartán (Cozaar®) y el telmisartán (Micardis®) son dos medicamentos que originalmente son prescritos para tratar hipertensión e insuficiencia cardiaca (Figura 3).[21] Al ser dos fármacos pertenecientes al grupo de antagonistas del receptor de angiotensina II, son de los primeros medicamentos que han mostrado actividad inhibitoria de los sitios receptores ACE2. El modelo propuesto implica, además del bloqueo de la unión de la proteína espiga al receptor ACE2, “obstaculizar” a las sustancias que causan la constricción de los vasos sanguíneos reduciendo así la presión arterial. Lo anterior es un factor importante relacionado con la mortalidad por COVID-19.[22]
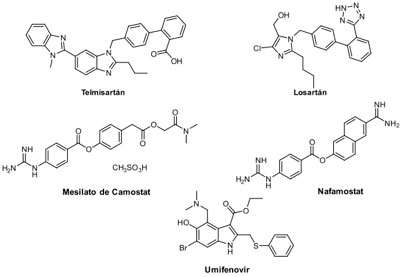
Otro medicamento que inhibe la fusión entre las partículas virales y las membranas plasmáticas y endosomales de virus diversos, es el umifenovir (Arbidol®).[23] Este fármaco está aprobado en algunos países para el tratamiento de la influenza,[24] aunque la Agencia de Alimentos y Medicinas de los EE. UU. (FDA, por sus siglas en inglés) no lo reconoce como tal.[25] Existen en progreso algunas pruebas clínicas que buscan validar el uso del umifenovir en pacientes con COVID-19;[26] sin embargo, hay evidencia que pone en duda su significancia terapéutica.[27] Existen reportes que revelan que el mesilato de camostat (Foistar®, Camostate®) , y el nafamostat (Futhan®, Nafatat®), inhibidores de proteasas de serina, han mostrado actividad inhibitoria en TMPRSS2.[19a,28]Ambos están aprobados en algunos países para el tratamiento de diversos tipos de pancreatitis,[29] y el nafamostat también es útil como anticoagulante durante procesos de hemodiálisis.[30] El nafamostat ha sido sujeto de pruebas clínicas en Japón en meses recientes[31] y próximamente en Corea del Sur[32] y se ha propuesto como el candidato antiviral más potente de los fármacos aprobados por FDA.[33] En México, el camostat entrará en fase clínica 2 para el tratamiento de COVID-19 en varios centros de salud como el Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán.[34]
Para prevenir la fusión de la proteína viral a la membrana celular, se ha planteado el uso de la cloroquina (CQ, Aralen®) e hidroxicloroquina (HCQ, Plaquenil®) (Figura 2). Estos fármacos se han usado para el tratamiento contra la malaria y artritis reumatoide,[35] y también presentan efectos antiinflamatorios y de modulación de la respuesta inmunitaria.[36] CQ e HCQ mostraron efectos antivirales contra SARS-CoV-2 in vitro, cuyo mecanismo de acción propuesto es la inhibición a través de interacciones con ácidos siálicos y gangliósidos en el huésped, impidiendo la fusión del virus en la célula huésped.[37] Sin embargo, su uso ha sido controvertido debido a que genera efectos indeseados como como lo es el daño a tejidos (e. g. hígado y células endoteliales).[38] Aunado a lo anterior, resultados de pruebas realizadas en Francia y Reino Unido demuestran que el uso de la HCQ en pacientes hospitalizados por COVID-19 no se refleja en la disminución de la mortalidad de pacientes con COVID-19 severo.[39] Es importante mencionar también que la FDA revocó la autorización para el uso de emergencia de estos dos fármacos a mediados de junio de 2020.[40], [41] A pesar de lo anterior, están por comenzar estudios clínicos en fase II de la HCQ en Colombia (etapa previa a periodo de reclutamiento).[42]
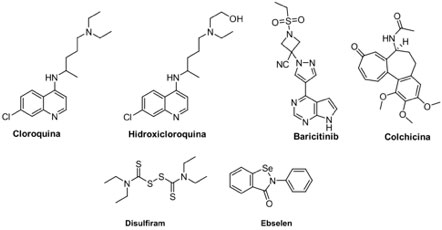
Otro fármaco que ha sido estudiado para inhibir fusión viral es el baricitinib (Olumiant®),[43] prescrito para artritis reumatoide,[44] el cual se ha empleado en algunos ensayos clínicos contra COVID-19.[45] La colchicina es un fármaco antiguo, que clásicamente se ha utilizado para tratar a lo largo de los años, desordenes inflamatorios;[46] se ha considerado para el tratamiento del COVID-19 dado que disminuye el riesgo hacia el síndrome de dificultad respiratoria aguda (SDRA), [47] que es el proceso mórbido de mayor importancia y letalidad en esta enfermedad.[48] Dentro del conjunto de inhibidores de la enzima ACE2 también se han propuesto fármacos que tienen actividad anti-oxidante y anti-inflamatoria y que incluso poseen actividad citoprotectora: el ebselén es una molécula relativamente sencilla,[49] aunque presenta la singularidad de tener un átomo de selenio en su estructura. Si bien los estudios clínicos del ebselén (fase II) contemplan el tratamiento de padecimientos relacionados con la audición (enfermedad de Ménière, tinitus, pérdida de la audición), hay estudios preclínicos en desarrollo para el tratamiento de COVID-19.[50] El disulfiram (Antabuse®) es un fármaco que se utiliza para el tratamiento del alcoholismo crónico,[51] que ha mostrado resultados prometedores in sílico e in vitro como inhibidor de SARS-CoV-2 (Figura 4).[52]
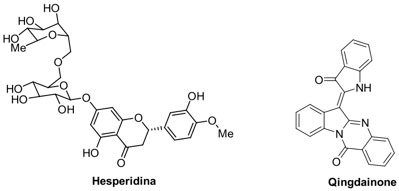
Además de los ejemplos anteriores, hay moléculas pequeñas en fase de investigación que muestran actividad contra SARS-CoV y MERS-CoV y por lo tanto, llaman la atención para el combate de SARS-CoV-2, dada la similitud entre todos ellos. Algunas moléculas pequeñas presentan una actividad antiviral potencial al modelarse, in silico, fenómenos de inhibición de la entrada y fusión del virus.[53] Ejemplos de ellos son algunos flavonoides como la hesperidina[54] y otros productos naturales como la qingdainona (Figura 5).[55]
Inhibidores dirigidos a la proteasa principal de SARS-CoV-2
La proteasa principal de SARS-CoV-2, que es del tipo quimiotripsina o de serina (denominada Mpro o 3CLpro), ha demostrado ser esencial para la replicación de este coronavirus. A diferencia de las proteasas celulares provistas por el anfitrión, reclutadas de manera oportuna por los coronavirus, esta proteasa se encarga de realizar al menos 11 cortes en la poliproteína viral codificada por el genoma de RNA del SARS-CoV-2, necesarios para liberar sus unidades protéicas funcionales.[56] Por lo anterior, esta proteína se ha convertido posiblemente en el blanco principal de las acciones que buscan combatir quimioterapéuticamente al SARS-CoV-2; además, no se conocen proteasas humanas que presenten una especificidad similar, por lo que los inhibidores que tengan como objetivo a la proteasa principal y que además presenten alta selectividad, se espera que sean no-tóxicos [56a].
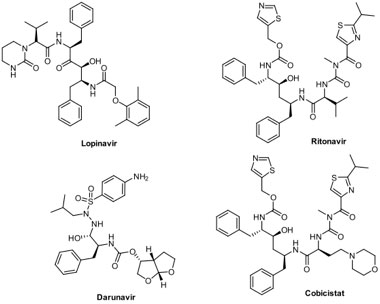
Posiblemente el ejemplo de más resonancia es el coctel antiviral lopinavir/ritonavir (Kaletra®) (Figura 6), cuya combinación se usa en el tratamiento del virus de la inmunodeficiencia humana (VIH)[57] y recientemente demostró su actividad contra 3CLpro.[58] Desafortunadamente hay estudios que son un tanto contradictorios: por un lado se han observado pruebas negativas de ARN de SARS-CoV-2, en muy pocos días, después de haber administrado Kaletra a pacientes con COVID-19;[59] por otro lado, se ha mostrado que Kaletra no disminuye la carga del virus en pacientes con neumonía moderada.[60] En la actualidad, el lopinavir no se recomienda en la terapéutica, ya que no tuvo eficacia en una prueba aleatoria clínica pequeña, y se anticipa que se requiere de una exposición no conveniente para poder lograr la inhibición de SARS-CoV-2.[61] Una alternativa al uso de la mancuerna lopinavir/ritonavir es la combinación, también anti-VIH, darunavir/cobicistat (Prezcobix®), la cual mostró actividad anti-SARS-CoV-2 y actualmente se encuentra en estudio clínico.[62] También hay estudios que muestran falta de conversión negativa, o reversión de la infección, en un periodo de 7 días, comparado con cuidados estándar.[63] Esto contrasta con estudios que indican la inhibición excepcional de SARS-CoV-2 utilizando este fármaco.[64]
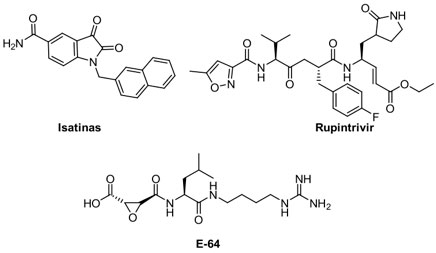
Además de los fármacos arriba mencionados, hay moléculas pequeñas que prometen actividad contra Mpro.[65] Dentro de estas especies podemos encontrar a derivados de isatinas,[66] y un fármaco experimental peptidomimético que es el rupintrivir (AG-7088).[67] Otro ejemplo es la especie E-64(Figura 7), un péptido con actividad inhibitoria promisoria de cisteín-proteasas.[68] Cabe mencionar que el genoma de RNA del SARS-CoV-2 codifica adicionalmente para una proteasa de este último tipo, denominada PLpro, cuya función biológica aún resta por ser descifrada cabalmente.
Inhibidores dirigidos a la ARN polimerasa dependiente de ARN
El objetivo trascendental para interferir en la replicación del genoma viral es la ARN polimerasa dependiente de ARN (RdRp). Estudios han demostrado que la RdRp de SARS-CoV-2 y de SARS-CoV comparten una similitud del 99.1%, así como 96% de identidad en sus aminoácidos.[69] Estas similitudes estructurales y funcionales hacen de RdRp un objetivo prometedor para los antivirales de amplio espectro. El remdesivir (Veklury®) es una monofosforamida análoga de la adenina, desarrollada por la farmacéutica Gilead Sciences, que ha llamado la atención recientemente como opción terapéutica para COVID-19.[70] Este fármaco ha sido desarrollado a lo largo de más de 10 años de investigación, con programas sobre hepatitis C y virus respiratorio sincital.[71] Originalmente fue concebido para el tratamiento de la hepatitis C, y muy recientemente se encontró que tenía potencial para el tratamiento del ébola.[72] El remdesivir es un profármaco, dado que requiere ser fosforilado en el medio celular para convertirse en su forma activa (trifosfato). [72b,73]Dado que el remdesivir se asemeja a un nucleótido del ARN, éste se incorpora en la secuencia de las nuevas cadenas que se sintetizan durante la invasión viral. Esto último trae como consecuencia un mecanismo de inhibición en la síntesis del ARN que se conoce como terminación de cadena interrumpida (delayed chain termination), lo cual ocurre después de algunos residuos posteriores a la incorporación del inhibidor. [72b,68,74] Además, muestra una actividad eficiente contra los coronavirus SARS-CoV y MERS-CoV.[74a] Aunque el remdesivir ha sido el primer fármaco aprobado por la FDA para combatir el SARS-CoV-2,[75] su ruta de síntesis es relativamente larga, lo que repercute en su precio.[76]
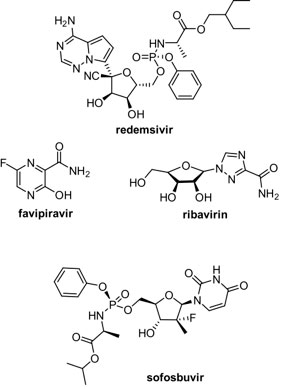 Por otro lado, el favipiravir (Avigan®, Favivir®, FluGuard®) y ribavirin (Tribavirin®, Virazole®, Rebetol®) son dos antivirales utilizados para el tratamiento de diversos tipos de virus de ARN, entre los se encuentran aquelllos que causan la influenza y la fiebre amarilla, para el caso del Favipiravir,[77] mientras que para el combate del virus de la hepatitis C se prescribe el ribavirin (en combinación con el interferón alfa).[78] El favipiravir fue colocado en estudios clínicos dado que mostró actividad in vitro contra COVID-19 y se esperan los resultados de la exposición a este fármaco de pacientes enfermos.[79] Por su parte, el ribavirin en combinación con el interferón alfa-2b mostró actividad contra SARS-CoV.[80] Sin embargo, un estudio reciente con 115 pacientes confirmados con COVID-19 mostró que la terapia con ribavirin no resultó en una mejora de la conversión negativa respecto al grupo control.[81] Aunado a lo anterior, es importante mencionar que estudios in vitro revelan que se requieren concentraciones elevadas de ribavirin, comparadas con aquellas que se necesitan de otros antivirales, para inhibir SARS-CoV-2.[82] Otro medicamento utilizado en combinación con otros fármacos para el tratamiento de la hepatitis C es el sufosbuvir (Sovaldi®),[83] el cual mostró actividad contra la ARN polimerasa dependiente de ARN (RdRp). En un estudio in silico, se mostró que la RdRp del SARS-CoV-2 conserva los residuos de unión a sofosbuvir que se encuentran en el virus de la hepatitis C,[84] lo que lo convierte en un candidato para tratar COVID-19 y que actualmente se encuentra en diversos ensayos clínicos, ya sea como componente único, o en combinación con otros medicamentos.[85]
Por otro lado, el favipiravir (Avigan®, Favivir®, FluGuard®) y ribavirin (Tribavirin®, Virazole®, Rebetol®) son dos antivirales utilizados para el tratamiento de diversos tipos de virus de ARN, entre los se encuentran aquelllos que causan la influenza y la fiebre amarilla, para el caso del Favipiravir,[77] mientras que para el combate del virus de la hepatitis C se prescribe el ribavirin (en combinación con el interferón alfa).[78] El favipiravir fue colocado en estudios clínicos dado que mostró actividad in vitro contra COVID-19 y se esperan los resultados de la exposición a este fármaco de pacientes enfermos.[79] Por su parte, el ribavirin en combinación con el interferón alfa-2b mostró actividad contra SARS-CoV.[80] Sin embargo, un estudio reciente con 115 pacientes confirmados con COVID-19 mostró que la terapia con ribavirin no resultó en una mejora de la conversión negativa respecto al grupo control.[81] Aunado a lo anterior, es importante mencionar que estudios in vitro revelan que se requieren concentraciones elevadas de ribavirin, comparadas con aquellas que se necesitan de otros antivirales, para inhibir SARS-CoV-2.[82] Otro medicamento utilizado en combinación con otros fármacos para el tratamiento de la hepatitis C es el sufosbuvir (Sovaldi®),[83] el cual mostró actividad contra la ARN polimerasa dependiente de ARN (RdRp). En un estudio in silico, se mostró que la RdRp del SARS-CoV-2 conserva los residuos de unión a sofosbuvir que se encuentran en el virus de la hepatitis C,[84] lo que lo convierte en un candidato para tratar COVID-19 y que actualmente se encuentra en diversos ensayos clínicos, ya sea como componente único, o en combinación con otros medicamentos.[85]
Conclusiones
Es prácticamente imposible que exista en el futuro cercano (e inclusive lejano) una solución única para contar con un tratamiento efectivo contra el COVID-19. Los medios de comunicación difunden, prácticamente en tiempo real, los avances de las diferentes agencias, compañías, universidades y centros de investigación sobre las vacunas que prometen dar inmunidad al SARS-CoV-2. La efectividad de esa estrategia depende de lograr un esquema amplio y efectivo de vacunación. Sin embargo, los posibles tratamientos basados en fármacos y moléculas de novo como los que se mencionan a lo largo de este ensayo, pueden representar una alternativa concreta para aquellos casos donde la infección es inminente (donde la inmunidad no se haya adquirido). De vital importancia será validar el reuso de los medicamentos propuestos en poblaciones humanas y virales sujetas a su propia filodinámica, influenciadas constantemente por mutaciones que pueden hacer relevante o inútil cierta molécula terapéutica.[86] Dada la dinámica y urgencia en la generación de conocimiento científico sobre un tema, sin precedentes, este ensayo tuvo la intención de introducir y dimensionar la reutilización de medicamentos en el contexto de la COVID19. Para este fin, presentamos algunos ejemplos que resultaron por demás interesantes y prometedores a nuestra consideración, sin pretender conformar una lista exhaustiva ni definitiva por ser un área que está en pleno desarrollo.
Los autores declaran no tener conflicto de interés de ningún tipo respecto a los temas abordados en el ensayo anterior.
Referencias
[1] a) https://www.who.int/emergencies/diseases/novel-coronavirus-2019 (accesado el 19 de septiembre de 2020). b) https://ourworldindata.org/mortality-risk-COVID (accesado el 17 septiembre de 2020).
[2] a) Zhou, P.; Yang, X. L.; Wang, X. G.; Hu, B.; Zhang, L.; Zhang, W., … & Chen, H. D. A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature, 2020, 579 (7798), 270-273. b) Zhu, N.; Zhang, D.; Wang, W.; Li, X.; Yang, B.; Song, J.; … & Niu, P. A novel coronavirus from patients with pneumonia in China, 2019. New Engl. J. Medicine. 2020, 382, 727-733.
[3] Coronaviridae Study Group of the International Committee on Taxonomy of Viruses. The species Severe acute respiratory syndrome-related coronavirus: classifying 2019-nCoV and naming it SARS-CoV-2. Nature Microbiol. 2020, 5 (4), 536.
[4] Naqvi, A. A. T.; Fatima, K.; Mohammad, T.; Fatima, U.; Singh, I. K.; Singh, A.; Atif, S. M.; Hariprasad, G.; Hasan, G. M.; Hassan, M. I. Insights into SARS-CoV-2 Genome, Structure, Evolution, Pathogenesis and Therapies: Structural Genomics Approach. Biochim. Biophys. Acta – Mol. Basis Dis. 2020, 1866 (10), 165878.
[5] Se considera que tanto SARS-CoV-2 y SARS-CoV pertenecen a la misma especie (SARSr-CoV), dado que las secuencias de aminoácidos de siete dominios de replicasa en el gen de mayor tamaño (ORF1ab) que fueron usados para la clasificación de las especies CoV, fueron un 94.4% idénticos entre ambos virus. Ver ref. 2a.
[6] Petersen, E.; Koopmans, M.; Go, U.; Hamer, D. H.; Petrosillo, N.; Castelli, F.; … & Simonsen, L. Comparing SARS-CoV-2 with SARS-CoV and influenza pandemics. Lancet Infect. Dis. 2020, 20, e238-e244.
[7] Datos obtenidos de la Organización Mundial de la Salud (WHO por sus siglas en inglés): https://www.who.int/csr/sars/country/table2003_09_23/en/, https://www.who.int/emergencies/mers-cov/en/, https://www.worldometers.info/coronavirus/, https://COVID19.who.int
[8] NIH por las siglas en inglés de National Institutes of Health.
[9] Applied filters: Recruiting, Enrolling by Invitation, Active, Not Recruiting and completed Studies for COVID-19. https://clinicaltrials.gov/ (accesado en septiembre 14, 2020).
[10] Matheson, N. J.; Lehner, P. J. How does SARS-CoV-2 cause COVID-19? Science, 2020, 369 (6503), 510-511.
[11] Alanagreh, L. A.; Alzoughool, F.; Atoum, M. The human coronavirus disease COVID-19: its origin, characteristics, and insights into potential drugs and its mechanisms. Pathogens, 2020, 9 (5), 331-342
[12] La variante G614 del SARS-CoV-2 desplazó a la forma D614 del escenario mundial desde los meses de abril-mayo de 2020. Esta mutación da lugar a mayores cargas virales en pacientes y por lo tanto da lugar a cuadros más infecciosos. Ver: a) Grubaugh, N. D.; Hanage, W. P.; Rasmussen, A. L. Making Sense of Mutation: What D614G Means for the COVID-19 Pandemic Remains Unclear. Cell 2020, 182 (4), 794–795. b) Korber, B.; Fischer, W. M.; Gnanakaran, S.; Yoon, H.; Theiler, J.; Abfalterer, W.; … & Hastie, K. M. Tracking changes in SARS-CoV-2 Spike: evidence that D614G increases infectivity of the COVID-19 virus. Cell. 2020, 182, 1
[13] https://www.who.int/publications/m/item/draft-landscape-of-COVID-19-candidate-vaccines (accesado el 21 de septiembre de 2020)
[14] https://www.businessinsider.com/COVID-vaccine-wont-reach-everyone-for-four-years-serum-institute-2020-9?r=MX&IR=T (accesado el 21 de septiembre de 2020)
[15] Los términos más apropiados que se utilizan en el idioma inglés son “small-molecule repurposing”, “drug repositioning” o “drug-reprofiling”, que describen al proceso que busca nuevas aplicaciones para un fármaco existente, del cual no existía conocimiento o estudio y por lo tanto no se prescriben para tal fin. Ver: Poroikov, V.; Druzhilovskiy, D. Drug Repositioning: New Opportunities for Older Drugs. En In Silico Drug Design; Elsevier, 2019; pp 3–17.
[16] Chevrette, M. G.; Gutiérrez-García, K.; Selem-Mojica, N.; Aguilar-Martínez, C.; Yañez-Olvera, A.; Ramos-Aboites, H. E.; Hoskisson, P. A.; Barona-Gómez, F. Evolutionary Dynamics of Natural Product Biosynthesis in Bacteria. Nat. Prod. Rep. 2020, 37 (4), 566–599.
[17] a) Gutiérrez-García, K.; Neira-González, A.; Pérez-Gutiérrez, R. M.; Granados-Ramírez, G.; Zarraga, R.; Wrobel, K.; Barona-Gómez, F.; Flores-Cotera, L. B. Phylogenomics of 2,4-Diacetylphloroglucinol-Producing Pseudomonas and Novel Antiglycation Endophytes from Piper Auritum. J. Nat. Prod. 2017, 80 (7), 1955–1963. b) Kusumaningsih, T.; Prasetyo, W. E.; Firdaus, M. A Greatly Improved Procedure for the Synthesis of an Antibiotic-Drug Candidate 2,4-Diacetylphloroglucinol over Silica Sulphuric Acid Catalyst: Multivariate Optimisation and Environmental Assessment Protocol Comparison by Metrics. RSC Adv. 2020, 10 (53), 31824–31837.
[18] Existen excelentes artículos in extenso que el lector puede consultar para tener un panorama mayor sobre el tema aquí abordado: a) De Savi, C.; Hughes, D. L.; Kvaerno, L. Quest for a COVID-19 Cure by Repurposing Small-Molecule Drugs: Mechanism of Action, Clinical Development, Synthesis at Scale, and Outlook for Supply. Org. Process Res. Dev. 2020, 24 (6), 940–976. b) Ahidjo, B. A.; Loe, M. W. C.; Ng, Y. L.; Mok, C. K.; Chu, J. J. H. Current Perspective of Antiviral Strategies against COVID-19. ACS Infect. Dis. 2020, 6 (7), 1624–1634.
[19] Yan, R.; Zhang, Y.; Li, Y.; Xia, L.; Guo, Y.; Zhou, Q. Structural basis for the recognition of SARS-CoV-2 by full-length human ACE2. Science, 2020, 367(6485), 1444-1448.
[20] a) Hoffmann, M.; Kleine-Weber, H.; Schroeder, S.; Krüger, N.; Herrler, T.; Erichsen, S.; … & Müller, M. A. SARS-CoV-2 cell entry depends on ACE2 and TMPRSS2 and is blocked by a clinically proven protease inhibitor. Cell. 2020, 181(2), 271-280; b) Hoffmann, M.; Kleine-Weber, H.; Pöhlmann, S. A multibasic cleavage site in the spike protein of SARS-CoV-2 is essential for infection of human lung cells. Molecular Cell. 2020, 78(4), 779-784.
[21] Además de tratar la presión alta, se usa como tratamiento renal en pacientes con diabetes tipo 2, proteinuira y microalbuminuria.
[22] Gurwitz, D. Angiotensin receptor blockers as tentative SARS‐CoV‐2 therapeutics. Drug Develop. Res. 2020, 81, 537-540.
[23] a) Haviernik, J.; Štefánik, M.; Fojtíková, M.; Kali, S.; Tordo, N.; Rudolf, I.; Hubálek, Z.; Eyer, L.; Ruzek, D. Arbidol (Umifenovir): A Broad-Spectrum Antiviral Drug That Inhibits Medically Important Arthropod-Borne Flaviviruses. Viruses 2018, 10 (4), 1–8.
[24] Blaising, J.; Polyak, S. J.; Pécheur, E. I. Arbidol as a Broad-Spectrum Antiviral: An Update. Antiviral Res. 2014, 107 (1), 84–94.
[25] https://www.fda.gov/drugs/information-drug-class/influenza-flu-antiviral-drugs-and-related-information#ApprovedDrugs (accesado el 23 de septiembre de 2020).
[26] https://clinicaltrials.gov/ct2/show/NCT04350684 (accesado el 23 de septiembre de 2020).
[27] a) Huang, D.; Yu, H.; Wang, T.; Yang, H.; Yao, R.; Liang, Z. Efficacy and safety of umifenovir for coronavirus disease 2019 (COVID‐19): A systematic review and meta‐analysis. J. Med. Virol. 2020, 1-10. b) Lian, N.; Xie, H.; Lin, S.; Huang, J.; Zhao, J.; Lin, Q. Umifenovir Treatment Is Not Associated with Improved Outcomes in Patients with Coronavirus Disease 2019: A Retrospective Study. Clin. Microbiol. Infect. 2020, 26 (7), 917–921.
[28] Hoffmann, M.; Schroeder, S.; Kleine-Weber, H.; Müller, M. A.; Drosten, C.; Pöhlmann, S. Nafamostat mesylate blocks activation of SARS-CoV-2: New treatment option for COVID-19. Antimicrob. Agents Chemother. 2020, 64(6), e00754-20.
[29] http://www.shijiebiaopin.net/upload/product/201272318373223.PDF (accesado el 23 de septiembre de 2020).
[30] Maruyama, Y.; Yoshida, H.; Uchino, S.; Yokoyama, K.; Yamamoto, H.; Takinami, M.; Hosoya, T. Nafamostat Mesilate as an Anticoagulant during Continuous Veno-Venous Hemodialysis: A Three-Year Retrospective Cohort Study. Int. J. Artif. Organs 2011, 34 (7), 571–576..
[31] https://www.u-tokyo.ac.jp/content/400140399.pdf (accesado el 23 de septiembre de 2020).
[32] https://clinicaltrials.gov/ct2/show/NCT04418128 (accesado el 23 de septiembre de 2020).
[33] Ko, M.; Jeon, S.; Ryu, W. S.; Kim, S. Comparative analysis of antiviral efficacy of FDA-approved drugs against SARS-CoV-2 in human lung cells: Nafamostat is the most potent antiviral drug candidate. J. Med. Chem. 2020, 1-6.
[34] a) https://pulsenews.co.kr/view.php?year=2020&no=953191 (accesado el 23 de septiembre de 2020). b) https://elfinanciero.com.mx/cdmx/se-probaran-medicamentos-contra-COVID-19-en-cdmx (accesado el 23 de septiembre de 2020).
[35] a) https://www.fda.gov/drugs/drug-safety-and-availability/la-fda-advierte-en-contra-del-uso-de-la-hidroxicloroquina-o-la-cloroquina-para-el-tratamiento-del (accesado el 23 de septiembre de 2020). b)
[36] https://www.elsevier.es/es-revista-medicina-integral-63-articulo-antipaludicos-el-tratamiento-enfermedades-autoinmunes-13044040 (accesado el 23 de septiembre de 2020).
[37] Fantini, J., Di Scala, C.; Chahinian, H.; Yahi, N. Structural and molecular modeling studies reveal a new mechanism of action of chloroquine and hydroxychloroquine against SARS-CoV-2 infection. Int. J. Antimicrob. Agents, 2020, 55(5), 105960.
[38] Tang, D., Li, J.; Zhang, R.; Kang, R.; Klionsky, D. J. Chloroquine in fighting COVID-19: good, bad, or both?. Autophagy, 2020, 1-3.
[39] https://www.who.int/news-room/q-a-detail/q-a-hydroxychloroquine-and-COVID-19 (accesado el 23 de septiembre de 2020).
[40] https://www.fda.gov/news-events/press-announcements/coronavirus-COVID-19-update-fda-revokes-emergency-use-authorization-chloroquine-and (accesado el 23 de septiembre de 2020).
[41] Es muy probable que el lector ha estado al tanto respecto a los mensajes contrapuestos entre el presidente de los EE. UU. Donald Trump, y el Dr. Antony Fauci, el Director del Instituto Nacional de Alergias y Enfermedades Infecciosas del mismo país, ver: a) https://abcnews.go.com/Health/timeline-tracking-trump-alongside-scientific-developments-hydroxychloroquine/story?id=72170553 y b) https://www.cnbc.com/2020/07/29/dr-fauci-says-all-the-valid-scientific-data-shows-hydroxychloroquine-isnt-effective-in-treating-coronavirus.html (ambas accesadas el 4 de octubre de 2020). Aunque el presidente Trump ha abogado de manera intensiva por el uso de la HCQ para tratar COVID-19, al parecer al momento de esta publicación, aún no está claro si está utilizándola para tratar su infección. Ver también: https://www.newsweek.com/hydroxychloroquine-doctor-furious-donald-trump-took-experimental-antibody-stupidness-1536161 (accesado el 4 de octubre de 2020).
[42] https://clinicaltrials.gov/ct2/show/NCT04359095 (accesado el 19 de septiembre de 2020).
[43] Este fármaco inhibe ciertas kinasas involucradas es procesos de endocitosis, lo cuál está íntimamente relacionado a la fusión viral. Ver: Stebbing, J.; Phelan, A.; Griffin, I.; Tucker, C.; Oechsle, O.; Smith, D.; Richardson, P. COVID-19: Combining Antiviral and Anti-Inflammatory Treatments. Lancet Infect. Dis. 2020, 20 (4), 400–402.
[44] Taylor, P. C.; Keystone, E. C.; van der Heijde, D.; Weinblatt, M. E.; del Carmen Morales, L.; Reyes Gonzaga, J.; Yakushin, S.; Ishii, T.; Emoto, K.; Beattie, S.; Arora, V.; Gaich, C.; Rooney, T.; Schlichting, D.; Macias, W. L.; de Bono, S.; Tanaka, Y. Baricitinib versus Placebo or Adalimumab in Rheumatoid Arthritis. N. Engl. J. Med. 2017, 376 (7), 652–662.
[45] a) Lenz, H.-J.; Richardson, P.; Stebbing, J. The Emergence of Baricitinib: A Story of Tortoises Versus Hares. Clin. Infect. Dis. 2020 (preprint). https://doi.org/10.1093/cid/ciaa940. (accesado el 21 de septiembre de 2020). b) https://clinicaltrials.gov/ct2/show/NCT04421027 (accesado el 23 de septiembre de 2020). c) https://clinicaltrials.gov/ct2/show/NCT04320277 (accesado el 23 de septiembre de 2020).
[46] Slobodnick, A.; Shah, B.; Krasnokutsky, S.; Pillinger, M. H. Update on Colchicine, 2017. Rheumatology (Oxford). 2018, 57 (1), i4–i11. https://doi.org/10.1093/rheumatology/kex453.
[47] Parra-Medina, R.; Sarmiento-Monroy, J. C.; Rojas-Villarraga, A.; Garavito, E.; Montealegre-Gómez, G.; Gómez-López, A. Colchicine as a possible therapeutic option in COVID-19 infection. Clin. Rheumatol. 2020, 39(8), 2485-2486.
[48] https://www.manualmoderno.com/blog/post/tipificacion-del-sdra-por-COVID-19/ (accesado el 23 de septiembre de 2020)
[49] Schewe, T. Molecular actions of ebselen—an antiinflammatory antioxidant. General Pharmacology: The Vascular System, 1995, 26(6), 1153-1169.
[50] https://adisinsight.springer.com/drugs/800000622 (accesado el 23 de septiembre de 2020)
[51] https://medlineplus.gov/spanish/druginfo/meds/a682602-es.html (accesado el 23 de septiembre de 2020)
[52] Trezza, A.; Iovinelli, D.; Santucci, A.; Prischi, F.; Spiga, O. An integrated drug repurposing strategy for the rapid identification of potential SARS-CoV-2 viral inhibitors. Sci. Rep. 2020, 10(1), 1-8.
[53] Qiao, B.; Olvera de la Cruz, M. Enhanced Binding of SARS-CoV-2 Spike Protein to Receptor by Distal Polybasic Cleavage Sites. ACS nano, 2020, 14(8), 10616-10623.
[54] Wu, C., Liu, Y.; Yang, Y.; Zhang, P.; Zhong, W.; Wang, Y.; … & Zheng, M. Analysis of therapeutic targets for SARS-CoV-2 and discovery of potential drugs by computational methods. Acta Pharm. Sinica B. 2020, 10(5), 766-788.
[55] Vivek-Ananth, R. P.; Rana, A.; Rajan, N.; Biswal, H. S.; Samal, A. In silico identification of potential natural product inhibitors of human proteases key to SARS-CoV-2 infection. Molecules. 2020, 25, 3822.
[56] a) Zhang, L.; Lin, D.; Sun, X.; Curth, U.; Drosten, C.; Sauerhering, L.; … & Hilgenfeld, R. Crystal structure of SARS-CoV-2 main protease provides a basis for design of improved α-ketoamide inhibitors. Science, 2020, 368(6489), 409-412; b) Jin, Z.; Du, X.; Xu, Y.; Deng, Y.; Liu, M.; Zhao, Y.; … Duan, Y. Structure of M pro from SARS-CoV-2 and discovery of its inhibitors. Nature, 2020, 582, 1-5.
[57] World Health Organization. (2019). Executive summary: the selection and use of essential medicines 2019: report of the 22nd WHO Expert Committee on the selection and use of essential medicines: WHO Headquarters, Geneva, 1-5 April 2019. World Health Organization. https://apps.who.int/iris/handle/10665/325773 (accesado el 23 de septiembre de 2020).
[58] a) Sisay, M. 3CLpro inhibitors as a potential therapeutic option for COVID-19: Available evidence and ongoing clinical trials. Pharmacol. Res. 2020, 156, 104779; b) Choy, K. T.; Wong, A. Y. L.; Kaewpreedee, P.; Sia, S. F.; Chen, D.; Hui, K. P. Y.; … & Peiris, M. Remdesivir, lopinavir, emetine, and homoharringtonine inhibit SARS-CoV-2 replication in vitro. Antiviral Res. 2020, 104786.
[59] Lim, J.; Jeon, S.; Shin, H.Y.; Kim, M.J.; … & Lee, B.; Park, S.J. Case of the index patient who caused tertiary transmission of COVID-19 Infection in Korea: The Application of Lopinavir/Ritonavir for the Treatment of COVID-19 Infected Pneumonia Monitored by Quantitative RT-PCR. J. Korean Med. Sci. 2020, 35, e79
[60] Cheng, C. Y.; Lee, Y. L.; Chen, C. P.; Lin, Y. C.; Liu, C. E.; Liao, C. H.; Cheng, S. H. Lopinavir/ritonavir did not shorten the duration of SARS CoV-2 shedding in patients with mild pneumonia in Taiwan. J. Microbiol. Immunol. Infec. 2020, 53, 488–492.
[61] Schoergenhofer, C.; Jilma, B.; Stimpfl, T.; Karolyi, M.; Zoufaly, A. Pharmacokinetics of Lopinavir and Ritonavir in Patients Hospitalized With Coronavirus Disease 2019 (COVID-19). Ann. Intern. Med. 2020,
[62] https://clinicaltrials.gov/ct2/show/NCT04425382 (accesado el 20 de septiembre de 2020).
[63] Chen, J.; Xia, L.; Liu, L.; Xu, Q.; Ling, Y.; Huang, D.; Huang, W.; Song, S.; Xu, S.; Shen, Y.; Lu, H. Antiviral Activity and Safety of Darunavir/Cobicistat for the Treatment of COVID-19. Open Forum Infect. Dis. 2020, 7 (7), 1–5.
[64] Ver referencias incluidas en: Dong, L.; Hu, S.; Gao, J. Discovering Drugs to Treat Coronavirus Disease 2019 (COVID-19). Drug Discov. Ther. 2020, 14 (1), 58–60.
[65] ul Qamar, M. T.; Alqahtani, S. M.; Alamri, M. A.; Chen, L. L. Structural basis of SARS-CoV-2 3CLpro and anti-COVID-19 drug discovery from medicinal plants. J. Pharm. Anal. 2020, 10(4), 313-319.
[66] Liu, P.; Liu, H.; Sun, Q.; Liang, H.; Li, C.; Deng, X.; … & Lai, L. Potent inhibitors of SARS-CoV-2 3C-like protease derived from N-substituted isatin compounds. Eur. J. Med. Chem. 2020, 206, 112702.
[67] Anand, K.; Ziebuhr, J.; Wadhwani, P.; Mesters, J. R.; Hilgenfeld, R. Coronavirus main proteinase (3CLpro) structure: basis for design of anti-SARS drugs. Science, 2003, 300(5626), 1763-1767; b) Hoffman, R.; Kania, R. S.; Brothers, M. A.; Davies, J. F.; Ferre, R. A.; Gajiwala, K. S.; … & Lockner, J. W. The Discovery of Ketone-Based Covalent Inhibitors of Coronavirus 3CL Proteases for the Potential Therapeutic Treatment of COVID-19. 2020.
[68] Hanada, K.; Tamai, M.; Morimoto, S.; Adachi, T.; Ohmura, S.; Sawada, J.; Tanaka, I. Inhibitory Activities of E–64 Derivatives on Papain. Agric. Biol. Chem. 1978, 42(3), 537-541; b) Schiefer, I. T.; Tapadar, S.; Litosh, V.; Siklos, M.; Scism, R.; Wijewickrama, G. T.; … & Fa’, M. Design, synthesis, and optimization of novel epoxide incorporating peptidomimetics as selective calpain inhibitors. J. Med. Chem. 2013, 56(15), 6054-6068.
[69] Sheahan, T. P., Sims, A. C., Zhou, S., Graham, R. L., Pruijssers, A. J., Agostini, M. L., … & Chappell, J. D. An orally bioavailable broad-spectrum antiviral inhibits SARS-CoV-2 in human airway epithelial cell cultures and multiple coronaviruses in mice. Science Transl. Med. 2020 12(541).
[70] Al-Tawfiq, J. A.; Al-Homoud, A. H.; Memish, Z. A. Remdesivir as a Possible Therapeutic Option for the COVID-19. Travel Med. Infect. Dis. 2020, 34 (March), 101615.
[71] a) https://www.gilead.com/-/media/gilead-corporate/files/pdfs/COVID-19/gilead_rdv-development-fact-sheet-2020.pdf (accesado el 23 de septiembre de 2020). b) https://www.gilead.com/news-and-press/press-room/press-releases/2014/5/gileads-investigational-gs5806-reduces-viral-load-and-clinical-symptoms-in-phase-2-respiratory-syncytial-virus-rsv-challenge-study-in-adults (accesado el 23 de septiembre de 2020).
[72] a) https://www.gilead.com/-/media/gilead-corporate/files/pdfs/COVID-19/gilead_rdv-development-fact-sheet -2020.pdf; b) Warren, T. K.; Jordan, R.; Lo, M. K.; Ray, A. S.; Mackman, R. L.; Soloveva, V.; … & Larson, N. Therapeutic efficacy of the small molecule GS-5734 against Ebola virus in rhesus monkeys. Nature, 2016, 531(7594), 381-385.
[73] Tchesnokov, E. P.; Feng, J. Y.; Porter, D. P.; Götte, M. Mechanism of inhibition of Ebola virus RNA-dependent RNA polymerase by remdesivir. Viruses, 2019, 11(4), 326
[74] a) Gordon, C. J.; Tchesnokov, E. P.; Feng, J. Y.; Porter, D. P.; Götte, M. The antiviral compound remdesivir potently inhibits RNA-dependent RNA polymerase from Middle East respiratory syndrome coronavirus. J. Biol. Chem. 2020, 295(15), 4773-4779; ; b) Saha, A.; Sharma, A. R.; Bhattacharya, M.; Sharma, G.; Lee, S. S.; Chakraborty, C. Probable Molecular Mechanism of Remdesivir for the Treatment of COVID-19: Need to Know More. Pharmacol. Res. 2020, 158, 104904.
[75] https://www.fda.gov/news-events/press-announcements/coronavirus-COVID-19-update-fda-issues-emergency-use-authorization-potential-COVID-19-treatment (accesado en el 22 de septiembre de 2020). b) https://www.fda.gov/media/137566/download (accesado el 22 de septiembre 22 de 2020).
[76] https://www.gilead.com/purpose/advancing-global-health/COVID-19/working-to-supply-remdesivir-for-COVID-19
[77] Furuta, Y.; Gowen, B. B.; Takahashi, K.; Shiraki, K.; Smee, D. F.; Barnard, D. L. Favipiravir (T-705), a novel viral RNA polymerase inhibitor. Antiviral research, 2013, 100(2), 446-454.
[78] https://www.drugs.com/monograph/ribavirin.html (accesado el 23 de septiembre de 2020).
[79] a) https://clinicaltrials.gov/ct2/show/NCT04402203; b) https://clinicaltrials.gov/ct2/show/NCT04359615 (accesados el 23 de septiembre de 2020).
[80] Falzarano, D.; De Wit, E.; Martellaro, C., Callison, J.; Munster, V. J.; Feldmann, H. Inhibition of novel β coronavirus replication by a combination of interferon-α2b and ribavirin. Sci. Rep. 2013, 3, 1686.
[81] Tong, S., Su, Y.; Yu, Y.; Wu, C.; Chen, J.; Wang, S.; Jiang, J. Ribavirin therapy for severe COVID-19: a retrospective cohort study. Int. J. Antimicrob. Agents. 2020, 56(3), 106114.
[82] Wang, M.; Cao, R.; Zhang, L.; Yang, X.; Liu, J.; Xu, M.; … & Xiao, G. Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019-nCoV) in vitro. Cell Res. 2020, 30(3), 269-271.
[83] Gane, E. J., Stedman, C. A.; Hyland, R. H.; Ding, X.; Svarovskaia, E.; Symonds, W. T., … & Berrey, M. M. Nucleotide polymerase inhibitor sofosbuvir plus ribavirin for hepatitis C. New Engl. J. Med. 2013, 368(1), 34-44; b) https://medlineplus.gov/spanish/druginfo/meds/a614014-es.html (accesado el 20 de septiembre de 2020).
[84] Jácome, R.; Campillo-Balderas, J. A., de León, S. P., Becerra, A.; Lazcano, A. Sofosbuvir as a potential alternative to treat the SARS-CoV-2 epidemic. Sci. Rep. 2020, 10(1), 1-5.
[85] a) https://clinicaltrials.gov/ct2/show/NCT04460443 (accesado el 23 de septiembre de 2020). b) https://clinicaltrials.gov/ct2/show/NCT04497649 (accesado el 23 de septiembre de 2020).
[86] El 16 de octubre de 2020, la Organización Mundial de la Salud (WHO) publicó estudios preliminares de la iniciativa “Solidarity”, que consistió en la aplicación de pruebas clínicas aleatorizadas en 12,000 pacientes de 500 instalaciones hospitalarias en más de 30 países. Desafortunadamente, estos resultados interinos encontraron que los tratamientos con remdesivir, hidroxicloroquina, lopinavir/ritonavir e interferón, tenían poco o nulo efecto en la mortalidad, prevención de uso de ventilador, o duración de estancia hospitalaria en los pacientes enfermos con COVID-19 severo. https://www.who.int/emergencies/diseases/novel-coronavirus-2019/global-research-on-novel-coronavirus-2019-ncov/solidarity-clinical-trial-for-covid-19-treatments (accesado el 18 de octubre de 2020).








Comentarios no permitidos.