En los últimos veinte años, los avances científicos en farmacología han permitido mejorar las intervenciones terapéuticas mediante el uso de técnicas enfocadas en la utilización de moléculas pequeñas de ácido ribonucleico o ARN de interferencia (siRNAs, small-interfering RNAs), capaces de bloquear de manera temporal la expresión de algunos genes (efecto knockdown). Esta característica tiene aplicación directa en la terapia génica pues puede controlarse el funcionamiento del genoma y regular la expresión de algunos genes que participan en el desarrollo de ciertas patologías como el cáncer, diabetes o hipertensión que afectan a una gran parte de la población tanto nacional como mundial. Esta regulación ocurre en distintos ámbitos como en el procesamiento del ARN, en la estructura de la cromatina, afectando la estabilidad del ARN, inhibiendo el proceso de transcripción y traducción e incluso interviniendo en la segregación cromosómica.
Origen de los siRNAs
En 1998 se describieron por primera vez secuencias de ARN de 38 nucleótidos, a los que se les identificó como ARN de interferencia de doble cadena (dsRNA, por sus siglas en inglés) en el nematodo Caenorhabditis elegans (Fire, et al 1998). Posteriormente se reportaron en distintos organismos eucariontes, y se supo que podían producir un silenciamiento génico con gran especificidad, aunque con un mecanismo difícil de entender y de lograr; posteriormente se identificaron secuencias más pequeñas de aproximadamente 21 nucleótidos que se originaron a partir de dsRNA, a los cuales se les nombró como siRNAs, y pudieron utilizarse para inhibir secuencias específicas de algunos genes (Elbashir, Et al, 2001). El postulado central de la biología molecular dice que el ADN se transcribe a ARN y a partir de éste, se generan proteínas. De aquí, un siRNA tiene la capacidad de bloquear el ARN mensajero (bloqueo post-transcripcional), evitando que se produzca la proteína de la unidad funcional del gen cuya expresión ha sido inhibida de manera temporal. En teoría, se podría bloquear cualquier ARN mensajero que codifique para una proteína, situación que resulta prometedora debido a que se podrían frenar enfermedades de origen genético, o bien, emplear nuevos fármacos para el tratamiento de padecimientos crónicos.
¿Cómo actúa un siRNA?
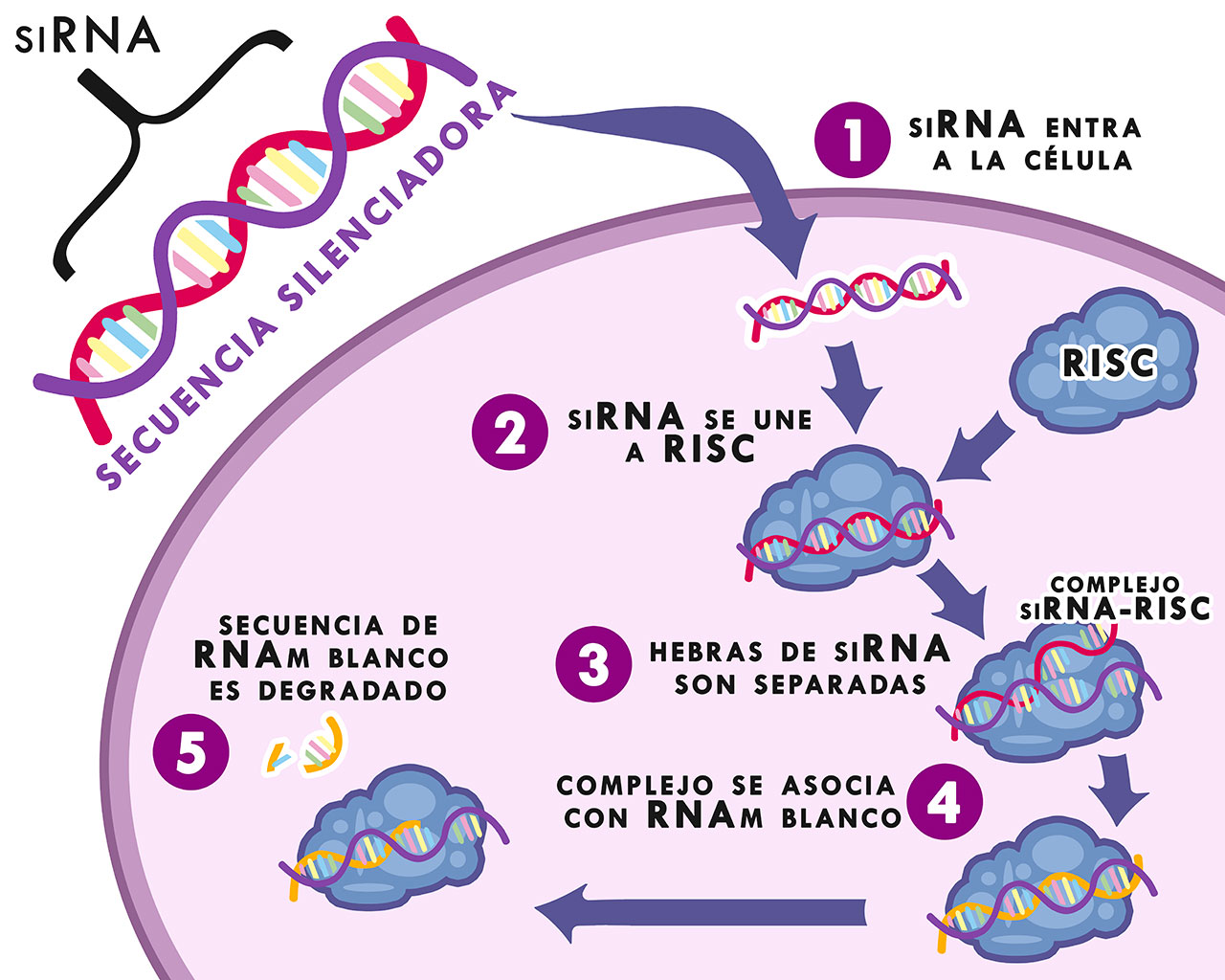
Cuando el siRNA es introducido al citoplasma de la célula, se incorpora a un complejo proteico conocido como Complejo Silenciador Inductor de RNA o RISC (por sus siglas en inglés). Uno de sus componentes principales es la proteína Argonauta o Ago que escinde la hebra pasajera de la doble cadena del siRNA, activando el RISC. La hebra restante lo guía a su mRNA homólogo, que deriva en la escisión catalítica de la secuencia blanco (véase figura 1) (Carthew et al, 2009).
Retos en el uso de siRNAs en la terapéutica
Uno de los principales retos para aprovechar el alto potencial terapéutico de los siRNAs es lograr un sistema de transporte y entrega eficiente que permita su llegada al sitio blanco, ya que un siRNA por sí sólo es degradado rápidamente en la circulación por enzimas como endonucleasas y exonucleasas, que disminuyen su efectividad. Para posibilitar que las secuencias cortas de ARN tengan estabilidad biológica, se han diseñado distintos tipos de transportadores, los cuales funcionan ensamblando el siRNA en un complejo molecular que se encarga de que el siRNA llegue a la secuencia blanco que será bloqueada de manera temporal. Las dos principales categorías son:
- Vectores virales. Son virus modificados que funcionan como vehículo para introducir las cadenas cortas de ácidos nucleicos en una célula.
- Vectores no virales. Son todas aquellas técnicas que permiten introducir el material genético a las células mediante métodos químicos o físicos (Rozalen et al, 2003). Dentro de este grupo existen sistemas de transporte y entrega basados en polímeros, en lípidos y en péptidos, además de sistemas combinados en donde se conjugan los tres (liposoma-péptido, liposoma-polímero, entre otros).
Recientemente se han usado de manera exitosa distintos siRNAs en modelos experimentales de cáncer de ovario, pulmón, de mama, entre otros, con el objetivo de analizar el efecto del silenciamiento en ratones y así generar tratamientos alternativos que podrían ser empleados en ensayos clínicos. Sin embargo, la selección del siRNA adecuado requiere un trabajo arduo y extenso puesto que algunos pueden tener como blanco distintas regiones de la misma secuencia de mRNA, y cada uno tiene una eficacia diferente con baja funcionalidad en células de mamíferos.
Otro desafío en la utilización de siRNAs, es que no son tan específicos como se creía inicialmente, sino que muchos tienen un efecto silenciador no deseado en genes distintos al gen objetivo (off-target). Esto se debe a la homología parcial en las secuencias blanco, especialmente en el extremo 3´, por lo que es necesario un buen diseño con el fin de formar secuencias más específicas; que puede alcanzarse mediante el uso de la bioinformática, que permite obtener siRNAs con afinidad por diferentes segmentos del mRNA blanco; debe considerarse aquel que tenga mayor probabilidad de unirse en una región accesible y con la mayor especificidad (Wall & Shi, 2003).
Efecto de los siRNAs en enfermedades inflamatorias y cáncer
El Factor de Necrosis Tumoral o TNF-α (por sus siglas en inglés) es un elemento importante en la patogénesis de un sinnúmero de enfermedades inflamatorias e inmunológicas. Cuando el TNF-α se une a su receptor promueve la activación del factor de transcripción NF-κB (factor nuclear potenciador de las cadenas ligeras kappa de las células B activadas) que promueve la producción de moléculas inflamatorias, por lo que el TNF-α puede ser un blanco clave para el silenciamiento. En 2003, Sørensen y colaboradores administraron siRNAs contra TNF-α a ratones y demostraron un efecto protector contra la sepsis inducida por lipopolisacáridos bacterianos (Sørensen, D.R. et al., 2003).
Por otro lado, se han realizado estudios con siRNAs contra la proteína de superficie celular denominada Fas en la Falla Hepática Aguda inducida por virus o por rechazo a trasplante hepático, en la cual se mostró cierta protección en ratones inyectados con estos siRNAs anti Fas, efecto que duró alrededor de 10 días, evidenciando su estabilidad (Song, et al, 2003). En esta enfermedad también se probó un siRNA contra la caspasa 8, molécula que interviene en la muerte celular. Se observó una disminución del daño hepático desencadenado por la activación de Fas en los ratones en los que se silenció caspasa 8 (Zender, et al, 2003).
Respecto al uso de siRNAs en cáncer, se ha experimentado con distintos blancos para disminuir el efecto de algunos genes encargados de aquellas acciones características del cáncer como la proliferación, invasión, metástasis, angiogénesis, entre otras. Se reporta el uso de siRNAs contra el Factor de Crecimiento Vascular Endotelial o VEGF en ensayos clínicos, resultando en actividad antitumoral, bloqueando a su ARN mensajero (Tanamero, et al., 2013).
Además de la evidencia creciente el uso de estos pequeños ARN de interferencia en la terapéutica, son necesarios más estudios para obtener y demostrar la seguridad y eficacia requerida para emplearlos como parte del tratamiento. Con el fin de que se apruebe su uso en la población general, se debe encontrar un medio de transporte que sea compatible, biodegradable y seguro.
Referencias
Carthew, R. W., & Sontheimer, E. J. (2009). Origins and mechanisms of miRNAs and siRNAs. Cell, 136(4), 642-655.
Elbashir, S.M. et al. (2001) Duplexes of 21-nucleotide RNAs mediate RNA interference in cultured mammalian cells. Nature 411, 494–498.
Fire, A. et al. (1998) Potent and specific genetic interference by doublestranded RNA in Caenorhabditis elegans. Nature 391, 806–811.
Rozalén, J, Valentín, C. & Jordán, J. (2009) Terapia génica. Vectores de expresión. Offarm vol.22. Núm. 8. 102-108.
Song, E.et al.(2003) RNA interference targeting Fas protects micefrom fulminate hepatitis.Nat. Med.9, 347 – 351
Sørensen, D.R.et al.(2003) Gene silencing by systemic delivery ofsynthetic siRNAs in adult mice.J. Mol. Biol.327, 761 – 766
Tabernero J, Shapiro GI, LoRusso PM, et al. First-in-humans trial of an RNA interference therapeutic targeting VEGF and KSP in cancer patients with liver involvement. Cancer Discov. 2013;3
(4):406LP–417. doi:10.1158/2159-8290.CD-12-0429
Wall, N. R., & Shi, Y. (2003). Smaill RNA: can RNA interference be exploited for therapy. Lancet 362: 1401-03.
Zender, L.et al.(2003) Caspase 8 small interfering RNA prevents acuteliver failure in mice.Proc. Natl. Acad. Sci. U. S. A.100, 7797 – 7802