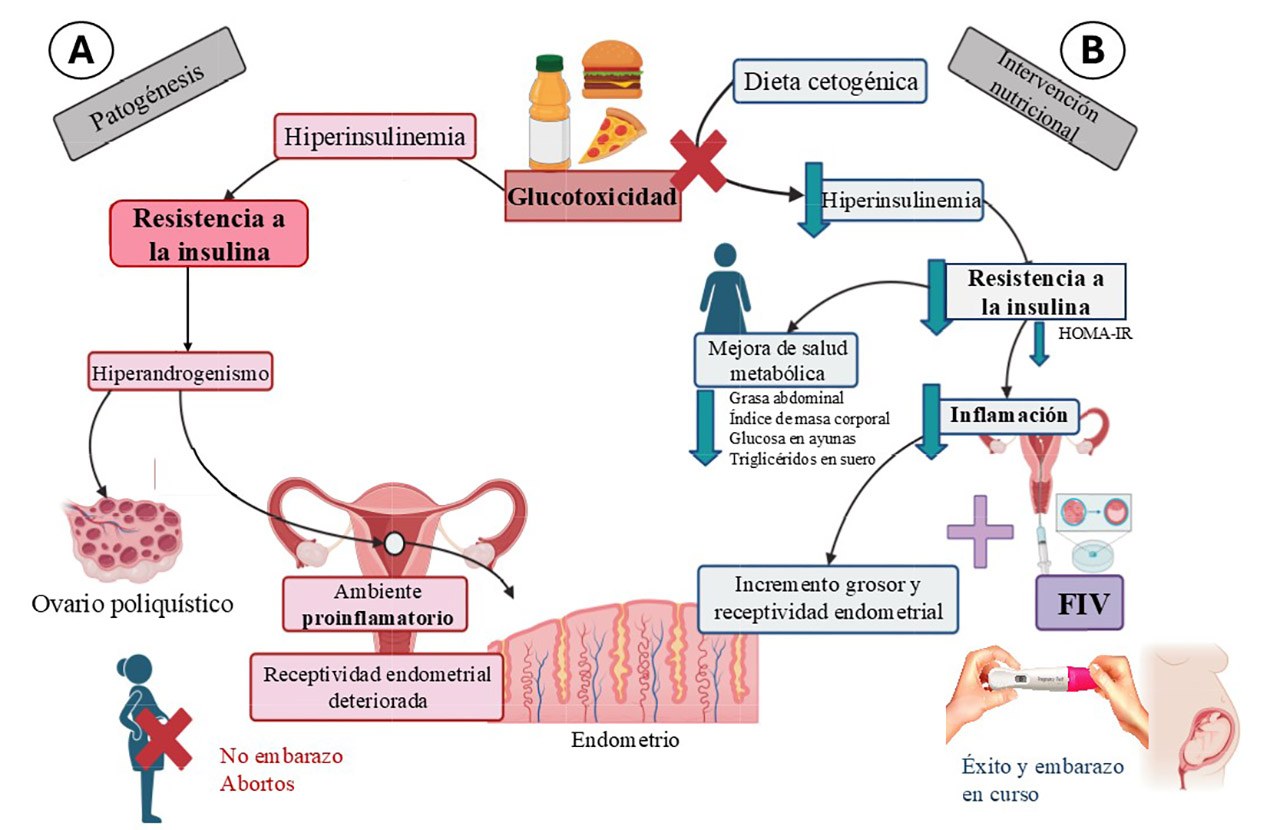
Entre el 11 y el 13% de las mujeres en edad reproductiva padece el síndrome de ovario poliquístico (SOP), condición caracterizada por un desequilibrio hormonal profundo que altera el funcionamiento normal de los ovarios y del ciclo menstrual (Teede et al., 2023). El hiperandrogenismo es su característica clínica más destacada –caracterizado por niveles elevados de andrógenos–, con signos visibles como hirsutismo en áreas de distribución pilosa androgénica (como el rostro, tórax y región dorsal), acné, y alopecia.
Las mujeres con SOP suelen experimentar disfunción ovulatoria, –ciclos menstruales irregulares o ausentes–, que suele dificultar/impedir la concepción de manera natural (Stener-Victorin et al., 2024) y es la razón principal por la que acuden a clínicas de reproducción asistida. Al someterse a tratamientos de fertilización in vitro (FIV), las mujeres con SOP suelen presentar ovocitos inmaduros, baja calidad embrionaria o mayor tasa de abortos espontáneos y complicaciones como el síndrome de hiperestimulación ovárica (Kumar et al., 2013), dificultando su tratamiento y el logro del embarazo.
La alteración metabólica más frecuente en estas pacientes es la resistencia a la insulina, acompañada de altos triglicéridos en plasma, lo que contribuye a empeorar los síntomas del síndrome del ovario poliquístico y con frecuencia, la presencia de sobrepeso y obesidad. La acción y presencia de un exceso de insulina (hiperinsulinemia constante) afecta y perturba aún más el ambiente hormonal en las enfermas y disminuye sus posibilidades de éxito para la reproducción.
La alimentación actual tiende a ser obesogénica por la alta frecuencia en el consumo de cantidades excesivas de carbohidratos y alimentos procesados, hipercalóricos y con un alto índice glucémico (Kopp, 2019). Este ambiente obesogénico genera una exposición constante a la glucosa alimenticia, siendo frecuente el consumo de más de 250 g de carbohidratos/día en la dieta estándar occidental. La glucotoxicidad tiene efectos negativos en la salud al generar un estado de hiperinsulinemia constante y eventualmente resistencia a la insulina, promoviendo alteraciones metabólicas que incrementan el riesgo de desarrollar otras enfermedades degenerativas que también contribuyen con la cada vez más creciente infertilidad femenina.
Un volumen cada vez mayor de ensayos clínicos ha demostrado la efectividad de las dietas muy bajas en carbohidratos (<50 gr. diarios, 10-15% de las calorías de la dieta), moderadas en proteínas y altas en grasas saludables –60% de la dieta– en la reducción de los niveles séricos de insulina, corrigiendo y mejorando los marcadores de resistencia y sensibilidad a esta hormona así como el perfil lipídico y permitiendo la estabilización de parámetros metabólicos (Shahid et al., 2022).
Considerando que la prevalencia de obesidad en mujeres mexicanas es del 41% (Campos-Nonato et al., 2023) y de éstas, aproximadamente el 10% padecen del síndrome del ovario poliquístico (Wolf et al., 2018), el estudio piloto llevado a cabo por Palafox-Gomez y colaboradores en el 2023 resalta por su ataque frontal al problema con una intervención nutricional terapéutica donde se implementó un esquema nutricional bajo en carbohidratos y con un aporte adecuado de grasas saludables y proteínas, cuidadosamente diseñado para inducir un estado metabólico de cetosis nutricional leve. Este se puede definir como un estado metabólico fisiológico en el cual, una ingesta reducida de carbohidratos promueve que el organismo adapte su fuente principal de energía y comience a oxidar ácidos grasos, generando como subproductos los cuerpos cetónicos: acetoacetato, beta-hidroxibutirato y acetona. Estos compuestos, sintetizados en el hígado, son utilizados como fuente alternativa de energía por diversos tejidos, incluyendo el músculo esquelético y el sistema nervioso central. Esta intervención personalizada, controlada y basada en evidencia previa, tuvo como objetivo mejorar la sensibilidad a la insulina y optimizar marcadores de disfunción metabólica de las pacientes, antes de iniciar un nuevo ciclo FIV.
Se reclutó a 12 pacientes con SOP y resistencia a la insulina (evaluado por el índice HOMA-IR), con ciclos FIV previos que fallaron. A lo largo de la intervención nutricional (duración 14 ± 11 semanas) todas las pacientes redujeron drásticamente su consumo de carbohidratos de 208 ± 50.5 g/día a 41.71 ± 10.1 g/día, basados en una dieta de 1800 cal, lo cual fue evidenciado por la presencia de cuerpos cetónicos en orina (>40 mg/dL), que son el producto del metabolismo de las grasas como macronutriente prioritario. Al finalizar la intervención nutricional se reportó una disminución significativa en la circunferencia de la cintura y en el peso corporal (8.3 ± 3.5 cm y 7.9 ± 1.1 kg, respectivamente); una mejora significativa en los parámetros metabólicos, como insulina en suero, glucosa en ayunas, triglicéridos e índice HOMA-IR (11.6 ± 3.7 µUI/mL, 11.4 ± 3.5 mg/dL, 43.8 ± 11.6 mg/dL y 3.28 ± 1.27, respectivamente).
A pesar de que no se registraron diferencias significativas en el número de folículos antrales, ovocitos colectados, y ovocitos MII (maduros), las tasas de fertilización entre el ciclo previo y el ciclo post-intervención nutricional, así como las tasas de resultados obstétricos sí mostraron mejora muy importante, ya que el embarazo en curso o con recién nacido vivo, alcanzó una tasa de 66.7 vs cero del ciclo fallido anterior.
La intervención nutricional terapéutica basada en la generación de cetosis nutricional al reducir el consumo de carbohidratos, ha mostrado ser eficaz en la mejora de los parámetros antropométricos y metabólicos en pacientes infértiles con síndrome del ovario poliquístico y con resistencia a la insulina, para quienes, al eliminar la glucotoxicidad, pueden lograr el embarazo y mejorar su calidad de vida (Fig.1) (Palafox-Gomez et al., 2023). Asimismo, este estudio piloto abrió el horizonte para evaluar si la resistencia a la insulina y las alteraciones metabólicas asociadas son por sí mismas un factor que, junto con la edad, agravan o pueden ser causales en el problema de infertilidad femenina. Es importante señalar que este tipo de estrategias dietéticas debe ser indicada y supervisada por personal médico o profesionales en nutrición clínica, a fin de garantizar su seguridad, eficacia y adecuación individual.
Bibliografía
Campos-Nonato, I., Galvan-Valencia, O., Hernandez-Barrera, L., Oviedo-Solis, C., & Barquera, S. (2023). Salud Publica Mex, 65, s238-s247. doi:10.21149/14809
Kopp, W. (2019). How Western Diet And Lifestyle Drive The Pandemic Of Obesity And Civilization Diseases. Diabetes Metab Syndr Obes, 12, 2221-2236. doi:10.2147/DMSO.S216791
Kumar, P., Nawani, N., Malhotra, N., Malhotra, J., Patil, M., Jayakrishnan, K., Mahajan, N. (2013). Assisted reproduction in polycystic ovarian disease: A multicentric trial in India. J Hum Reprod Sci, 6(1), 49-53. doi:10.4103/0974-1208.112382
Palafox-Gomez, C., Ortiz, G., Madrazo, I., & Lopez-Bayghen, E. (2023). Adding a ketogenic dietary intervention to IVF treatment in patients with polycystic ovary syndrome improves implantation and pregnancy. Reprod Toxicol, 119, 108420. doi:10.1016/j.reprotox.2023.108420
Shahid, R., Iahtisham Ul, H., Mahnoor, Awan, K. A., Iqbal, M. J., Munir, H., & Saeed, I. (2022). Diet and lifestyle modifications for effective management of polycystic ovarian syndrome (PCOS). J Food Biochem, 46(7), e14117. doi:10.1111/jfbc.14117
Stener-Victorin, E., Teede, H., Norman, R. J., Legro, R., Goodarzi, M. O., Dokras, A., Piltonen, T. T. (2024). Polycystic ovary syndrome. Nat Rev Dis Primers, 10(1), 27. doi:10.1038/s41572-024-00511-3
Teede, H. J., Tay, C. T., Laven, J. J. E., Dokras, A., Moran, L. J., Piltonen, T. T., Joham, A. E. (2023). Recommendations From the 2023 International Evidence-based Guideline for the Assessment and Management of Polycystic Ovary Syndrome. J Clin Endocrinol Metab, 108(10), 2447-2469. doi:10.1210/clinem/dgad463
Wolf, W. M., Wattick, R. A., Kinkade, O. N., & Olfert, M. D. (2018). Geographical Prevalence of Polycystic Ovary Syndrome as Determined by Region and Race/Ethnicity. Int J Environ Res Public Health, 15(11). doi:10.3390/ijerph15112589
*Foto de portada creada con DALLE