El sistema inmunológico se ha dividido (en términos operacionales) en dos grandes categorías, de acuerdo con la rapidez de respuesta, así como la especificidad que muestra ante un estímulo antigénico. Por un lado, encontramos a la denominada inmunidad innata, que representa la primera línea de defensa contra los patógenos, caracterizada por una respuesta rápida (minutos, horas) y con aparente poca especificidad; por el otro, a la inmunidad adaptativa que, aunque responde de manera lenta (días, semanas), reconoce y recuerda con exquisita especificidad a los antígenos que detonaron su activación.
Las células responsables de la inmunidad adquirida son los linfocitos, que a su vez se dividen en linfocitos T y linfocitos B. Ambos tipos expresan receptores muy específicos para el reconocimiento de los antígenos. Algunos de éstos requieren ser procesados y presentados por las células de la inmunidad innata, para su reconocimiento posterior por los linfocitos T.
En ratones y humanos, los linfocitos B maduran en la médula ósea (“B” del inglés Bone marrow) y los linfocitos T en el Timo. Los primeros reconocen antígenos por anticuerpos anclados en su membrana (BCR por “B Cell Receptor”). En cambio, los linfocitos T expresan un “TCR”, que reconoce antígenos proteicos que requieren ser procesados (proteólisis) y presentados en Moléculas del Complejo Principal de Histocompatibilidad (MHC en inglés), por células profesionales de la inmunidad innata (células dendríticas y macrófagos). Existen linfocitos que no expresan BCR ni TCR, cuya identificación se remonta a mediados de los años setenta del siglo pasado. Dichos linfocitos identifican y eliminan células tumorales y células infectadas con virus de manera rápida, por lo que se les incluye entre las células la inmunidad innata.
Estos linfocitos actualmente denominados ILC (del inglés, Innate Lymphocyte Cells) se clasifican en tres grupos. El grupo 1 se caracteriza por la producción de interferón gamma (IFN-g) y factor de necrosis tumoral alfa (TNF-a), que favorecen las respuestas ante virus y células tumorales. El grupo 2, produce interleucina 4 (IL-4), 5 (IL- 5) y 13 (IL-13), importantes en la respuesta contra parásitos y a alergenos. Y el grupo 3, productores de IL-17 e IL-22 que participan en la respuesta contra bacterias y hongos (Vivier et al., 2018).
Las ILC1 contienen a las células asesinas naturales (del inglés Natural Killer, o NK), o linfocitos granulares grandes, que no requieren del procesamiento y presentación de los antígenos; estas células también regulan al sistema inmunológico a través de la secreción de citocinas (Paul & Lal, 2017).
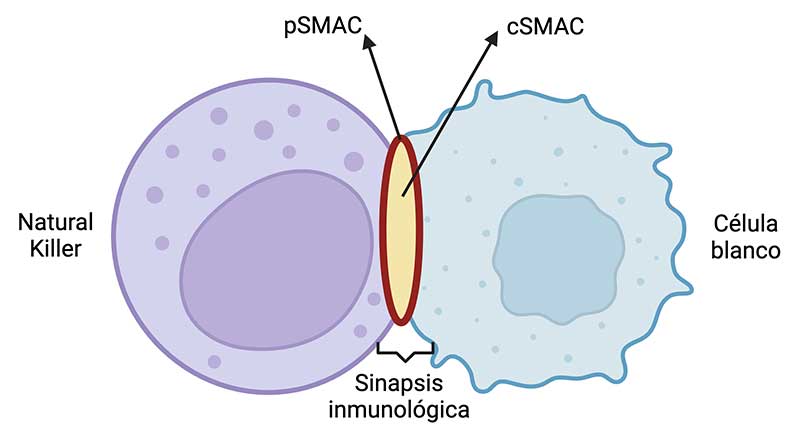
El mecanismo de citotoxicidad comienza cuando la célula NK reconoce una célula blanco (célula tumoral o infectada con virus), generando una interfase de comunicación entre ambas células, conocida como “sinapsis inmunológica” (SI). La SI tiene dos regiones: un clúster de activación periférica supramolecular (pSMAC) y un clúster de activación central supramolecular (cSMAC). En el pSMAC se acumulan moléculas de adhesión como LFA-1 y MAC-1, mientras que en el cSMAC se conglomeran receptores de activación.
Esta SI permite la interacción de la célula NK con su célula blanco, provocando la liberación dirigida de proteínas al sitio de unión entre ambas células (Krzewski & Coligan, 2012). La SI es el resultado de la reorganización del citoesqueleto que posibilita la movilización de lisosomas secretores hacia el centro organizador de microtúbulos. Los lisosomas secretores contienen perforina, granzima A y granzima B (Crinier et al., 2020).
La perforina es una proteína que forma poros en la membrana de la célula blanco, creando cambios osmóticos y permitiendo la entrada de las granzimas (enzimas del tipo serina proteasas), que inducen la autodestrucción controlada de la célula blanco, proceso conocido como apoptosis (Ham et al., 2022). La granzima B tiene la capacidad de “cortar” a las caspasas 3 y 7, lo que detona la apoptosis. Por otra parte, la granzima A induce la muerte celular de forma independiente de caspasas, al producir especies reactivas de oxígeno (ROS) y promueve la liberación de nucleasas que generan daño en el ADN de la célula blanco (Prager & Watzl, 2019).
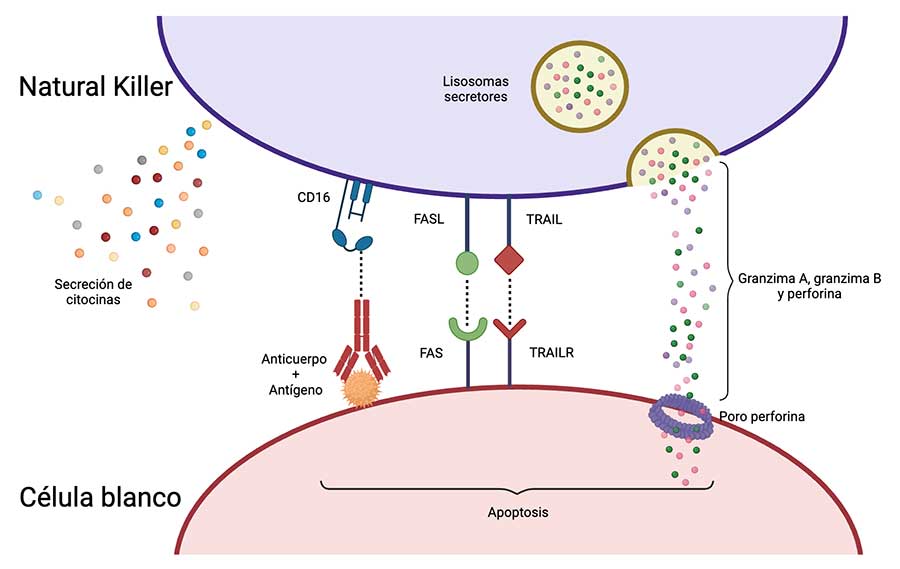
Además, las células NK son capaces de realizar citotoxicidad celular dependiente de anticuerpos (ADCC), cuando el receptor de Fcg (FcgR) en la NK reconoce a la IgG unida a un antígeno en la célula blanco, lo que induce la liberación de gránulos líticos y su eliminación. Asimismo, las células NK expresan al ligando de FAS (FASL) y TRAIL que, al interactuar con sus respectivos receptores en la célula blanco FAS y el receptor de TRAIL (TRAILR), inducen la apoptosis (Crinier et al., 2020).
Aunque la función principal de la célula NK es la citotoxicidad, también se encargan de secretar diferentes citocinas pro-inflamatorias como el IFN-g y el TNF-a con actividades antitumorales y antivirales. El IFN-g estimula la producción de perforina, granzimas y la expresión de FASL (Konjevic et al.,2019). Por otro lado, el TNF-a promueve la maduración y la activación de las células NK (Lee et al., 2009).
Las células NK reconocen, pero no atacan células sanas, gracias a la expresión balanceada de sus receptores de inhibición y activación. Los receptores de inhibición se unen a las moléculas del MHC-I, bloqueando las respuestas citolíticas, lo que impide la muerte de las células sanas. No obstante, las respuestas asociadas al estrés incrementan la expresión de los ligandos reconocidos por los receptores de activación de la célula NK, provocando la liberación de los gránulos líticos, aún en presencia de receptores inhibidores (Paul & Lal, 2017).
La miosina IIa (MyoIIa) desempeña un papel muy importante en el transporte de los lisosomas secretores hacia la sinapsis inmunológica (Krzewski & Coligan, 2012). La MyoIIa pertenece a la super familia de proteínas motoras, las cuales se mueven a través de filamentos de actina por medio de la energía generada por la hidrólisis de moléculas de ATP (Krendel & Mooseker, 2005). Estas proteínas están involucradas en el tránsito intracelular, motilidad celular, regulación de cambios morfológicos celulares, así como en procesos de endocitosis y exocitosis (Maravillas-Montero et al., 2014).
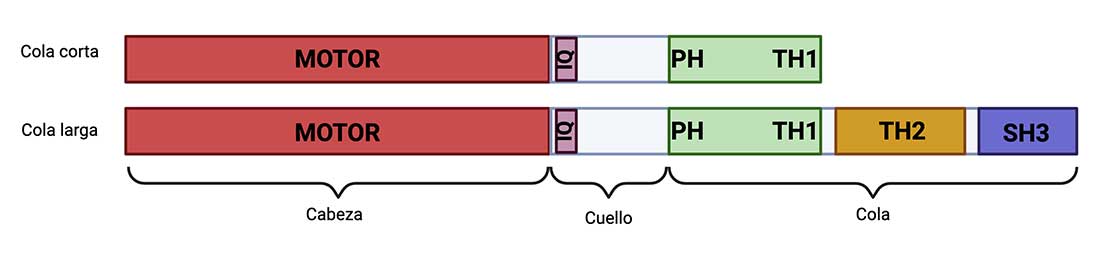
Se han reportado 38 clases de miosinas en organismos eucariontes, las cuales se clasifican en convencionales y no convencionales; dentro de las no convencionales se encuentran las miosinas de clase I (Myo1), involucradas en la regulación del transporte intracelular, en la formación de proyecciones celulares, así como en la exocitosis, endocitosis y fagocitosis. (Cruz-Zárate et al., 2021). Las Myo1 tienen un dominio motor (sitio de unión a filamentos de actina y para la hidrolisis del ATP), el cual usa la energía de la hidrólisis de ATP para crear cambios conformacionales que posibilitan su movimiento a través de filamentos de actina.
Enseguida tenemos el dominio del cuello, que contiene regiones ricas en glutamina e isoleucina conocidas como motivos “IQ”, sitio de la unión de las cadenas ligeras variables. Finalmente se encuentra el dominio de la cola (TH de “tail homology”). Las miosinas de cola corta tienen un TH1, que contiene un dominio homólogo a Pleckstrina (PH), que permite la unión a fosfoinosítidos de la membrana y a balsas lipídicas. Por otro lado, las miosinas de cadena larga están constituidas por el dominio TH1, TH2 y TH3. El TH2 es un dominio rico en aminoácidos como glicina, prolina y alanina/glutamina que tiene un sitio de unión a actina insensible a ATP, mientras que el TH3 regula las interacciones de la miosina con otras proteínas (Maravillas-Montero. & Santos-Argumedo, 2011).
Humanos y ratones tenemos 8 tipos de Myo1, seis de cola corta: Myo1a, Myo1b, Myo1c, Myo1d, Myo1g y Myo1h; y dos de cola larga: Myo1e y Myo1f. De acuerdo con la base de datos Immgen (https://www.immgen.org), las células NK expresan ARNm de Myo1g y Myo1f. A pesar de que el ARNm de la Myo1f se expresa en mayor cantidad, datos preliminares de nuestro laboratorio indican que la ausencia de Myo1g tiene un mayor impacto en la función de las células NK (Esparza López, Z. V. A. [2023]).
Gracias al estudio de la Myo1g en ratones deficientes (Myo1g-/-), se encontró que las moléculas de adhesión LFA-1 y CD44 disminuyen su expresión de forma significativa en linfocitos B activados, posiblemente por la alteración en su transporte a través de las balsas lipídicas (Maravillas-Montero et al., 2014). Esto provoca que la adhesión celular se vea afectada y, por ende, su capacidad de migración sea menos eficiente.
De igual forma, la deficiencia de Myo1g-/- mostró que ratones de 8, 10 y 12 semanas tienen una disminución en el porcentaje y en los números absolutos de células NK1.1+, en comparación con ratones silvestres C57BL/6. Esto indicaría que la Myo1g está involucrada en el reclutamiento de receptores de activación durante el proceso de citotoxicidad. Por ello, es interesante estudiar cómo se afectan los mecanismos de citotoxicidad por la deficiencia de Myo1g.
Por el momento, este estudio es la primera evidencia de la participación de la Myo1g en la expresión del receptor NK1.1, lo siguiente es evaluar el impacto en la citotoxicidad de estas células.
El hallazgo inicial por bioinformática sobre la expresión de la expresión de miosinas de clase 1 en las células NK ha planteado nuevas preguntas, potencialmente importantes, para el estudio de las células de la inmunidad innata.
Trabajo apoyado por Conahcyt (CF-2023-I-741).
Referencias
- Crinier, A., Narni-Mancinelli, E., Ugolini, S., & Vivier, E. (2020). SnapShot: Natural Killer Cells. Cell, 180(6), 1280-1280.
- Cruz-Zárate, D., Miguel-Rodríguez, C. E., Martínez-Vargas, I. U., & Santos-Argumedo, L. (2021). Myosin 1g and 1f: A Prospective Analysis in NK Cell Functions. Frontiers in Immunology, 12, 760290.
- Esparza López, Z. V. A. (agosto, 2023). Identificación de la función de Myo1f y Myo1g en células Natural Killer (NK). Tesis de Maestría, Departamento de Biomedicina Molecular CINVESTAV-IPN
- Ham, H., Medlyn, M., & Billadeau, D. D. (2022). Locked and Loaded: Mechanisms Regulating Natural Killer Cell Lytic Granule Biogenesis and Release. Frontiers in Immunology, 13, 871106.
- (2024). ImmGen Data Browser (base de datos) https://www.immgen.org/Databrowser19/DatabrowserPage.html
- Konjević, G. M., Vuletić, A. M., Mirjačić Martinović, K. M., Larsen, A. K., & Jurišić, V. B. (2019). The role of cytokines in the regulation of NK cells in the tumor environment. Cytokine, 117, 30-40.
- Krendel, M., & Mooseker, M. S. (2005). Myosins: Tails (and Heads) of Functional Diversity. Physiology, 20(4), 239-251.
- Krzewski, K., & Coligan, J. E. (2012). Human NK cell lytic granules and regulation of their exocytosis. Frontiers in Immunology, 3.00335
- Lee, J., Lee, S. H., Shin, N., Jeong, M., Kim, M. S., Kim, M. J., Yoon, S. R., Chung, J. W., Kim, T.-D., & Choi, I. (2009). Tumor necrosis factor-α enhances IL-15-induced natural killer cell differentiation. Biochemical and Biophysical Research Communications, 386(4), 718-723.
- Maravillas‐Montero, J. L., López‐Ortega, O., Patiño‐López, G., & Santos‐Argumedo, L. (2014). Myosin 1g regulates cytoskeleton plasticity, cell migration, exocytosis, and endocytosis in B lymphocytes. European Journal of Immunology, 44(3), 877-886.
- Maravillas-Montero, J. L., & Santos-Argumedo, L. (2011). The myosin family: Unconventional roles of actin-dependent molecular motors in immune cells. Journal of Leukocyte Biology, 91(1), 35-46.
- Paul, S., & Lal, G. (2017). The Molecular Mechanism of Natural Killer Cells Function and Its Importance in Cancer Immunotherapy. Frontiers in Immunology, 8, 1124.
- Prager, I., & Watzl, C. (2019). Mechanisms of natural killer cell-mediated cellular cytotoxicity. Journal of Leukocyte Biology, 105(6), 1319-1329.
- Vivier, E., Artis, D., Colonna, M., Diefenbach, A., Di Santo, J. P., Eberl, G., Koyasu, S., Locksley, R. M., McKenzie, A. N. J., Mebius, R. E., Powrie, F., & Spits, H. (2018). Innate Lymphoid Cells: 10 Years On. Cell, 174(5), 1054-1066.












