INTRODUCCIÓN
La actual pandemia debida al coronavirus (COVID-19) denominado oficialmente como síndrome respiratorio agudo severo 2 (SARS-CoV-2, por sus siglas en inglés), se propaga de persona a persona a través de gotículas procedentes de la nariz o la boca que salen despedidas cuando una persona infectada tose o exhala y éstas son inhaladas por otras personas. Además, estas gotículas caen sobre los objetos y superficies, lo que también es fuente de infección si se tocan estos objetos o superficies y luego se tocan los ojos, nariz o boca. Aparentemente ésta es la razón por la que la cantidad de casos de coronavirus fuera de China aumentó tanto y el número de países afectados se multiplicó en los últimos meses. Jamás se había visto una pandemia causada por un coronavirus. Ésta es la primera pandemia de este tipo, y nunca se ha visto una pandemia que pueda controlarse. En prácticamente dos meses, el número de infectados fue de más de 1 millón de personas en todo el mundo, lo que evidencia el alto nivel de contagio y velocidad de propagación del virus. Hasta el momento, no hay un medicamento o vacuna antiviral clínicamente aprobada disponible para usarse contra la COVID-19. Sin embargo, pocos medicamentos antivirales de amplio espectro han sido evaluados en ensayos clínicos que resulten en la recuperación clínica. De acuerdo con la OMS (PAHO.org) los datos reunidos hasta la fecha sugieren que 80% de las infecciones son leves o asintomáticas, 15% son infecciones graves, que requieren oxígeno, y 5% son infecciones críticas, que requieren ventilación. Debido a que el porcentaje de enfermos graves de COVID-19 es considerablemente menor al de personas infectadas pero asintomáticas, es de fundamental importancia buscar mecanismos para tratar de evitar que esta contagiosa enfermedad se siga propagando tan rápidamente y disminuya, o de preferencia que se elimine la infección en personas sanas.
ANTECEDENTES
Se sabe que el SARS-CoV-2 posee la estructura típica de coronavirus con una proteína S que lo rodea y otras poliproteínas necesarias para su replicación. La proteína S del SARS-CoV-2 es importante en el inicio de la infección, ya que contiene una estructura tridimensional en el dominio de unión al receptor (RBD por sus siglas en inglés), para mantener las fuerzas de Van der Waals. El residuo de glutamina 394 en la región RBD de SARS-CoV-2, es reconocido por el residuo crítico de lisina 31 en el receptor de la enzima convertidora de angiotensina 2 (ACE2), que se encuentra en las células epiteliales de las vías aéreas del ser humano (Shereen et. al., 2020).
Estudios previos indican que la susceptibilidad de los epitelios de las vías aéreas humanas a la infección por SARS-CoV, se correlaciona con la expresión y localización de ACE2. Este receptor ACE2 se expresa predominantemente en la superficie apical de epitelios de vías aéreas bien diferenciados, especialmente en las células ciliadas. Dado que un virus debe unirse a las células e ingresar a ellas antes de que pueda replicarse, la expresión superficial de ACE2 y el estado de diferenciación celular pueden influir directamente en la patogénesis de la enfermedad del SARS-CoV. En resumen, el receptor ACE2 asociado a las células humanas, es el receptor del coronavirus (Jia et. al., 2009).
Al estudiar los efectos de la adición de heparina exógena, que se utiliza como anticoagulante en medicina clínica, a células que serían infectadas con pseudovirus SARS, se observó que se inhibió la unión de la proteína S del virus a las células huésped y se impidió la infección (Thachil, 2020; Lang et. al., 2011). Por otro lado, la incubación de células Vero con heparina (100 μg / ml) 30 minutos antes de la inyección de SARS-CoV HSR1, redujo la infección en 50%. La inhibición parcial del SARS-CoV HSR1 por la heparina sugiere que las proteínas de la envoltura que recubren los viriones SARS-CoV podrían estar dotadas de aminoácidos cargados positivamente y que podrían interactuar con los grupos sulfato cargados negativamente presentes en los proteoglicanos de heparán sulfato (HSPGs, por sus siglas en inglés), expresados en la superficie de las células objetivo (Vicenzi et al., 2004). Tanto la heparina como los ampliamente distribuidos proteoglicanos de heparán sulfato (Figura 1), existen de manera normal en diversas células del cuerpo humano.
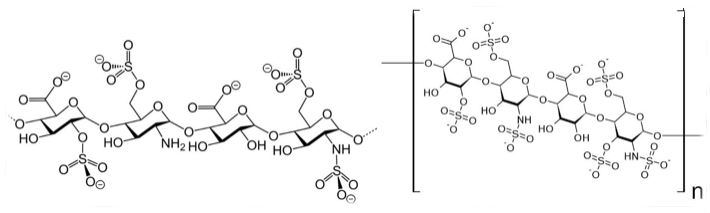
Por otro lado, se sabe que diversos tipos de algas producen polisacáridos sulfatados (PS) que tienen propiedades antivirales. Estos PS funcionan como receptores inespecíficos para proteínas virales que, al unirse, impiden la infección de diversos virus a las células. Desde hace bastante tiempo se sabe que los polisacáridos y la carragenina extraídos de Gelidium cartilagenium [(Linnaeus) Gaillon, 1828], una alga roja erecta de 10 cm de longitud, tenían un marcado efecto inhibitorio sobre el crecimiento del virus de la influenza B y el virus de las paperas en huevos embrionados, aunque no tuvieron efecto sobre la multiplicación del virus de la influenza A y el NDV (Gerber et. al., 1958). Esta alga fue originalmente denominada como Fucus cartilagineus [Linnaeus, 1753] y el nombre actualmente aceptado es Plocamium cartilagineum [(Linnaeus) P.S. Dixon, 1967], (WoRMS, 2020). El carragenano o carragenina, es un poligalactano sulfatado con 15 a 40% de contenido de éster-sulfato y una masa molecular relativa promedio muy superior a 100 kDa. Está formado por unidades alternativas de D-galactosa y 3,6-anhidrogalactosa (3,6-AG) unidas por enlaces glucosídicos α-1,3 y β-1,4. El carragenano se clasifica en varios tipos, como λ, κ, ι, ε, μ, todos con grupos de sulfato del 22 al 35%. Esta clasificación se realizó en función de su solubilidad en cloruro de potasio. Se ha usado principalmente para alimentos por sus propiedades gelificantes (Necas & Bartosikova, 2013).
Se han descrito actividades antivirales en extractos de algas que contienen polisacáridos sulfatados con propiedades anti-HIV-1 y HIV-2; también se conoce el polipéptido cianovirina N de 11 kDa aislado de algas azul-verdes que interfiere con diversos pasos en el proceso de fusión a la membrana del HIV-1 a células CD4+ y que también inhibe al HSV y al virus del sarampión in vitro (Luescher-Mattli et. al., 2003). Se sabe que la Gyrodinium impudicum cepa KG03, microalga causante de la marea roja, produce el exopolisacárido sulfatado p-KG03. Éste tiene una significativa actividad antiviral (EC50 = 26.9 µg/ml) contra el virus de la encefalomiocarditis (EMC) según ensayos in vitro, sin presentar efectos citotóxicos en células HeLa hasta en concentraciones de 1,000 mg/mL. El p-KG03 tiene un peso molecular de 1.87 x 107 Da y está formado de galactosa con ácido urónico (2.96% p/p) y de grupos sulfato (10.32% p/p) (Yim et. al., 2004). Extractos de Undaria pinnatifida, Splachnidium rugosum, Gigartina atropurpurea, y Plocamium cartilagineum; mostraron buena actividad contra virus del herpes HSV-1 (2.5 – 3.6 mg/mL) y HSV-2 (0.7 – 6.6 mg/mL) cuando se aplicaron tópicamente, pero solo durante la primera hora de la infección viral; no fueron efectivos si se aplicaban después (Lee et. al., 2004; Harden et. al., 2009). Exopolisacáridos aniónicos aislados de microorganismos fototrópicos como la cianobacteria Arthrospira platensis y la microalga roja Porphyridium purpureum (Rhodophyta), tienen efectos contra el virus de la vacuna, que se ha usado realmente como vacuna en la erradicación de la enfermedad de la viruela (Radonić et. al., 2011). Más recientemente, tres aislados del virus del Chikungunya (CHIKV) se usaron para pruebas antivirales con extractos de diversas algas marinas (Bryothamnion triquetrum, Caulerpa racemosa, Laurencia dendroidea, Osmundaria obtusiloba, Ulva fasciata, y Kappaphycus alvarezii). Se encontraron altos niveles de inhibición de hasta 1.25 μg/mL dependientes del tiempo de adición, y demostraron tener baja toxicidad (Cirne-Santos et. al., 2019).
Estos compuestos también se encontraron en diversas variedades de macroalgas marrones y sargazos como Turbinaria turbinata, Sargassum filipendula, Dictyota caribaea y Padina perindusiata que se colectaron en la península de Yucatán. En extractos de estas algas, se encontraron fuciodanos sulfatados de bajo peso molecular. El análisis de espectros infrarrojos de transformada de Fourier (FT-IR), indicó que la mayoría de los grupos sulfato se hallaron en el C-4 y en menor grado en C-2 y C-3 de los residuos fucopiranosa (García-Ríos, et. al., 2012). Extractos de algunas de estas algas mostraron actividad antiviral contra el virus del herpes simplex tipo-I in vitro como el Sargassum fluitans (EC50 = 42.8 μg/ml) y Solieria filiformis (EC50 = 136.0 μg/ml) a una multiplicidad de infección (MOI) de 0.01 ID50/células sin mostrar citotoxicidad (1–200 μg/mL) (Bedoux et. al., 2017). Varios polisacáridos acídicos derivados de algas marinas fueron utilizados para observar los efectos que tenían ante la infección por diversos virus como el HIV-1, hepatitis B (HBV), hepatitis C (HCV), el virus de la leucemia humana de células T tipo 1 (HTLV-1) y el de la estomatitis vesicular (VSV). Se encontró que los polisacáridos de fucan sulfatado, el ascofilan y dos derivados fucoidanos de distintas fuentes, inhibieron significativamente el paso inicial de la infección del HIV-1, del HBV, del HCV y del VSV; el grado de inhibición dependió de las dosis aplicadas pero no afectaron las etapas finales en ensayos con células HeLa (Ueno et. al., 2019). Una caracterización más específica se realizó con fucoidanos purificados del Sargassum henslowianum denominados SHAP-1 y SHAP-2 con un peso molecular aparente de 6.55 x 105 y 5.89 x 105 Da, respectivamente. Ambos están compuestos de fucosa y galactosa en una proporción de aproximadamente 3:1 y con un 31.9% de sulfato en los carbonos C-2 y C-4 principalmente. Las IC50 de ambos compuestos contra el HSV-1 fueron de 0.89 y 0.82 μg/mL; y de 0.48 μg/mL contra el HSV-2. Se propuso que el mecanismo antiviral era por medio del bloqueo de la adsorción de los virus a las células huésped (Sun et. al., 2020). A estos polisacáridos sulfatados y otros oligosacáridos de bajo peso molecular derivados de macroalgas como galactanos, ulvanos y fucanos se les han encontrado actividades como anticoagulantes/antitrombóticas, antivirales, inmuno-inflamatorias, anti-lipidémicas, y antioxidantes (Jiao et. al., 2011).
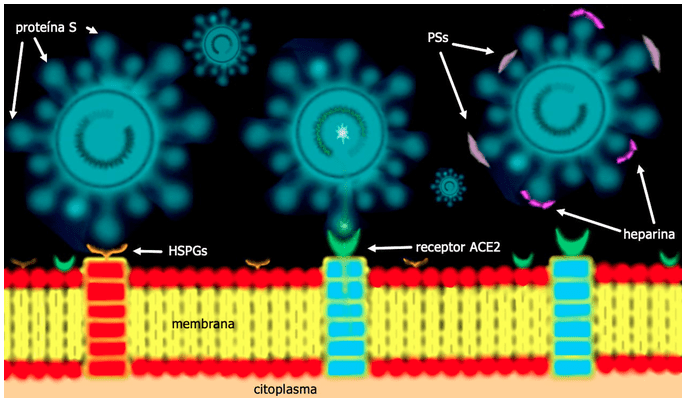
Con estos datos varios autores proponen entonces que el posible mecanismo de ingreso del virus a las células es inicialmente por la adherencia de la proteína S viral a los HSPGs que se encuentran naturalmente en las células, y estos ayudan a que el virus “ruede” o se deslice sobre las células humanas sin liberarse, hasta que localiza a un receptor ACE2. y facilita la unión de la proteína S al mismo haciéndolo fuertemente y permitiendo así el ingreso del virus adentro de la célula (Figura 2) (Lang et. al., 2011). Recientemente se encontró que el número de células en los tejidos nasal y bucal que expresan el receptor ACE2, es comparable con el número de células de pulmón y colon que expresan el mismo receptor ACE2 (Wu & Zheng, 2020).
Debido a los efectos antes mencionados, se han generado ya varias patentes que implican el uso de extractos de algas como potenciales antivirales; algunos ejemplos son:
- Patente ES2406684T3 Andreas Grassauer Marinomed Biotechnologie Gmbh, Prioridad 2007-08-24, Archivado 2008-08-22, Concedida 2013-06-07. “Composición antiviral que comprende un polisacárido sulfatado: carragenano iota”.
- Patente ES2655674T3 Krzysztof PYRC Uniwersytet Jagiellonski, Prioridad 2012-05-18, Archivado 2013-05-16, Concedida 2018-02-21. “El uso de polímero de quitosano en el tratamiento y prevención de infecciones provocadas por coronavirus”.
- Patente WO1996030027A1 Steven Neal Anderson Abbott Laboratories, Prioridad 1995-03-29, Archivado 1996-03-22, Publicado 1996-10-03. “Inhibición de la infección por rotavirus con carragenano o sulfato de dextrano”.
- Patente PT2101792E Andreas Grassauer Marinomed Biotechnologie Gmbh, Prioridad 2006-12-05, Archivado 2007-12-04, Publicado 2010-06-25. “Uso de carragenano para tratar infecciones por rinovirus”.
- Patente WO2013006795A2 John Schlafer COLMAN Humanitas International Foundation, Prioridad 2011-07-07, Archivado 2012-07-06, Publicado 2013-01-10. “Composiciones antivirales y métodos de uso”.
Se han realizado estudios clínicos en humanos que demuestran que estos derivados de algas no presentan citotoxicidad y son bien tolerados por personas de diferentes edades. En un estudio abierto de fase I / II de aumento de dosis, seis pacientes con SIDA fueron tratados con administración i.p. de dextrina 2-sulfato, y hubo una disminución significativa en la carga viral. Concluyeron que los compuestos aniónicos de bajo peso molecular parecen poseer una mejor biodisponibilidad que los compuestos de alto peso molecular. De hecho, el tamaño más pequeño de los oligosacáridos que contienen manosa altamente sulfatados (PI-88), puede explicar su actividad biológica in vivo (Ghosh et. al., 2009). Otras vías de administración también son efectivas. Se analizaron los datos de pacientes individuales a partir de dos ensayos aleatorios doble ciego, controlados con placebo que evaluaban la efectividad terapéutica del aerosol nasal de carragenano en el resfriado común agudo. Se incluyeron pacientes con resfriado común confirmado por virus (n = 254, tratamiento 126, placebo 128) y se evaluaron los siguientes parámetros: duración de la enfermedad, número de pacientes con recaídas, número de virus respiratorios y títulos virales en la inclusión (visita 1) en comparación con los días 3-5 (visita 2). Los pacientes tratados con carragenina mostraron una reducción significativa en la duración de la enfermedad de casi 2 días (p <0.05), así como significativamente menos recaídas durante 21 días de período de observación (p <0.05). La eliminación del virus entre la visita 1 y la visita 2 fue significativamente más pronunciada en el grupo de carragenano (p <0.05). En ambos estudios, el resfriado común confirmado por virus fue causado por tres subtipos de virus principales: rinovirus humano (46%), coronavirus humano (25%) y virus de la gripe A (14%). El aerosol nasal de carragenano mostró una eficacia antiviral significativa en los tres subgrupos de virus; la mayor efectividad se observó en pacientes infectados con el virus corona humano. La duración reducida de la enfermedad fue de 3 días (p <0.01) y el número de recaídas fue tres veces menor (p <0.01) en pacientes infectados con el virus de corona tratados con carragenano en comparación con los pacientes control. Concluyeron que la administración de carragenano con un aerosol nasal en niños y adultos que padecen resfriado común confirmado por virus, redujo la duración de la enfermedad, aumentó la eliminación viral y disminuyó las recaídas de los síntomas, por lo que el aerosol nasal de carragenano fue un tratamiento efectivo del resfriado común en niños y adultos (Registro de la prueba; ISRCTN52519535 y ISRCTN80148028 (International Standard Randomised Controlled Trials Number, https://www.isrctn.com ) (Koenighofer et. al., 2014; Graf et. al., 2018; Hao et. al., 2019). También se probaron pastillas que contenían antisépticos y anestésicos locales como amilmetacresol (AMC) y alcohol 2,4-diclorobencílico (DCBA) o hexilresorcinol (HR) y pastillas Coldamaris® que contienen el iota-carragenano antiviral patentado; contra representantes de virus respiratorios que causan dolor de garganta: rinovirus humano (HRV) 1a , HRV8, virus de influenza A H1N1n, Coxsackievirus A10 y coronavirus humano (hCoV) OC43, encontrando que las pastillas que contienen carragenano son altamente activas contra todos los virus probados, a diferencia de las otras. Se demostró también que, durante el tiempo de residencia de la pastilla en la boca, el título viral se redujo en 85% y 91% para el virus de la influenza A y hCoV OC43, respectivamente (Morokutti-Kurz, et. al., 2017).
El producto Coldamaris® de la empresa Marinomed Biotech, con sede en Viena, a base de iota-carragenina principalmente, recibió ya la aprobación de EUA como un nuevo tratamiento para el resfriado común (The PharmaLetter, 2018). Viene en presentación de pastillas y como aerosol nasal. Las pastillas no contienen azúcar ni miel y es apto para uso en niños y adolescentes a partir de 6 años, y adultos. La presentación en aerosol indica que el Coldamaris profiláctico hidrata la mucosa nasal y crea una película protectora agradable que evita que los virus ataquen al organismo. El tracto respiratorio superior también se limpia y el aerosol nasal lo protege los 365 días del año (Figura 3).
Este producto se comercializa como auxiliar en el tratamiento de resfriados de origen viral sin especificar a cuáles virus está dirigido. De acuerdo con la literatura, funciona de manera diferente con distintos virus. Hasta la fecha no se ha reportado su efecto contra el COVID-19.
PROPUESTA
En este contexto, se propone elaborar un producto similar derivado de algas, pero con polisacáridos sulfatados (PS) de bajos pesos moleculares que puedan ser aplicados también como aerosol al tracto respiratorio, y como pastillas al tracto bucofaríngeo de personas sanas, que serían cubiertos por estos PS restringiendo la unión del virus SARS-CoV-2 con las proteínas celulares, disminuyendo y posiblemente evitando así la infección del organismo y la propagación del virus.
La propuesta es tratar de evitar que la proteína S del SARS-CoV-2 se una al receptor ACE2 de las células epiteliales de las vías respiratorias y bucal de personas sanas, por medio de la administración de estos PSs, que se unirán inespecíficamente a la proteína S del virus. Se propone el uso del sargazo que arriba a las costas mexicanas como la materia prima para el escalamiento de la producción de estos PSs de bajo peso molecular. Para lograr esto, primero es necesario conseguir los recursos para desarrollar la metodología de extracción y generación de esos PSs de bajos pesos moleculares, después hay que buscar el apoyo de empresas farmacéuticas para el escalamiento del proceso y la elaboración de los aerosoles y pastillas, así como de instituciones públicas de salud para realizar los ensayos clínicos necesarios del potencial producto final. Sabiendo que hay por lo menos un producto similar (Coldamaris®) en el mercado europeo y estadounidense, se esperaría que no fuera muy complicado lograr el registro y aprobación del producto que se espera obtener con esta propuesta. Podría registrarse como medicamento herbolario que, de acuerdo con la COFEPRIS, no requiere de tantos requisitos para su aprobación y uso.
BENEFICIOS
Como se mencionó anteriormente, considerando que el 80% de las infecciones por el COVID-19 son leves o asintomáticas, 15% son infecciones graves que requieren oxígeno, y 5% son infecciones críticas que requieren ventilación, es de fundamental importancia buscar mecanismos para tratar de evitar que esta contagiosa enfermedad se siga propagando tan rápidamente y que disminuyan o de preferencia que se elimine la infección en personas sanas. Por ello, esta propuesta se enfoca en tratar de evitar que la proteína S del SARS-CoV-2 se una al receptor ACE2 de las células epiteliales de las vías respiratorias y bucal de personas sanas, por medio de la administración de polisacáridos sulfatados de bajo peso molecular extraídos de algas. Esto debería de interrumpir desde el inicio la entrada y posterior replicación del virus en personas sanas, evitando así la rápida propagación de la enfermedad descargando la presión en los servicios de salud, que es uno de los principales problemas de esta pandemia, y permitiendo además que las personas sanas tratadas puedan continuar con sus actividades normales, en beneficio de la economía, que es el otro problema derivado de esta situación. Para ello, es necesario montar la técnica de extracción de estos polisacáridos sulfatados y lograr su posterior degradación a moléculas de bajo peso molecular a partir de algas. Estas técnicas se podrían adaptar a los sargazos que arriban a las costas mexicanas para usarlos como materia prima para el escalamiento de la producción de estos polisacáridos sulfatados de bajo peso molecular. Con este material se elaborarían soluciones que se podrían atomizar para su aplicación en las vías nasales y pastillas para chupar que protegerán el tracto bucal y digestivo de personas sanas.
De acuerdo con la literatura y a la eficacia de estas moléculas, se esperaría que, con la aplicación de estos productos en forma nasal y bucal conjuntamente en personas sanas, se logrará un impacto sanitario inmediato en la disminución de la velocidad de contagios e infección. Esto tendría también un impacto ecológico, ya que su producción a base de sargazo ayudaría a eliminar ese residuo contaminante de nuestras playas, y el impacto social sería la generación de empleos y una sensación de bienestar y seguridad en la población en general.
REFERENCIAS
- Bedoux, G., Caamal-Fuentes, E., Boulho, R., Marty, C., Bourgougnon, N., Freile-Pelegrín, Y., & Robledo, D. (2017). Antiviral and cytotoxic activities of polysaccharides extracted from four tropical seaweed species. Natural Product Communications, 12(6), https://doi.org/10.1177/1934578X1701200602
- Cirne-Santos, C. C., Barros, C. D. S., Azevedo, R. C., Nogueira, C., Yamomoto, K., Meira, G., … & Ferreira, D. (2019). Inhibition by marine algae of chikungunya virus isolated from patients in a recent disease outbreak in Rio de Janeiro. Frontiers in Microbiology, 10, 2426. https://doi.org/10.3389/fmicb.2019.02426
- García-Ríos, V.; Ríos-Leal, E.; Robledo, D. & Freile-Pelegrin, Y. (2012). Polysaccharides Composition from Tropical Brown Seaweeds. Phycological Research, 60, 305–315. https://doi.org/10.1111/j.1440-1835.2012.00661.x
- Gerber, P., Dutcher, J. D., Adams, E. V., & Sherman, J. H. (1958). Protective effect of seaweed extracts for chicken embryos infected with influenza B or mumps virus. Proceedings of the Society for Experimental Biology and Medicine, 99(3), 590-593. https://doi.org/10.3181/00379727-99-24429
- Ghosh, T., Chattopadhyay, K., Marschall, M., Karmakar, P., Mandal, P., & Ray, B. (2009). Focus on antivirally active sulfated polysaccharides: from structure–activity analysis to clinical evaluation. Glycobiology, 19(1), 2-15. https://doi.org/10.1093/glycob/cwn092
- Graf, C., Bernkop-Schnürch, A., Egyed, A., Koller, C., Prieschl-Grassauer, E., Morokutti-Kurz, M. (2018). Development of a nasal spray containing xylometazoline hydrochloride and iota-carrageenan for the symptomatic relief of nasal congestion caused by rhinitis and sinusitis. International Journal of General Medicine. 11:275-283. https://doi.org/10.2147/IJGM.S167123
- Hao, C., Yu, G., He, Y., Xu, C., Zhang, L., & Wang, W. (2019). Marine glycan–based antiviral agents in clinical or preclinical trials. Reviews in Medical Virology, 29(3), e2043. https://doi.org/10.1002/rmv.2043
- Harden, E. A., Falshaw, R., Carnachan, S. M., Kern, E. R., & Prichard, M. N. (2009). Virucidal activity of polysaccharide extracts from four algal species against herpes simplex virus. Antiviral Research, 83(3), 282-289. https://doi.org/10.1016/j.antiviral.2009.06.007
- Jia, H. P., Look, D. C., Tan, P., Shi, L., Hickey, M., Gakhar, L., … & McCray Jr, P. B. (2009). Ectodomain shedding of angiotensin converting enzyme 2 in human airway epithelia. American Journal of Physiology-Lung Cellular and Molecular Physiology, 297(1), L84-L96. https://doi.org/10.1152/ajplung.00071.2009
- Jiao, G., Yu, G., Zhang, J., & Ewart, H. S. (2011). Chemical structures and bioactivities of sulfated polysaccharides from marine algae. Marine Drugs, 9(2), 196-223. https://doi.org/10.3390/md9020196
- Koenighofer, M., Lion T., Bodenteich A., Prieschl-Grassauer, E., Grassauer A., Unger, H., Mueller C. A., Fazekas, T. (2014). Carrageenan nasal spray in virus confirmed common cold: individual patient data analysis of two randomized controlled trials. Multidisciplinary Respiratory Medicine. 9:57. https://doi.org/10.3201/eid0702.010220
- Lang, J., Yang, N., Deng, J., Liu, K., Yang, P., Zhang, G., & Jiang, C. (2011). Inhibition of SARS pseudovirus cell entry by lactoferrin binding to heparan sulfate proteoglycans. PLoS One, 6(8). https://doi.org/10.1371/journal.pone.0023710
- Lee, J. B., Hayashi, K., Maeda, M., & Hayashi, T. (2004). Antiherpetic activities of sulfated polysaccharides from green algae. Planta Medica, 70(09), 813-817. https://doi.org/10.1055/s-2004-827228
- Luescher-Mattli, M. (2003). Algae, a possible source for new drugs in the treatment of HIV and other viral diseases. Current Medicinal Chemistry-Anti-Infective Agents, 2(3), 219-225. https://doi.org/10.2174/1568012033483051
- Morokutti-Kurz, M., Graf, C. and Prieschl-Grassauer E. (2017). Amylmetacresol/2,4- dichlorobenzyl alcohol, hexylresorcinol, or carrageenan lozenges as active treatments for sore throat. International Journal of General Medicine. 10:53-60. https://doi.org/10.2147/IJGM.S120665
- Necas, J., & Bartosikova, L. (2013). Carrageenan: a review. Veterinarni Medicina, 58(4) 187-2015. http://vri.cz/docs/vetmed/58-4-187.pdf
- PAHO.org, Pan American Health Organzation, consultada el 21 de abril del 2020. https://www.paho.org/hq/index.php?option=com_content&view=article&id=15760:similarities-and-differences-covid-19-and-influenza&Itemid=1926&lang=es
- Radonić, A., Thulke, S., Achenbach, J., Kurth, A., Vreemann, A., König, T., … & Nitsche, A. (2011). Anionic polysaccharides from phototrophic microorganisms exhibit antiviral activities to Vaccinia virus. Journal of Antivirals and Antiretrovirals, 2, 051-055. https://doi.org/10.4172/jaa.1000023
- Shereen, M. A., Khan, S., Kazmi, A., Bashir, N., & Siddique, R. (2020). COVID-19 infection: origin, transmission, and characteristics of human coronaviruses. Journal of Advanced Research, 24, 91-98. https://doi.org/10.1016/j.jare.2020.03.005
- Sun, Q. L., Li, Y., Ni, L. Q., Li, Y. X., Cui, Y. S., Jiang, S. L., … & Dong, C. X. (2020). Structural characterization and antiviral activity of two fucoidans from the brown algae Sargassum henslowianum. Carbohydrate Polymers, 229, 115487. https://doi.org/10.1016/j.carbpol.2019.115487
- Thachil, J. (2020). The versatile heparin in COVID‐19. Journal of Thrombosis and Haemostasis, 18, 1020-1022. https://doi.org/10.1111/jth.14821
- The PharmaLetter, BRIEF—Marinomed receives EU nod for common cold therapy, 07-08-2018, https://www.thepharmaletter.com/in-brief/brief-marinomed-receives-eu-nod-for-common-cold-therapy
- Ueno, M., Nogawa, M., Siddiqui, R., Watashi, K., Wakita, T., Kato, N., … & Ariumi, Y. (2019). Acidic polysaccharides isolated from marine algae inhibit the early step of viral infection. International Journal of Biological Macromolecules, 124, 282-290. https://doi.org/10.1016/j.ijbiomac.2018.11.152
- Vicenzi, E., Canducci, F., Pinna, D., Mancini, N., Carletti, S., Lazzarin, A., … & Clementi, M. (2004). Coronaviridae and SARS-associated coronavirus strain HSR1. Emerging Infectious Diseases, 10(3), 413. https://doi.org/10.3201/eid1003.030683
- WoRMS Editorial Board (2020). World Register of Marine Species. Accessed 2020-04-05. https://doi.org/10.14284/170
- Wu, C., & Zheng, M. (2020). Single-cell RNA expression profiling shows that ACE2, the putative receptor of COVID-2019, has significant expression in nasal and mouth tissue, and is co-expressed with TMPRSS2 and not co-expressed with SLC6A19 in the tissues. BMC Infectious Disease (under review) https://www.researchsquare.com/article/rs-16992/v1
- Yim, J. H., Kim, S. J., Ahn, S. H., Lee, C. K., Rhie, K. T., & Lee, H. K. (2004). Antiviral effects of sulfated exopolysaccharide from the marine microalga Gyrodinium impudicum strain KG03. Marine Biotechnology, 6(1), 17-25. https://doi.org/10.1007/s10126-003-0002-z