El cerebro está compuesto por distintos tipos celulares, en los que se incluye a las neuronas, la glía (oligodendrocitos y astrocitos) y una pequeña población (10-15%) de macrófagos residentes (células del sistema inmune involucradas en la detección, fagocitosis y destrucción de bacterias y otros organismos dañinos), conocidos como microglía. Esta población de células, al contrario de lo que se creyó durante mucho tiempo, tiene funciones que van más allá de su participación en la inmunidad innata del cerebro, y su presencia y acciones son muy importantes durante el desarrollo fetal y a lo largo de la vida adulta.
La historia de la microglía se remonta a 1856, cuando el patólogo alemán Rudolf Virchow describió por primera vez la parte no neuronal del Sistema Nervioso Central (SNC), denominándolo “glía” (por la palabra griega “pegamento”); sin embargo, en ese momento, únicamente se concibió como un tipo de tejido conectivo que contenía distintos tipos celulares diferentes a las neuronas. Fue hasta 1919 que el neurocientífico español Pío del Río Hortega describió a la microglía por primera vez, proporcionando, además, un método de tinción que permitió diferenciarla de los otros tipos celulares del SNC.
Por mucho tiempo se creyó que la microglía y los macrófagos residentes de los distintos tejidos del cuerpo tenían el mismo origen; ahora se sabe que eso no es correcto. La microglía deriva de células progenitoras eritro-mieloides presentes antes del octavo día durante el desarrollo embrionario, en el saco vitelino. Estas células migran al cerebro antes de su vasculogénesis (la formación de novo de vasos sanguíneos), y persisten en el cerebro a lo largo de toda la vida del individuo. Por su parte, los macrófagos fuera del SNC provienen de progenitores mieloides eritroides, que también nacen del saco vitelino en una etapa más tardía y que después migran al hígado fetal donde darán lugar a monocitos intermediarios.
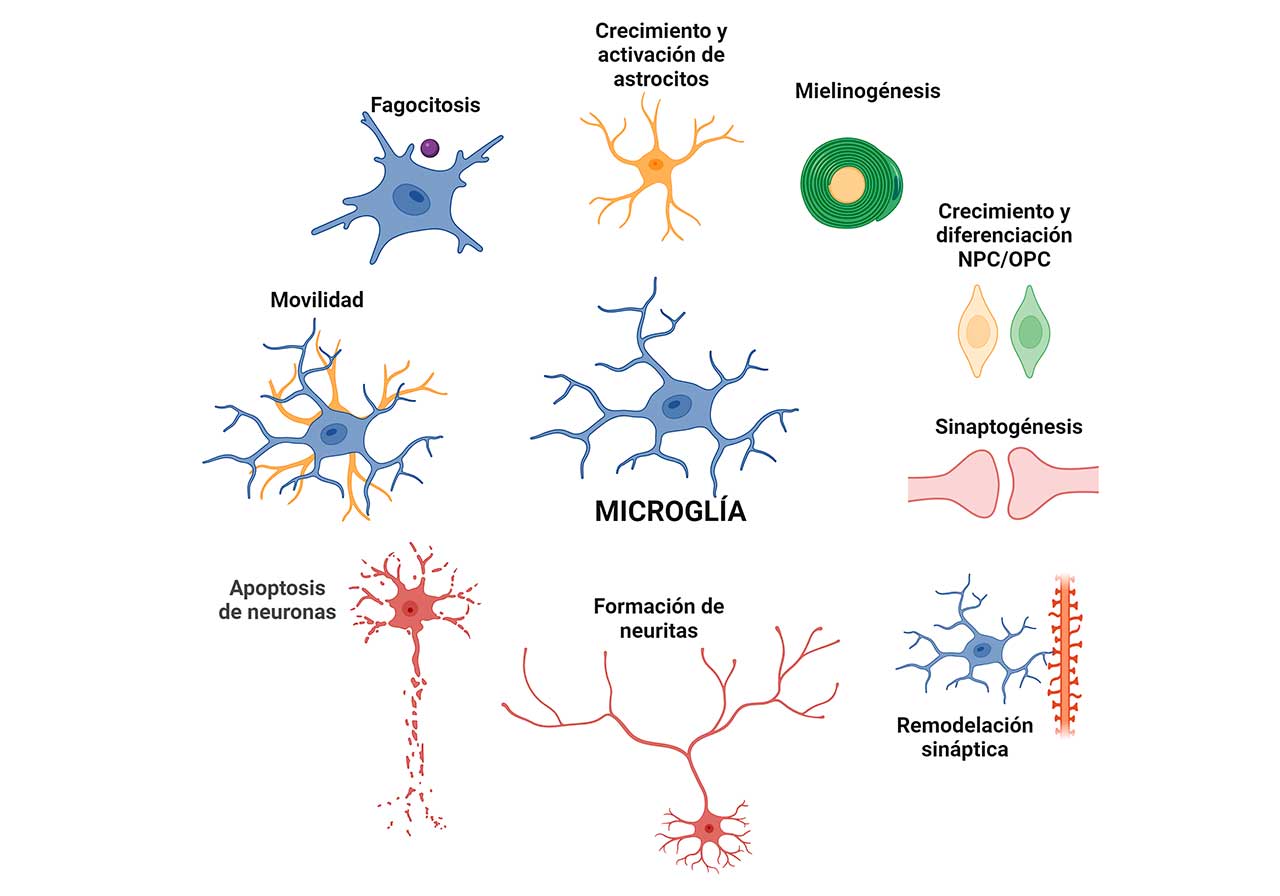
Las funciones de la microglía no se limitan a su papel en la vigilancia inmune y en el cerebro sano; tiene papeles homeostáticos durante el desarrollo fetal y posnatal, así como a lo largo de la vida. De hecho, la morfología de la microglía puede cambiar en cada uno de estos estadios, y se ha reportado que esos cambios morfológicos correlacionan con perfiles de expresión transcriptómicos distintivos.
Durante el desarrollo embrionario y el estadio posnatal temprano, la microglía realiza distintas funciones. Algunas de ellas son la fagocitosis activa y la remodelación de tejido neural, el establecimiento de la arquitectura neuronal del SNC. Además, controla la abundancia, la remoción del exceso y la inducción de las Células Progenitoras Neurales (NPCs). Se ha reportado que la microglía también participa en el proceso de neurogénesis, estimulándola al promover la supervivencia, proliferación y maduración de las NPCs hacia las neuronas. Por otra parte, se sabe que interviene en la poda sináptica (proceso por el que se eliminan a las neuronas extra y a las conexiones sinápticas, para incrementar la eficiencia de la transmisión de la señal neuronal), y en la mielinogénesis (formación de las láminas de mielina).
En la etapa adulta de los individuos, la microglía tiene funciones de censado permanente, lo que le permite actuar de forma inmediata cuando se detecta alguna lesión o la presencia de algún agente tóxico o patogénico. Una función muy importante de la microglía es el mantenimiento de la homeostasis, participando en la remodelación sináptica, la migración a sitios de muerte neuronal para fagocitar células muertas o en proceso de apoptosis, para eliminar los restos celulares de las células muertas y para mantener también homeostasis de la mielina. Igualmente participa en la eliminación de patógenos infecciosos, en los depósitos de proteínas que se forman en diferentes patologías como: el amiloide beta (Aβ) en la Enfermedad de Alzheimer, la α-sinucleína en la enfermedad de Parkinson, la huntingtina mutada en la enfermedad de Huntington, entre otras; para llevar a cabo estos procesos activa una respuesta neuro inflamatoria.
Las células de la microglía nunca descansan, están permanentemente censando, manteniendo la homeostasis, y protegiendo al cerebro de cualquier estímulo extraño o agente agresor. Sin embargo, puede surgir un problema cuando alguna de estas funciones se desregula, lo que puede causar que los efectos benéficos que tiene la microglia se alteren e induzcan un proceso de neurodegeneración, como llega a ocurrir en la enfermedad de Alzheimer.
La enfermedad de Alzheimer (EA) es padecimiento neurodegenerativo que se caracteriza por la presencia de placas amiloides extracelulares y de ovillos neurofibrilares dentro de las neuronas. Las placas están formadas de agregados de la proteína Aβ, y los ovillos son agregados de la proteína tau hiperfosforilada (p-Tau). Los cambios patológicos en los individuos con EA, dan lugar al declive cognitivo y atrofia del cerebro. Los mecanismos moleculares implicados en el desarrollo de la patología aún no son claros, y aunque se han considerado distintos aspectos para explicar su progresión, todos coinciden en que uno de los mecanismos con mayor influencia en el proceso patofisiológico es la neuroinflamación.
La neuroinflamación es un proceso de defensa que protege al cerebro. Se activa como una respuesta inflamatoria que promueve la reparación del tejido dañado y la eliminación de los agentes tóxicos y los restos celulares. Sin embargo, puede volverse perjudicial si se descontrola y si se mantiene en un estado de activación permanente.
¿Cómo es que la microglía contribuye a la progresión de la EA?
Se cree que la presencia de los oligómeros del Aβ puede promover la hiperfosforilación de proteína tau y la formación de los ovillos neurofibrilares, lo cual induce el proceso de neurodegeneración. En esa primera etapa, la microglía se encarga de eliminar a los oligómeros, y con ello evita la hiperfosforilación de Tau. No obstante, cuando los oligómeros del Aβ se acumulan y agregan para formar las placas neuríticas, se activa a la microglía induciendo el proceso de neuroinflamación activo y permanente, exacerbando el daño neuronal y el declive cognitivo. Se cree que en las primeras etapas, la microglía protege y controla la neuroinflamación.
En la EA ,una vez que se desequilibra la producción de los péptidos Aβ y se genera más Aβ42 y menos Aβ40, se empieza a oligomerizar y acumular en el espacio extracelular, alterando la función neuronal. La microglía en esa etapa se encargará de la eliminación de esos oligómeros (clearance), mediante la fagocitosis y la endocitosis, a través de sus Receptores Scavenger (SRs). Es probable el Aβ actúe como lo hacen las moléculas relacionadas a un patrón molecular asociado a daño (DAMP) y que se una a distintos receptores como: los tipo Toll (TLRs), los receptores para producto de glicación avanzada (RAGE), y los receptores de unión a dominios parecidos a nucleótidos (NLRs, nucleotide-binding oligomerization domain-like receptors). Una de las moléculas vinculadas a este proceso y que ha sido mayormente descrita es TREM2. Esta molécula es un receptor que pertenece a las moléculas de la inmunidad innata y se expresa en distintas células del sistema inmune, incluida la microglía.
Cuando el receptor TREM2 interactúa con la proteína adaptadora DAP12, se desencadena una transducción de señal que promueve la quimiotaxis (desplazamiento), fagocitosis, supervivencia y proliferación de la célula. La eliminación vía fagocitosis de los depósitos del Aβ, está mediada por este receptor y el proceso es aún más eficiente cuando el Aβ está forma un complejo con otras lipoproteínas, como la apolipoproteína E (ApoE) (proteína involucrada en el metabolismo de grasas en los mamíferos).
Otra de las funciones de la microglia que podría ayudar a controlar la enfermedad, es la formación de una barrera protectora alrededor de los depósitos amiloides, compactando las fibras amiloides a una forma más empaquetada y menos tóxica, previniendo así la unión de los nuevos péptidos de Aβ a las placas menos compactas existentes y evitando la formación de más placas neuríticas. Esto podría ser un mecanismo que limitaría la neurotoxicidad de los depósitos amiloides una vez que se empiezan a acumular en el cerebro envejecido.
Se sabe que el Aβ puede interactuar directamente con microglía y esa interacción la activa, lo que provoca pérdida temprana de sinapsis, producción de especies reactivas de oxígeno (ROS) y nitrógeno (NOS), activación del inflamosoma y la producción de citocinas pro inflamatorias, como el TNFa. El proceso inflamatorio atrae y recluta a más microglía activa, iniciando un proceso de neuroinflamación descontrolado.
Cuando la acumulación del Aβ sobrepasa la actividad de la microglía para eliminarlo, no se logra eliminar a estos agregados, provocando un aumento en la deposición del Aβ, lo que produce una inflamación crónica. La presencia de citocinas proinflamatorias reduce la actividad clearance de la microglía y la liberación de una proteína adaptadora ASC (apoptosis-associated speck-like protein containing a CARD) que se une al Aβ y causa más agregación de Aβ. La microglía activada promueve la hiperfosforilación de la proteína Tau, que a su vez lleva a la formación de los ovillos neurofibrilares. Esto causa la pérdida de la función neuronal, apoptosis y la activación de otras células del sistema inmunes.
Durante las etapas tempranas de la enfermedad, la microglía juega un papel importante de ayuda para controlar el desbalance producido por la afección. Sin embargo, luego progresa hacia células disfuncionales que dañan a las neuronas al perder el control del proceso de inflamación. Las distintas subpoblaciones de microglía que han sido identificadas en la EA, nos habla de esta transición: homeostática, intermedias y microglía asociada a enfermedad (DAM, disease-associated microglía). Estas DAMs, son células neuro protectoras que limpian al cerebro de los depósitos del Aβ.
Aunado a lo anterior, se encontró también otro subtipo de DAM en modelos de ratones viejos y de distintas enfermedades neurodegenerativas, que es inducida por fagocitosis de las neuronas apoptóticas. Este último tipo de DAM se encuentra cerca de las placas amiloides y presenta una disminución en la expresión de genes de censo y mantenimiento de la homeostasis y un aumento en los genes relacionados a la neurodegeneración.
Como se ha mencionado, la microglía tiene un papel muy importante en el desarrollo y en la homeostasis durante la vida adulta, pero cuando hay algún detonante de su actividad, como la acumulación del Aβ en la EA, puede causar su descontrol e hiperreactividad. En la EA tiene una actividad dual: por una parte, ayuda a controlar la enfermedad al promover la fagocitosis, el clearance, y a limitar la toxicidad del Aβ; pero por otra parte, cuando la microglía se sobre activa, se inducen mediadores de inflamación que causarán daño en el cerebro de los pacientes.
Referencias
Gao, C., Jiang, J., Tan, Y. & Chen, S. (2023). Microglia in neurodegenerative diseases: mechanism and potential therapeutic targets. Signal Transduction and Targeted Therapy, 8(359), 1-37.
Prinz, M., Jung, S. & Priller, J. (2019). Microglia Biology: One Century of Evolving Concepts. Cell, 179, 292-311.
Wolf, S. A., Ketternmann, B. & Ketternmann, H. (2017). Microglia in Physiology and Disease. Annual Review of Physiology, 79, 619-643.
Foto de portada: CC por GerryShaw
Wright-Jin, E. C., & Gutmann, D. H. (2019). Microglia as Dynamic Cellular Mediators of Brain Function. Trends In Molecular Medicine, 25(11), 967-979