El hierro o fierro (Fe) es el cuarto elemento más abundante sobre la Tierra, asociado con la vida por ser un nutriente esencial para la mayoría de los seres vivos; sin embargo, es poco soluble y puede ser altamente tóxico cuando está libre (no unido a proteínas o agentes quelantes). Desde bacterias hasta mamíferos, las células han desarrollado estrategias para mantener el hierro libre al nivel más bajo posible para evitar su toxicidad, en concentraciones que les permitan realizar sus múltiples funciones y en forma soluble. En esta regulación del hierro participan moléculas especializadas, sobre todo proteínas, para su adquisición y transporte a todas las células (transferrina, lactoferrina). Otras funciones las realizan las hemoproteínas para el transporte de electrones (citocromos) y de oxígeno (hemoglobina y mioglobina), el metabolismo (enzimas que requieren hierro para su actividad) y el almacenamiento de hierro (ferritina). El hierro es necesario en el metabolismo energético al formar parte de la aconitasa mitocondrial y de proteínas hierro-azufre, así como en la síntesis de ADN. La transferrina (Tf) fue evolutivamente desarrollada para la captación de hierro férrico. Además, al capturar el hierro, impide que los patógenos lo adquieran para sobrevivir, colonizar e invadir al hospedero.
Sin embargo, los patógenos pueden relacionarse en dos formas con Tf, si ésta no tiene hierro (apoTf) puede ser microbiostática, aunque si tiene hierro unido (holoTf), esta proteína puede ser utilizada como fuente de hierro para su crecimiento. La capacidad de utilizar el hierro de las proteínas está relacionada directamente con su virulencia. Los organismos más virulentos pueden crecer en presencia de holoTf aunque ésta tenga poca cantidad de hierro, mientras que los menos virulentos son inhibidos por apoTf.
Debido a que el hierro tiene muy baja biodisponibilidad y existe deficiencia de éste en la alimentación de la mayoría de la población, se considera un problema de salud pública. Para contrarrestar esta carencia, se han hecho esfuerzos para proporcionar hierro sobre todo a niños y mujeres embarazadas, fortificando los alimentos con sales de hierro. No obstante, el exceso al que se está exponiendo a las personas y a los microorganismos que viven en ellas, podría llegar a ser un problema en la carrera evolutiva de la relación hospedero-parásito y aumentar el riesgo de enfermedades infecciosas.
La concentración de hierro en suero permanece en equilibrio con la concentración de hierro almacenado en el hígado. Del hierro que se consume en la dieta (15 mg diarios aproximadamente), solo el 10% se absorbe en el intestino delgado. Una vez que se encuentra dentro de las células, su destino depende de la cantidad dentro de ellas. Si requiere ser exportado, será transformado por ferroxidasas de su forma ferrosa a la férrica, para que la Tf lo una en la mucosa intestinal y lo transporte hacia las células del organismo que requieran hierro. En la Figura 1 se muestra la estructura tridimensional de la Tf. La molécula presenta un surco profundo que contiene el sitio de unión de este elemento y del anión carbonato, que le ayuda a unir el hierro.
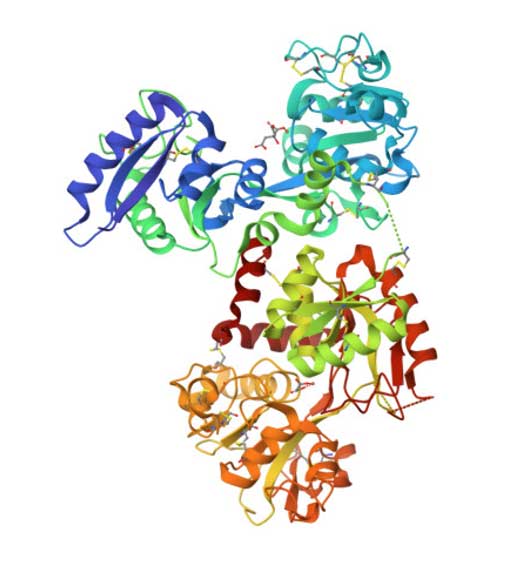
La transferrina puede unir dos iones de hierro férrico, pero normalmente solo del 20 al 40% de los sitios de unión están ocupados por hierro. El porcentaje de saturación de Tf es un indicador del estado general de hierro en el organismo; una Tf saturada al 100% denota que existe una sobrecarga de hierro. Las células del organismo que tienen necesidad de hierro presentan un receptor para Tf en la superficie celular, el cual está en cantidad proporcional a su necesidad. Cuando la Tf férrica (holoTf) se une a su receptor, se internaliza en la célula dentro de endosomas de reciclaje.
El ciclo de la Tf humana consta de la internalización del complejo holoTf-receptor, la liberación del hierro dentro del endosoma por el pH ácido de este organelo y el reciclaje del complejo apoTf-receptor (sin Fe) hacia la superficie celular. A pH neutro, apoTf se disocia del receptor y se recicla para la obtención de hierro. El receptor puede ser liberado a su forma soluble hacia el espacio extracelular. Solo el hierro férrico es transportado hacia el citoplasma o a la mitocondria. Debido a su citotoxicidad, el hierro se une a proteínas chaperonas que lo transportan hacia la ferritina, una proteína intracelular que puede almacenar hasta 4,500 átomos de Fe.
Transferrina y Entamoeba histolytica
Entamoeba histolytica (Fig. 2) es un protozoario parásito que afecta al 10% de la población mundial, causando amibiasis. Es una infección de muy alta prevalencia que se presenta con varios grados de severidad, desde una infección asintomática hasta la invasión de varios órganos. Esta infección causa la muerte de 40,000 a 100,000 personas por año por amibiasis invasiva y de más de 55,000 por amibiasis intestinal aguda. Esta enfermedad es más común en áreas tropicales donde pueden existir condiciones de hacinamiento e insalubridad, siendo mucho más común en África, México, India y algunos países de Sudamérica. En México, hasta el año 2000 la incidencia de amibiasis intestinal fue de 5000 casos por cada 100,000 habitantes, anualmente.
Los síntomas de la amibiasis intestinal consisten en dolor abdominal y colitis, con presencia de moco y sangre en heces (disentería). Durante la infección, las amibas pueden viajar hacia el hígado y producir absceso hepático, enfermedad que lleva a más de 10 mil casos al año en algunos estados de la República Mexicana (como Sonora, con 13.4%; Sinaloa, 11.37% y Nayarit, 10.11% por ejemplo). La infección puede alcanzar pulmón y cerebro. Existe otra amiba morfológicamente similar, Entamoeba dispar, que infecta al ser humano y vive como comensal en el intestino, ocasionando infecciones generalmente asintomáticas.
El ciclo de vida de E. histolytica es muy sencillo, consta de dos fases, quistes infectivos y trofozoítos invasivos. El parásito requiere de hierro para sobrevivir dentro de su hospedero. Al encontrarse en concentración muy baja y la mayoría unido a proteínas, no consigue hierro suficiente para su crecimiento, por lo que este parásito ha desarrollado varios mecanismos para obtenerlo. En respuesta, el hospedero ha perfeccionado la forma de mantener al hierro lejos del alcance de la amiba.
En el proceso de colonización e invasión, E. histolytica encuentra diferentes condiciones ambientales y varias proteínas ferrosas o férricas para alimentarse. Durante la invasión del intestino y tejidos, el parásito enfrenta a la lactoferrina, proteína que une hierro en la mucosa intestinal. También cuenta con el hierro contenido en las células de descamación, además de eritrocitos y células apoptóticas y necróticas en el caso de invasión. En el hígado, el hierro se encuentra en altas concentraciones en forma intracelular almacenado en ferritina, que también puede ser fuente de hierro para la amiba. En el torrente sanguíneo, durante la invasión de otros órganos y tejidos, tiene acceso al hierro de hemoglobina al romper los eritrocitos y al de la holoTf en el plasma. En este proceso de invasión la obtención de hierro de holoTf es indispensable, pues no hay otra fuente de hierro extracelular libre. En nuestro laboratorio, hemos encontrado que este parásito tiene altos requerimientos de Fe (80-100 µM); es necesario adicionarle citrato férrico al medio de cultivo para su crecimiento in vitro. Cuando investigamos si es capaz de usar holoTf humana como única fuente de hierro, se encontró que la utiliza y además puede crecer al mismo nivel que con citrato férrico.
Este resultado nos llevó a la búsqueda de alguna proteína de unión o un receptor para holoTf humana en E. histolytica. Para identificar esa proteína, se hicieron experimentos de microscopía confocal, inmunotransferencia y citometría de flujo, con un anticuerpo monoclonal dirigido contra el receptor de Tf humana. Curiosamente, este anticuerpo identificó una proteína en la superficie celular del trofozoíto. Cuando se colocó al parásito en presencia de holoTf, internalizó el complejo (receptor-holoTf) dentro de vesículas cubiertas de clatrina. Es notable que el receptor no mostró afinidad por apoTf y, por tanto, ésta no se internalizó.
El receptor amibiano que reconoce holoTf humana es una proteína multifuncional, pues participa en el metabolismo fermentativo de la glucosa y se une a proteínas de la matriz extracelular, como fibronectina. Posteriormente se purificó por inmunoprecipitación y se identificó por espectrometría de masas como la enzima acetaldehído/alcohol deshidrogenasa-2 (EhADH2). Este receptor es específico de holoTf, ya que no une lactoferrina, una proteína de la familia de las Transferrinas, que tiene 60% de homología con Tf a nivel de aminoácidos.
En experimentos de cinéticas de unión de holoTf a la superficie amibiana, se encontró que la unión depende de la temperatura (37 °C) y de la concentración de holoTf, ya que, si la concentración de holoTf es alta, el receptor se satura y no la internaliza. La holoTf ingresa junto con el receptor. Una vez que la enzima/receptor ha unido holoTf, se activa el sistema celular de señales para que el complejo se internalice y sea conducido primeramente hacia los endosomas tempranos, donde la holoTf libera el hierro y es muy probable que el receptor se recicle hacia la superficie (Fig. 3). A diferencia del receptor humano, en la amiba la apoTf resultante llega finalmente a los lisosomas, pues se observó co-localización de apoTf y un anticuerpo que reconoce un marcador de lisosomas. La apoTf fue degradada, aunque todavía no se conoce qué proteasas llevan a cabo la degradación.

Por ello la importancia de conocer y estudiar las proteínas receptoras de holoTf en parásitos. Durante una infección sistémica, hay una correlación con cambios en el estado general del hierro en el organismo debido a alguna condición patológica, lo que manifiesta la importancia del hierro en las infecciones.
Transferrrina, Entamoeba histolytica y factores de virulencia
La relación entre la obtención del hierro y la expresión de los factores de virulencia ha sido poco estudiada en E. histolytica. Hasta el momento, se sabe que el hierro es necesario para la secreción del amebaporo, que es el conjunto de proteínas amibianas que hacen poros en las células del hospedero, destruyéndolas.
El hierro también participa de manera muy importante en la expresión de lectinas de adhesión a las células y la actividad de las proteasas sobre diferentes proteínas del hospedero. Todas estas son acciones importantes para la virulencia de la amiba, su adhesión y el daño que causa a las células para iniciar la colonización.
La internalización de holoTf y la liberación del hierro dentro del citoplasma, permiten que se lleve a cabo una serie de señales dentro de la amiba, que promueven el crecimiento y la división celular. Al tener las condiciones adecuadas para sobrevivir, los factores de virulencia se pueden expresar adecuadamente.
Es de destacar la importancia que ha tenido el hierro para la amiba a través del tiempo, pues al mantener una relación tan estrecha con el hospedero, el parásito ha desarrollado mecanismos de obtención de este elemento muy eficientes, que ponen a prueba los sistemas desarrollados en los mamíferos para mantenerlo alejado de los patógenos. La sobrevivencia de los parásitos dentro de su hospedero requiere de la habilidad para identificar y responder a los retos del medio ambiente, que enfrentan para continuar evolucionando junto con el ser humano.
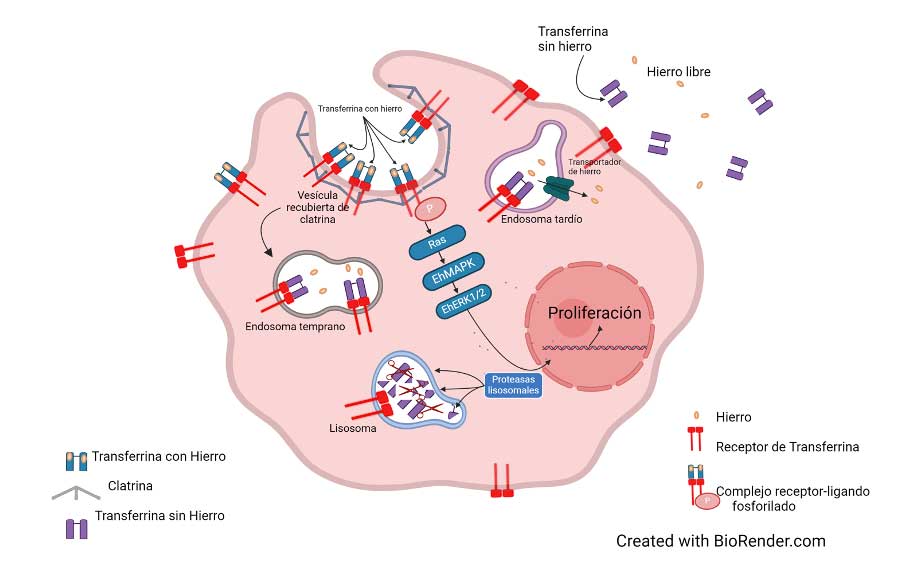
El mecanismo de obtención de hierro en E. histolytica (Fig. 4) y las proteínas que participan, son lo suficientemente diferentes a lo observado en los mamíferos, por lo que pueden ser tomados en cuenta para propósitos terapéuticos. Del mismo modo, al bloquear el receptor para evitar el reconocimiento y la unión de holoTf, podría ser un buen método de control profiláctico de la infección, al evitar que E. histolytica obtenga el hierro indispensable. En resultados preliminares del laboratorio, se observó que el receptor amibiano para holoTf es reconocido por sueros de pacientes con amibiasis, de modo que se generan anticuerpos contra esta proteína. Este resultado sugiere que podría utilizarse para desarrollar una vacuna que impida la infección o para bloquear la obtención de hierro por parte del receptor y por tanto su internalización.
Agradecimientos
Agradecemos el apoyo técnico para el uso y obtención de las imágenes de microscopía confocal a la Dra. María Asunción Cabañas Cortés.
Bibliografía
Carrero, J.C., et al. (2020). Intestinal amoebiasis: 160 years of its first detection and still remains as a health problem in developing countries. International Journal of Medical Microbiology. 310(1), 151358. doi: 10.1016/j.ijmm.2019.151358.
Reyes-Lopez, M., et al. (2011). Acetaldehyde/alcohol dehydrogenase-2 (EhADH2) and clathrin are involved in internalization of human transferrin by Entamoeba histolytica. Microbiology (UK). 157(Pt 1), 209-219. doi: 10.1099/mic.0.040063-0.
Reyes-Lopez, M., et al. (2020). Endocytosis, signal transduction and proteolytic cleaving of human holotransferrin in Entamoeba histolytica. International Journal for Parasitology. 50(12), 959-967. doi: 10.1016/j.ijpara.2020.05.013.
Reyes-López, M., et al. (2015). Transferrin: Endocytosis and cell signaling in parasitic protozoa. BioMed Research International. 2015, 641392. doi: 10.1155/2015/641392.












