La Enfermedad de Alzheimer (EA) es una condición cerebral que deteriora progresivamente la memoria, el lenguaje, y el comportamiento de las personas. Aunque esta enfermedad se ha asociado a la vejez, ya que es más frecuente en los adultos mayores, no es una característica natural del envejecimiento; más bien, es una enfermedad caracterizada por un conjunto de anomalías que provocan la acumulación de agregados proteicos en el cerebro, formados por péptidos amiloide-beta y de la proteína Tau, que finalmente provocan la muerte de las células neuronales.
La EA depende de múltiples factores para su desarrollo, y en la actualidad, no existe cura; por lo tanto, los tratamientos prescritos por el sector salud solo se enfocan en aliviar los síntomas del paciente para mejorar su calidad de vida y retrasar la dependencia. Algunos fármacos, como el Donepezilo, la Galantamina y la Rivastigmina, que son inhibidores de la enzima colinesterasa, promueven el reciclaje de la acetilcolina, un neurotransmisor que tiene varias funciones importantes tanto físicas (contracción muscular), psicológicas y cerebrales.
Sin embargo, ya que en la EA los niveles de esta molécula disminuyen en relación con la muerte de las células neuronales, es posible que estos medicamentos solo sean efectivos en etapas tempranas de la enfermedad, ya que la acetilcolina terminará degradándose y cada vez habrá menos células para producirla.
En este sentido, la muerte neuronal también trae consigo la muerte de otras células, ya que las células sanas son expuestas a un exceso del neurotransmisor glutamato, el cual es liberado por las células lesionadas o dañadas; en respuesta, las células activan el tráfico de calcio hacia el interior durante tiempos más prolongados, lo que provoca su hinchamiento y ruptura.
Para disminuir el impacto de este círculo vicioso, se han desarrollado fármacos que se unen a los mismos receptores que utiliza el glutamato para ser reconocido en la membrana celular, llamados receptores N-metil-D-aspartato, o por sus siglas, NMDA, tal como la Memantina, un medicamento que previene el deterioro y la muerte neuronal en la EA, y que además, de acuerdo con la FDA, se puede administrar en conjunto con ciertos inhibidores de la colinesterasa, como el Donepezilo, para obtener mejores resultados en el tratamiento. Sin embargo, estos medicamentos presentan muchos efectos secundarios y además representan un “alivio” temporal porque el deterioro cognitivo no se detiene.
Afortunadamente, la investigación sigue avanzando en el desarrollo de estrategias para interferir con los mecanismos que producen la EA, sobre todo para prevenir su progresión en etapas tempranas. En la actualidad, solamente existe una estrategia que se acerca a este objetivo, la cual se denomina inmunoterapia pasiva.
Esta terapia se basa en el reconocimiento inmunológico de los agregados proteicos utilizando ciertas proteínas llamadas “anticuerpos monoclonales”, los cuales, al unirse a los agregados de péptidos amiloide beta o de proteína Tau, ayudan a que éstos sean reconocidos y eliminados por las células del sistema inmune.
Para la eliminación de los agregados del péptido amiloide beta, se conocen dos medicamentos prometedores, Lecanemab y Aducanumab. Aunque ambos concluyeron los ensayos clínicos fase III, este último, ha sido el único aprobado por la FDA como tratamiento para pacientes con deterioro cognitivo y demencia leves causada por enfermedad de Alzheimer. Sin embargo, aunque se demostró que reducía los agregados maduros de amiloide beta, también llamadas placas amiloides, no se reunieron suficientes evidencias para asegurar una reducción del deterioro cognitivo en los pacientes.
En el caso de los agregados de la proteína Tau aberrante, los anticuerpos monoclonales más conocidos son Gosuranemab, Tilavonemab, Semorinemab y Zagotenemab; no obstante su uso como tratamiento aún está en investigación de ensayos clínicos fase II.
Uno de los retos que enfrentan los investigadores con este tipo de estrategia es que los neurofármacos logren atravesar las barreras que posee el cuerpo, para asegurar una dosis terapéutica del medicamento, principalmente porque puede sufrir degradación desde el lugar de administración hasta el sitio de acción.
Una de estas barreras es la barrera hematoencefálica (BHE), la cual es una estructura que impide el contacto de la sangre periférica con el parénquima cerebral, y por ello, es la encargada de regular el tráfico de metabolitos energéticos y nutrientes que llegan a las neuronas. Por esta razón se empezó a utilizar la nanotecnología para desarrollar diferentes sistemas de liberación de moléculas terapéuticas. Esta ciencia tiene como objetivo diseñar, producir y utilizar materiales con al menos una dimensión comprendida entre 1 y 100 nm, lo que es interesante dado que las proteínas y los ácidos nucleicos tienen el mismo rango de tamaño.
Para atravesar la BHE, se han desarrollado nanopartículas de diferente naturaleza, por ejemplo: metálicas, que incluyen oro, serio, selenio, hierro y molibdeno; poliméricas, tales como el quitosano, el poli(ácido-lacto-co-glicólico) o PLGA, el polietilenglicol o PEG, y los dendrímeros; también de tipo lipídicas; y finalmente, híbridas, es decir, la combinación de dos o más de estos materiales.
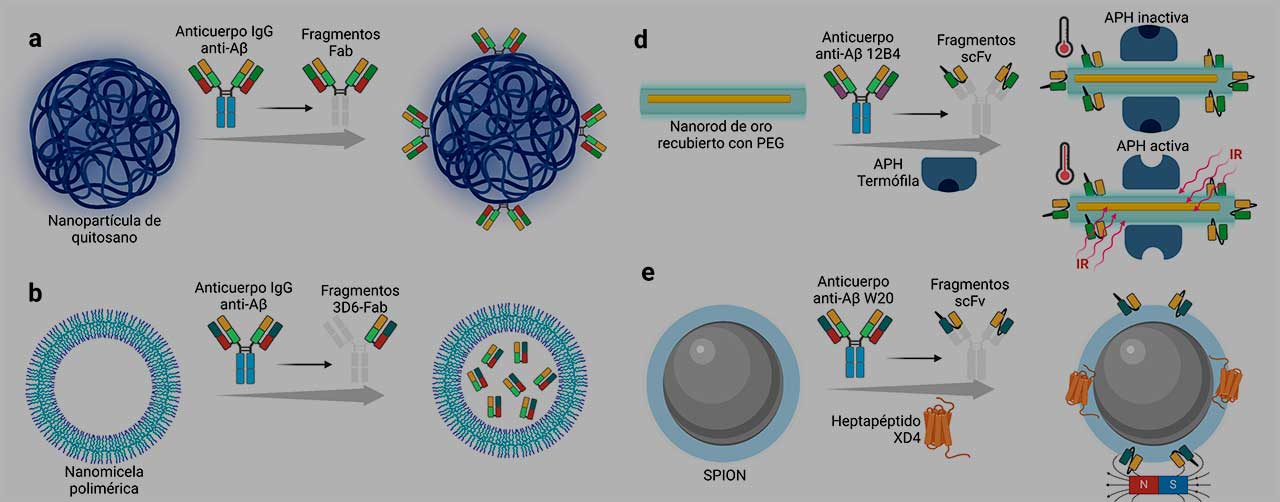
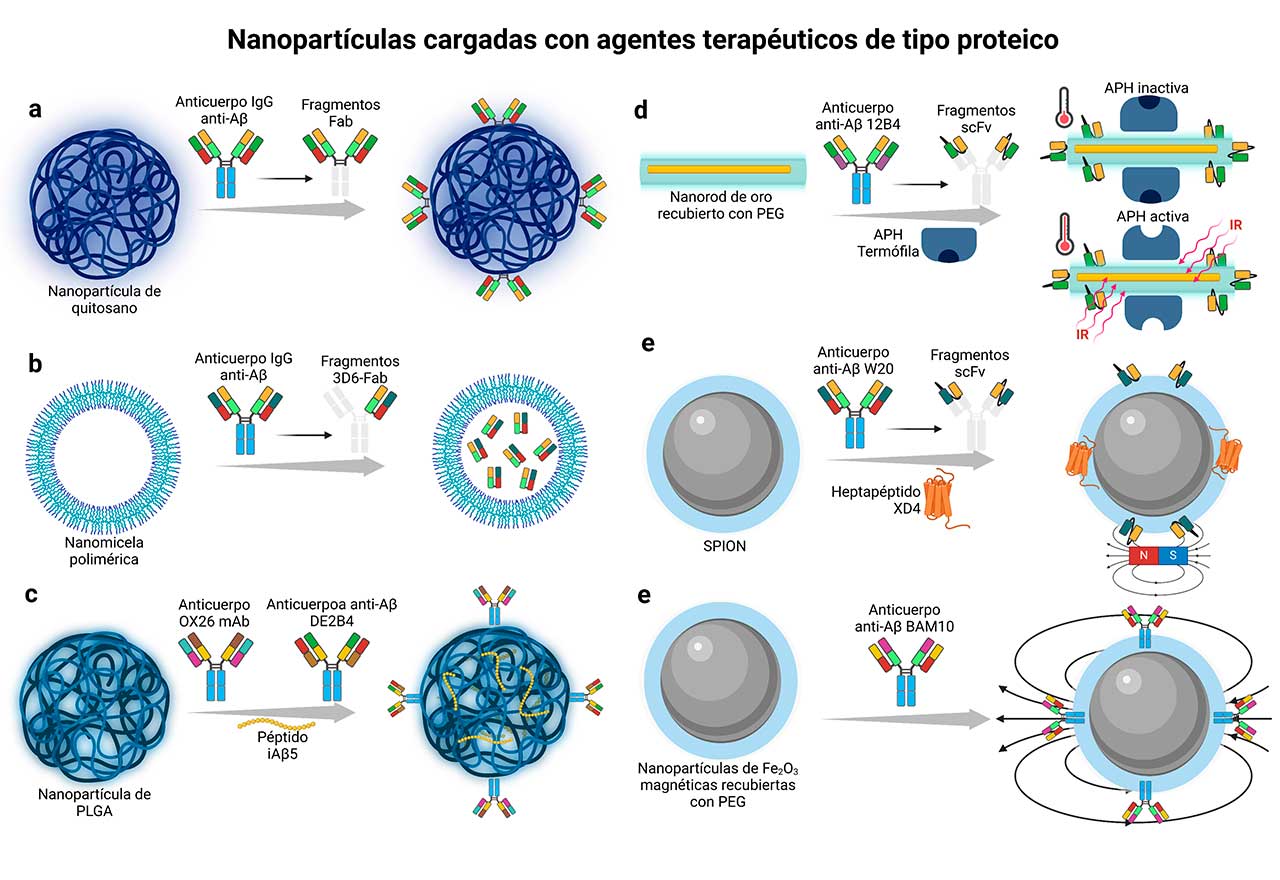
Nanopartículas cargadas con agentes terapéuticos de tipo proteico
Estas nanopartículas se han desarrollado con la finalidad de mejorar la inmunoterapia pasiva. En general, se toma un anticuerpo o fragmentos de él, con la capacidad de reconocer agregados del péptido amiloide beta (Aβ) y se unen a las nanopartículas, ya sea en la superficie o al interior de ellas:
Polímero-proteicas
Algunas de las estrategias para lograrlo, son, por ejemplo, el uso de las nanopartículas poliméricas, como por ejemplo, las de quitosano, un polímero que se obtiene a partir de la desacetilación parcial de la quitina. Estas nanopartículas son recubiertas con fragmentos de unión al antígeno (Fab) de un anticuerpo IgG anti-Aβ, tal como se muestra en la Figura 1a; con lo cual, se incrementa la biocompatibilidad por la BHE y se promueve la eliminación de los depósitos de amiloide beta debido al reconocimiento molecular que le confieren los fragmentos del anticuerpo.
Otra estrategia, son las nanopartículas poliméricas micelares, las cuales se sintetizan a partir de polímeros complejos anfipáticos, es decir, que en su estructura molecular tienen una región soluble en agua y otra insoluble. Estas nanopartículas encapsulan un gran número copias de un solo fragmento Fab del anticuerpo anti-Aβ, llamados fragmentos 3D6-Fab, tal como se muestra en la Figura 1b. Los resultados muestran que el uso de estas nano-micelas poliméricas aumentan 41 veces el ingreso de los fragmentos del anticuerpo al cerebro.
Por otro lado, también se han desarrollado nanopartículas a base de un polímero sintético de ácido-lacto-co-glicólico, llamado PLGA, el cual ha sido el único polímero sintético aprobado por la FDA para el desarrollo de sistemas de liberación de fármacos en humanos. Estas nanopartículas brindan varios beneficios, incluyendo una mayor capacidad de carga de fármacos, flexibilidad de unión a diferentes tipos de moléculas, biocompatibilidad y menor toxicidad.
La estrategia para tratar la EA con este tipo de polímero se basa en un enfoque múltiple, para ello, dos anticuerpos diferentes se unen a la superficie de las nanopartículas de PLGA. El primero, el anticuerpo OX26 mAb, que reconoce y se une a un receptor de superficie celular situado en el endotelio capilar del cerebro, llamado receptor de transferrina; y el segundo, el anticuerpo DE2B4, que reconoce al péptido amiloide beta (Aβ) y a la proteína precursora de amiloide (APP); además, también se incluye al péptido iAβ5, que es un disruptor de la conformación beta o lámina plegada del péptido Aβ, tal como se representa en la figura 1c. Con lo anterior, se asegura que las nanopartículas ingresen al parénquima cerebral con alta biodisponibilidad, puedan reconocer depósitos de amiloide beta, y al unirse a ellos, los péptidos iAβ5 bloquean su autoensamblaje para evitar la agregación. Otra estrategia terapéutica es el uso de nanopartículas de PLGA para fijar a la proteína de unión a Vitamina-D, también llamada GC-globulina, este complejo se ha evaluado en ratones que sobreexpresan el Aβ (5XFAD), y se ha observado que disminuye la agregación y acumulación de Aβ.
Metalicas-proteicas
Otra estrategia emplea nanopartículas metálicas, ya que, por el contrario de las nanopartículas poliméricas, es más fácil manipular su tamaño y forma para favorecer la biocompatibilidad por la BHE, además de que es posible unir proteínas complejas como las enzimas.
En este sentido, las nanopartículas de oro han sido las más utilizadas, debido a que son biocompatibles, estables, se pueden bioconjugar y funcionalizar con casi cualquier tipo de molécula, además de que tienen propiedades ópticas que permiten monitorear su actividad o cambiar sus propiedades físicas. Para este caso, se han desarrollado nano-varillas de oro recubiertas con PEG, que posteriormente sirven de anclaje para fragmentos variables de cadena única (scFv) del anticuerpo 12B4 anti-Aβ, y, además, de la enzima termófila acil-péptido hidrolasa, APH, la cual participa en la degradación y procesamiento de proteínas dentro de las células, este modelo se representa en la figura 1d. Estas nanopartículas establecen un complejo con formas aberrantes del péptido amiloide beta (oligómeros y fibras), y al irradiarlas con luz infrarroja, vibran y generan calor, lo que permite que la enzima se active y pueda destruir los agregados del amiloide beta en un sitio específico, reduciendo el daño en otros tejidos.
Otra clase de nanopartículas metálicas son las de óxido de hierro superparamagnético (SPION), las cuales se utilizan comúnmente como agentes de contraste para obtener imágenes con resonancia magnética. Las nanopartículas de este tipo se pueden recubrir con polietilenglicol (PEG) para anclar fragmentos variables de cadena única (scFv) del anticuerpo anti-Aβ W20, el cual reconoce a los oligómeros de amiloide beta. Además, con la adición de un heptapétido XD4 que activa al receptor eliminador de clase A (SR-A) en la microglía (Figura 1e), se promueve la inhibición significativa de la agregación y la citotoxicidad, y en respuesta a ello, se activa la producción de citoquinas inflamatorias en células BV-2. Otra clase de nanopartículas de este tipo, son las de óxido de hierro magnéticas. En este caso, las nanopartículas se recubren con PEG, y se funcionalizan con el anticuerpo BAM10, lo que permite la inhibición de la formación de fibras de amiloide beta y la citotoxicidad provocada por el Aβ (Figura 1f).
Nanopartículas cargadas con agentes terapéuticos no proteicos
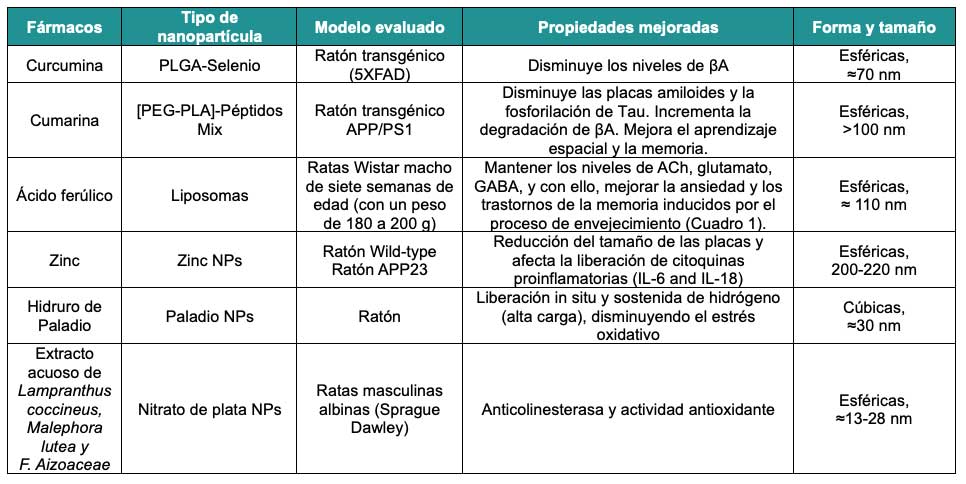
Con la finalidad de transportar otras moléculas con potencial terapéutico para la EA se están desarrollando nanopartículas que favorecen la biodisponibilidad de moléculas terapéuticas; algunas de ellas se han usado para transportar curcumina, cumarina, algunos metales como el zinc, selenio y el paladio, incluso nanopartículas recubiertas con extractos de plantas, o bien, antioxidantes como el ácido ferúlico, el cual ha demostrado, al menos en ratones, mantener los niveles cerebrales de ACh, glutamato, GABA, y con ello reducir la ansiedad y los trastornos de la memoria inducidos por el proceso de envejecimiento (Cuadro 1).
En 2019, por primera vez, se tuvo registro de un estudio clínico que consideró pacientes con deterioro cognitivo leve a moderado para evaluar la seguridad, tolerabilidad y eficacia de la administración intranasal de nanopartículas APH-1105, las cuales parecen modular la actividad de la enzima alfa-secretasa, una enzima que corta a la proteína precursora de amiloide (APP) para obtener un producto más soluble, lo que favorece su eliminación del cerebro evitando la formación de placas amiloides insolubles. En la actualidad este estudio se encuentra en fase clínica II y se prevé que finalice en diciembre de 2024.
Por lo tanto, aunque la administración dirigida de neurofármacos con nanopartículas, tiene como objetivo mejorar los resultados clínicos en la eficacia terapéutica contra la EA, se necesita un estudio a profundidad para desarrollar una nanomedicina sólida y clínicamente eficiente contra esta enfermedad, sobre todo porque aún no hay evidencia del margen de seguridad de esta tecnología.
Bibliografía de consulta
Harilal S, Jose J, Parambi DGT, Kumar R, Mathew GE, Uddin MS, Kim H, Mathew B. Advancements in nanotherapeutics for Alzheimer’s disease: current perspectives. J Pharm Pharmacol. 2019 Sep;71(9):1370-1383. doi: 10.1111/jphp.13132. Epub 2019 Jul 15. PMID: 31304982.
Kassem, L. M., Ibrahim N.A. y Farhana, S.A. (2020). Nanoparticle Therapy Is a Promising Approach in the Management and Prevention of Many Diseases: Does It Help in Curing Alzheimer Disease? Journal of Nanotechnology, volumen 2020, Article ID: 8147080, 8 pages. https://doi.org/10.1155/2020/8147080
Aphios Safety, Tolerability and Efficacy Assessment of Intranasal Nanoparticles of APH-1105, A Novel Alpha Secretase Modulator For Mild to Moderate Cognitive Impairment Due to Alzheimer’s Disease(AD). 2021. Available online: clinicaltrials.gov (accessed on 08 September 2024). Link
Taléns-Visconti, Raquel, Jesus Vicente de Julián-Ortiz, Ofelia Vila-Busó, Octavio Diez-Sales, and Amparo Nácher. 2023. “Intranasal Drug Administration in Alzheimer-Type Dementia: Towards Clinical Applications”. Pharmaceutics. 15, no. 5: 1399. https://doi.org/10.3390/pharmaceutics15051399
Huang, LK., Kuan, YC., Lin, HW. y cols. Ensayos clínicos de nuevos fármacos para la enfermedad de Alzheimer: actualización 2020-2023. J Biomed Sci 30, 83 (2023). https://doi.org/10.1186/s12929-023-00976-6
Rossato DR, Rosa JLO, Fontoura MB, de Souza LEM, de Almeida TM, Kudrna KB, Schaffazick SR, da Silva CB, Birk L, Eller S, de Oliveira TF, Burger ME. Ferulic Acid-Loaded Nanostructure Maintains Brain Levels of ACh, Glutamate, and GABA and Ameliorates Anxiety and Memory Impairments Induced by the D-Galactose Aging Process in Rats. Neurochem Res. 2024 Sep 20. doi: 10.1007/s11064-024-04248-z. Epub ahead of print. PMID: 39302597.