En nuestra cultura es muy conocido el cuento de que, al besar un sapo, éste se convierte en… ¡príncipe!. Sin embargo, varias especies de estos anfibios producen sustancias tóxicas para protegerse de sus depredadores (por ejemplo, serpientes, aves, y mamíferos como zorros, tejones, mapaches, ratas y comadrejas). Tal es el caso de Rhinella marina, que en nuestro país se distribuye en los estados con litorales en el Océano Pacífico y el Golfo de México, y de la especie Bufo alvarius que se encuentra particularmente en el desierto de Sonora.
Rhinella marina es una especie de anuro conocida comúnmente como sapo de caña, ya que se ha utilizado con éxito en el control de plagas en este cultivo. Sin embargo, al ser una especie introducida, puede volverse invasora en ciertos ecosistemas, como ha sucedido en Australia. Sus adaptaciones fisiológicas, como su dieta variada, su capacidad para vivir en entornos modificados por la actividad humana y su gran tamaño en todas las etapas de su vida, incluida la metamorfosis, han garantizado su supervivencia.
A pesar de lo que sugiere su nombre científico, es mayoritariamente terrestre, desplazándose a ambientes acuáticos durante el período reproductivo, que generalmente coincide con el inicio de la temporada de lluvias. El sapo de caña tiene la capacidad de absorber agua a través del epitelio ventral, lo que le permite mantener una adecuada hidratación en toda su piel.
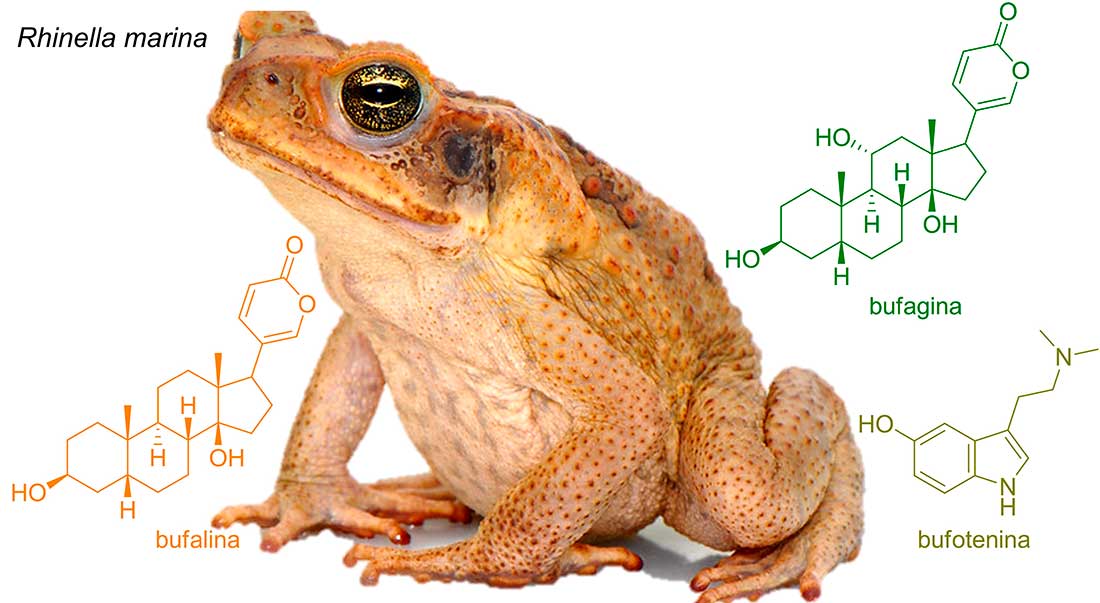
Estos animales poseen un par de glándulas parótidas en el cuello, detrás de cada ojo, donde el colesterol proveniente de la circulación sanguínea se convierte en toxinas como la bufalina y bufagina. La estructura química de estas bufotoxinas consta del núcleo esteroidal con una lactona de seis miembros como sustituyente en el anillo D (Figura 1). La lactona es precisamente la parte de estas moléculas que potencia su propiedad como cardiotónicos, es decir, aumenta la fuerza de las contracciones del miocardio.
Por ello, este tipo de compuestos puede utilizarse en el tratamiento de padecimientos como la insuficiencia cardíaca congestiva y el accidente cerebrovascular isquémico (R. J. Chen et al., 2010). Además, la bufalina puede emplearse como un quimiosensibilizador en el tratamiento de diversos tipos de cáncer resistente a fármacos (Ye et al., 2023). Asimismo, un estudio mostró que estas bufotoxinas, bufalina y bufagina, presentan buena actividad contra el parásito Plasmodium falciparum, causante de la malaria (Wells et al., 2022). Otra actividad antiparasitaria estudiada fue la ejercida por bufagina y otros derivados estructurales contra Trypanosoma cruzi, causante de la enfermedad de Chagas (Rodriguez et al., 2021).
Además, dentro de la composición química de sus secreciones glandulares, se encuentra el alcaloide bufotenina, un derivado del aminoácido triptófano (Chilton et al., 1979). La bufotenina, también conocida como 5-OH-DMT, induce efectos alucinógenos, aumento de la frecuencia respiratoria, opresión en el pecho, coloración púrpura de la piel de la cabeza y el cuello, así como náuseas y vómitos (McBride, 2000). En la civilización maya, la piel seca de este sapo fue utilizada en bebidas ancestrales, como el balché, para intensificar sus efectos psicotrópicos durante ceremonias religiosas (Carod-Artal, 2015).
Esta secreción no sólo se produce y almacena en las glándulas parótidas, sino también en glándulas de menor tamaño distribuidas en el dorso y las extremidades. Incluso se ha encontrado que las glándulas parótidas son más grandes en las hembras y la distribución de las glándulas en la piel es diferente a la de los machos. Esto tiene sentido, pues las hembras secretan toxinas al depositar sus huevos para protegerlos de los depredadores. Ambos sexos habitan en zonas distintas (W. Chen et al., 2017).
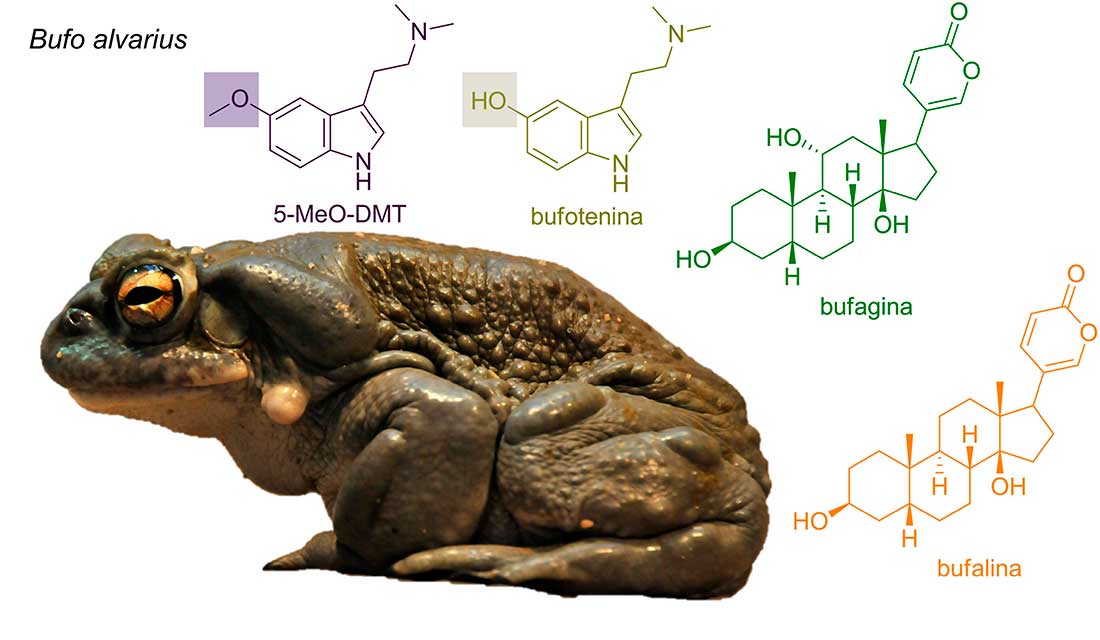
Bufo alvarius es un anfibio semiacuático comúnmente conocido como el “sapo sagrado”, debido a su uso en rituales de culturas prehispánicas. Por ejemplo, los sacerdotes olmecas fumaban la piel seca del animal durante sus rituales (Carod-Artal, 2015). Este sapo se caracteriza por poseer una enzima metiltransferasa que no está presente en otras especies de sapos. Dicha enzima es capaz de convertir la bufotenina en su forma metilada, la 5-MeO-DMT (Figura 2), uno de los psicotrópicos naturales más potentes. Esta conversión ocurre en grandes cantidades almacenándose principalmente en sus glándulas parótidas y tibiales; se estima que alrededor del 15% del peso en seco de estas glándulas corresponde a esta sustancia (Weil, s. f.).
La 5-MeO-DMT actúa como agonista de los receptores de serotonina, por lo que se ha propuesto su uso en pacientes con depresión severa y trastorno límite de la personalidad. Es inactiva si se administra por vía oral, por lo que, generalmente se fuma o se inhala. Entre sus efectos secundarios se incluyen miedo, confusión, paranoia, fatiga, temblores, vómito, cefaleas, opresión en el pecho y pérdida de la percepción corporal.
En la actualidad, aún se consume con fines recreativos; no obstante, su abuso puede poner en riesgo la salud y la vida de las personas. Además, esta práctica también vulnera a los sapos, ya que ha incrementado su caza y tráfico ilegal.
Lejos de convertirse en príncipes, los sapos han jugado un papel importante en rituales y como remedios medicinales en culturas ancestrales, pues muchas de sus especies, como Rhinella marina y Bufo alvarius, producen toxinas potentes con efectos tanto terapéuticos como peligrosos. El uso indiscriminado de estos animales conlleva riesgos tanto para los ecosistemas como para la salud humana, dado que el abuso de sustancias como la 5-MeO-DMT y la bufotenina pueden producir efectos adversos graves. Por ello, es fundamental abordar el uso y conservación de estas especies que enfrentan amenazas por su captura y comercio ilícitos.
Referencias:
Carod-Artal, F. J. (2015). Alucinógenos en las culturas precolombinas mesoamericanas. Neurología, 30(1), 42-49. https://doi.org/10.1016/j.nrl.2011.07.003
Chen, R. J., Chung, T., Li, F., Yang, W., Jinn, T., & Tzen, J. T. (2010). Steroid-like compounds in Chinese medicines promote blood circulation via inhibition of Na+/K+-ATPase. Acta Pharmacologica Sinica, 31(6), 696-702. https://doi.org/10.1038/aps.2010.61
Chen, W., Hudson, C. M., DeVore, J. L., & Shine, R. (2017). Sex and weaponry: The distribution of toxin‐storage glands on the bodies of male and female cane toads ( Rhinella marina ). Ecology and Evolution, 7(21), 8950-8957. https://doi.org/10.1002/ece3.2914
Chilton, W. S., Bigwood, J., & Jensen, R. E. (1979). Psilocin, Bufotenine and Serotonin: Historical and Biosynthetic Observations. Journal of Psychedelic Drugs, 11(1-2), 61-69. https://doi.org/10.1080/02791072.1979.10472093
McBride, M. C. (2000). Bufotenine: Toward an Understanding of Possible Psychoactive Mechanisms. Journal of Psychoactive Drugs, 32(3), 321-331. https://doi.org/10.1080/02791072.2000.10400456
Rodriguez, C., Ibáñez, R., Mojica, L., Ng, M., Spadafora, C., Durant-Archibold, A. A., & Gutiérrez, M. (2021). Bufadienolides from the Skin Secretions of the Neotropical Toad Rhinella alata (Anura: Bufonidae): Antiprotozoal Activity against Trypanosoma cruzi. Molecules, 26(14), 4217. https://doi.org/10.3390/molecules26144217
Weil, A. T., Davis, W. Bufo alvarius: a potent hallucinogen of animal origin. J Ethnopharmacol 1994, 41(1-2):1-8.
Wells, M., Fossépré, M., Hambye, S., Surin, M., & Blankert, B. (2022). Uncovering the antimalarial potential of toad venoms through a bioassay-guided fractionation process. International Journal for Parasitology: Drugs and Drug Resistance, 20, 97-107. https://doi.org/10.1016/j.ijpddr.2022.10.001
Ye, Q., Zhou, X., Ren, H., Han, F., Lin, R., & Li, J. (2023). An overview of the past decade of bufalin in the treatment of refractory and drug-resistant cancers: Current status, challenges, and future perspectives. Frontiers in Pharmacology, 14, 1274336. https://doi.org/10.3389/fphar.2023.1274336













