En el cuerpo humano se llevan a cabo millones de reacciones químicas para que el organismo se desempeñe de manera adecuada y permanezca en equilibrio. Estas reacciones son reguladas y organizadas por vías de señalización, en las que una gran cantidad de biomoléculas funcionan como intermediarias en la integración y amplificación de señales bioquímicas que en conjunto son capaces de controlar funciones celulares, tales como la multiplicación, o en su caso, la destrucción celular. Cuando estas vías de señalización se activan de manera incorrecta el resultado es la aparición de diversos padecimientos.
Las complejas vías de señalización intracelulares comienzan con la unión de un ligando (molécula señalizadora) a un receptor (molécula que lo recibe). La unión del ligando al receptor cambia su forma o actividad, lo que permite transmitir una señal o producir directamente un cambio dentro de la célula (Figura 1).
Tipos de receptores
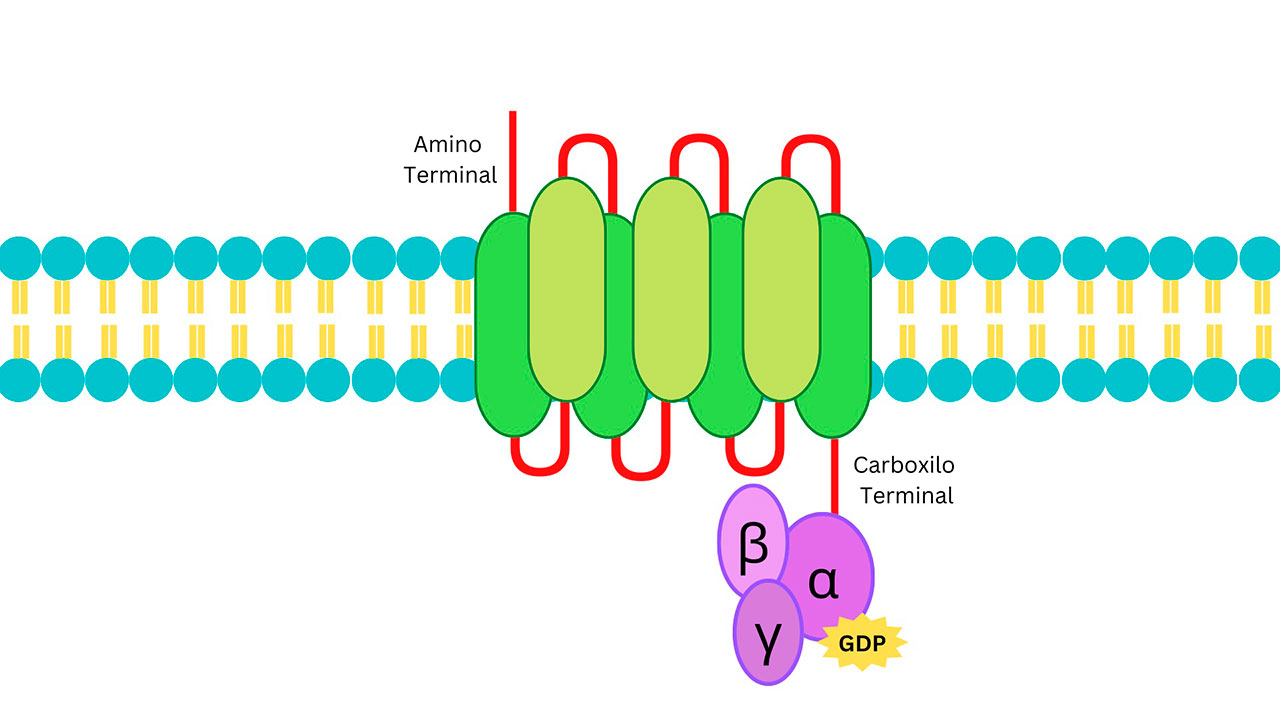
Los receptores acoplados a proteínas G (GPCR) son proteínas que se localizan en la membrana celular que reconocen sustancias extracelulares y transmiten señales. Los GPCR hacen esto mediante la activación de proteínas de unión a la proteína G, que son responsables de la transducción de la señal dentro de la célula. Un GPCR consta de tres regiones, comenzando con el amino terminal localizado en la región extracelular que detecta y se une al ligando; ésto hace que la región transmembrana de siete dominios sufra un cambio conformacional, y este cambio activa el extremo Carboxilo-terminal situado en el citoplasma, que a su vez activa a la proteína G formada por subunidades alfa, beta y gama; éstas tienen la capacidad de unir e hidrolizar GTP e iniciar un ciclo de activación-inactivación (Figura 2).
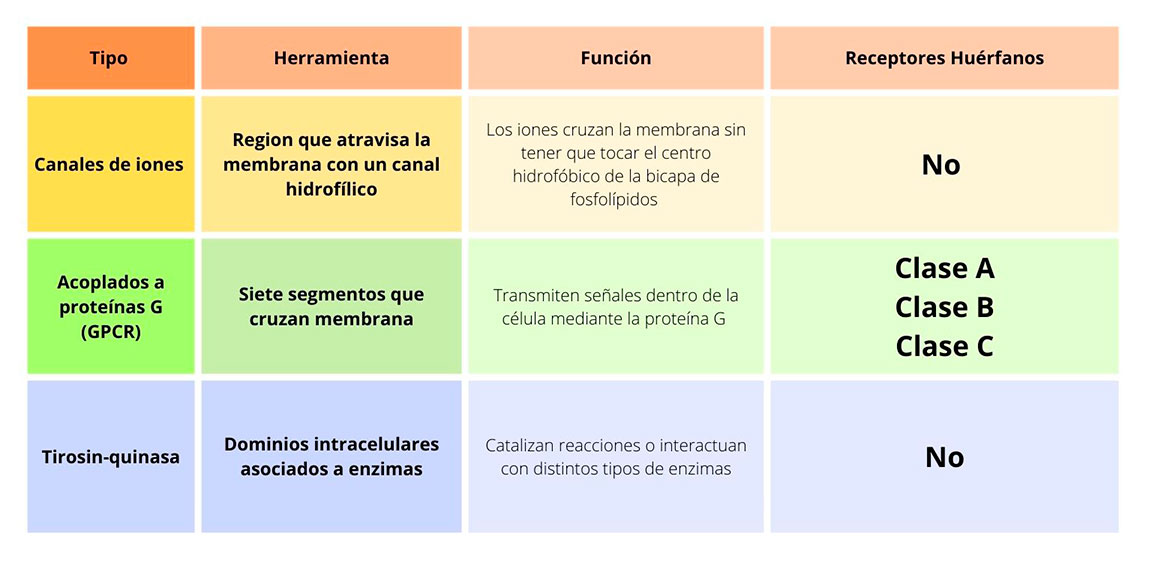
Los receptores GPCR son una de las familias más grandes de proteínas de membrana celular contando con hasta 1000 miembros que participan en los procesos de equilibrio del organismo, así como en el desarrollo de desbalances y enfermedades cuando presentan alteraciones. Aproximadamente el 30% de los fármacos utilizan estos receptores como blanco para ejercer su efecto (Tabla 1).
A diferencia de los receptores de membrana que se ubican en la superficie celular, dentro de la célula (en el núcleo) se encuentran los receptores nucleares, los cuales son factores de transcripción activados por ligando, que modulan la expresión de diferentes genes implicados en la diferenciación, apoptosis, crecimiento y metabolismo celular, actuando como receptores de señales. También se han relacionado con el desarrollo de diversas patologías, debido a que cualquier disfunción o error en las vías de señalización reguladas por estos receptores, se asocia con enfermedades de tipo reproductivo, proliferativo y/o metabólico, destacando su relevancia en distintos tipos de cáncer.
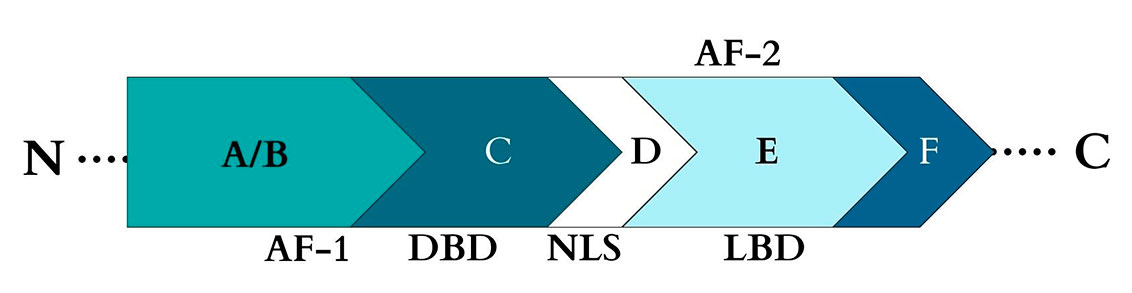
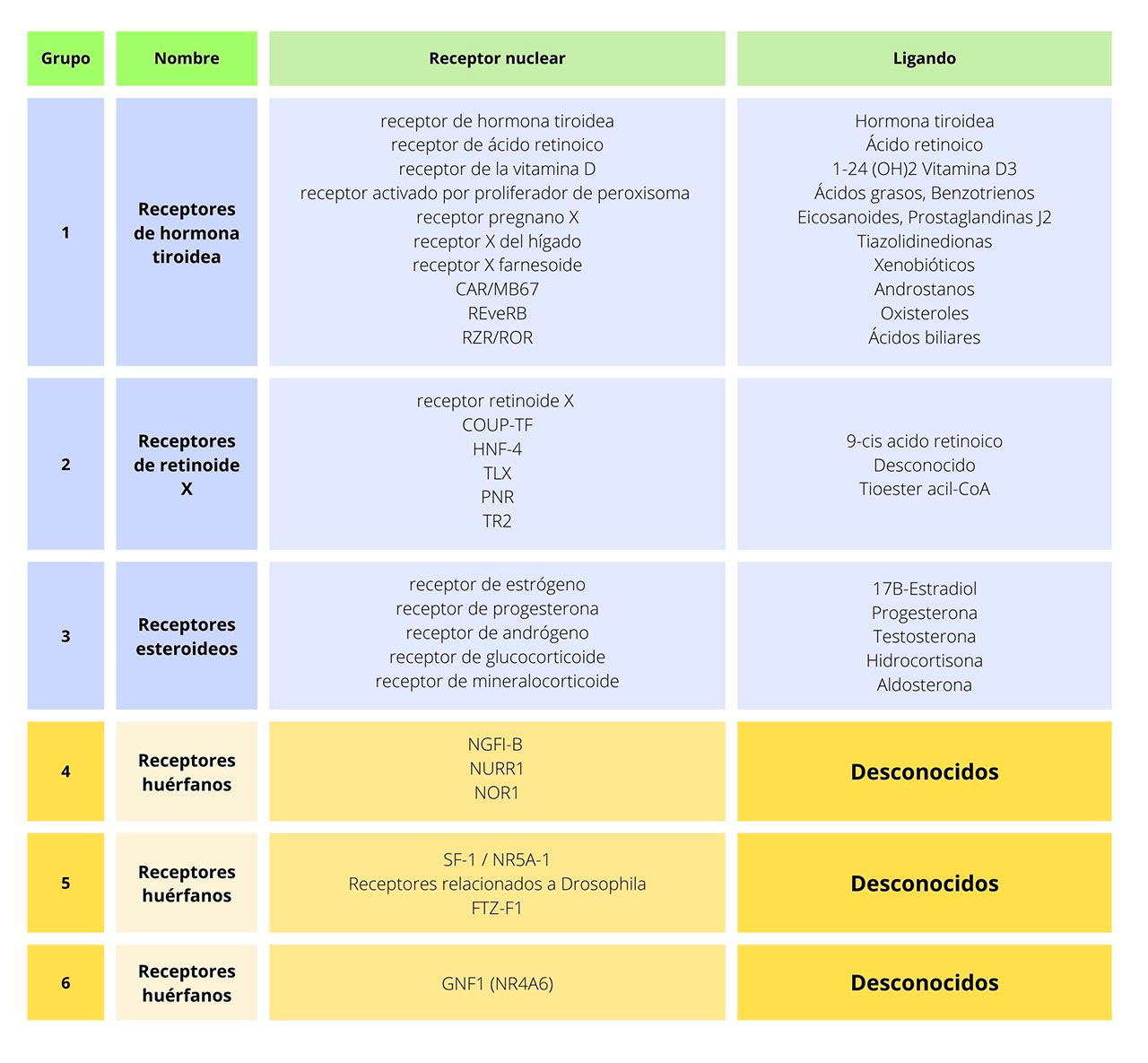
La estructura de un receptor nuclear está conformada por dominios funcionales denominados con las letras de la A – F, partiendo del extremo N–terminal al C–terminal (Figura 3). La región A/B contiene el dominio de activación transcripcional (AF–1), después se encuentra la región C que presenta el dominio de unión al ADN (DBD), el cual es altamente conservado en los receptores nucleares. La región D, además de contener una secuencia de localización nuclear (NLS), actúa como una bisagra entre la región C y E, y se encuentra involucrada en los cambios conformacionales de los receptores nucleares. La región E contiene el dominio de unión al ligando (LBD) y un segundo dominio de función de activación transcripcional (AF–2). El dominio F está presente sólo en algunos receptores nucleares. Existen aproximadamente 48 de estos receptores, que de acuerdo con las características de sus ligandos, se subdividen en seis grupos (Tabla 2).
Dentro de las clasificaciones de receptores de membrana y nucleares se encuentran aquellos que no cuentan con un ligando conocido, a este tipo de receptores se les conoce como huérfanos. Cuando se encuentra el ligando de un receptor, se dice que es “adoptado” o “desorfanizado”. Hay estudios que sugieren que la activación por medio de ligandos no es necesaria para todos los tipos de receptores y existen algunos independientes, es decir, que no necesitan un ligando para ejercer su acción; algunos actúan de manera constitutiva o se activan de otras formas, por ejemplo, por fosforilación.
Funcionamiento de los receptores huérfanos
Los receptores huérfanos tienen varias funciones ya que actúan como mediadores de las vías de señalización celular; la falta de ligandos fisiológicos o sintéticos de estas moléculas representa un reto en el análisis de su función. Sin embargo se ha reportado en estudios realizados en la última década que un aumento o disminución de su activación puede estar asociado con el desarrollo de diferentes enfermedades incluyendo diabetes mellitus, ateroesclerosis, desórdenes lipídicos y cáncer, lo que los ha convertido en puntos estratégicos para el abordaje de nuevas aproximaciones terapéuticas y han sido empleados en el desarrollo racional de fármacos en distintas áreas de la medicina.
Rol de los receptores huérfanos en el cáncer
El cáncer se define como un desorden de células que se dividen anormalmente, lo que conduce a la formación de neoplasias, que, al aumentar su tamaño dañan y se nutren del organismo alterando su funcionamiento normal. Además, estas células pueden migrar e invadir distintas regiones donde encuentran un nuevo lugar para continuar su crecimiento, originando una metástasis, que en muchas ocasiones es causa de muerte de los pacientes.
Esta patología, durante el año 2020 se convirtió en la principal causa de mortalidad en la población mundial (OMS 2021). El cáncer de mama es el más común en el mundo, con más de 2.2 millones de casos en el 2020 y es la principal causa de mortalidad en las mujeres; en el caso de los hombres el cáncer con mayor tasa de mortalidad es el cáncer de pulmón, seguido por el de próstata. Con el paso del tiempo, el estudio de las células cancerígenas a nivel celular, molecular, metabólico y genético ha permitido mejorar de manera significativa el manejo clínico de la enfermedad, así como el manejo del crecimiento tumoral y metástasis.
A través del estudio del genoma humano, se ha secuenciado el ADN y ARN de células cancerosas, y al comparar estas secuencias con las de un tejido normal se lograron identificar las diferencias genéticas que son capaces de originar cáncer. Por otra parte, también se ha logrado estudiar genes codificados en el ADN para así saber qué proteínas están anormalmente activas o silenciadas, lo que contribuye a su crecimiento descontrolado. Este proceso es conocido como genómica estructural y ha permitido mejorar de manera significativa el diagnóstico oportuno, así como el tratamiento clínico de la enfermedad, evitando el crecimiento tumoral y metástasis.
Gracias al estudio del genoma humano varias investigaciones ya han identificado un rol importante del receptor huérfano GPR161 en el cáncer de mama, en éstos se observó que hay un aumento en su expresión genética, específicamente en el cáncer de mama triple negativo. Situación que resulta por demás interesante debido a que este receptor se ha identificado como regulador de la proliferación de las células mamarias que se presenta en el cáncer triple negativo, por lo que puede llegar a ser un objetivo farmacológico para el tratamiento de esta patología. A pesar de que aún se desconoce el ligando del GPR161 y de su pobre conocimiento acerca de las vías de señalización, se sigue buscando poder validar su potencial y capacidad.
Algunos receptores huérfanos como los RORα, ERRγ, y Nur77 ejercen su función tumor supresiva directamente uniendo y regulando genes diana. Por ejemplo, el receptor SEMA3F suprime la invasión tumoral en el cáncer de mama y es un gen objetivo RORα directo. En varios estudios se observó un aumento en la expresión del gen GPR 161, específicamente en el cáncer de mama triple negativo, por lo que se ha identificado como regulador de la proliferación de las células mamarias en este tipo de cáncer. Otro ejemplo es la E-cadherina, que inhibe la metástasis y es un gen diana directo de ERRy.
Los antecedentes sugieren que estas familias de receptores huérfanos se asocian directamente a funciones específicas que ya están en proceso de ser identificadas, pueden llegar a ser blancos farmacológicos y alternativas terapéuticas para el tratamiento del cáncer, así como de otras patologías con alta incidencia y mortalidad en la población mundial. Esto será de gran ayuda para mejorar las intervenciones en los pacientes con la finalidad de mejorar su pronóstico y sobre todo brindar una mejor calidad de vida.
Glosario
ADN: Moléculas del interior de las células que contienen información genética y la transmiten de una generación a otra. También se llama ácido desoxirribonucleico o DNA.
Apoptosis: Tipo de muerte celular en la que una serie de procesos moleculares en la célula conducen a su muerte. También llamado muerte celular programada.
ARN: Contiene información copiada del ADN. Las células elaboran varias formas diferentes de ARN y cada forma cumple una función específica en la célula.
Fosforilación: Introducción de un grupo fosfato dentro de una biomolécula, en un proceso que normalmente está controlado por una fosforilasa.
Genoma Humano: El conjunto completo de ADN (material genético) en un organismo. En los seres humanos, casi cada célula contiene una copia completa del genoma.
Homeostasis: Estado de equilibrio entre todos los sistemas del cuerpo necesarios para sobrevivir y funcionar de forma adecuada.
Metástasis: Diseminación de células cancerosas desde el lugar donde se formó el cáncer por primera vez hasta otra parte del cuerpo.
Neoplasia: Masa anormal de tejido que aparece cuando las células se multiplican más de lo debido o no se mueren cuando deberían. Las neoplasias son benignas (no cancerosas) o malignas (cancerosas).
Transcripción: Proceso mediante el cual una célula elabora una copia de ARN de una pieza de ADN.
Referencias bibliográficas:
- Garattini E, Bolis M, Gianni’ M, Paroni G, Fratelli M, Terao M. (2016). Lipid-sensors, enigmatic-orphan and orphan nuclear receptors as therapeutic targets in breast-cancer. Oncotarget 7(27):42661-42682. doi: 10.18632/oncotarget.7410. PMID: 26894976; PMCID: PMC5173165.
- Feigin, M. E., Xue, B., Hammell, M. C., & Muthuswamy, S. K. (2014). G-protein-coupled receptor GPR161 is overexpressed in breast cancer and is a promoter of cell proliferation and invasion. Proceedings of the National Academy of Sciences, 111(11), 4191–4196.
- Sánchez, N. C. (2013). Conociendo y comprendiendo la célula cancerosa: Fisiopatología del cáncer. Revista Médica Clínica Las Condes, 24(4), 553-562.
- Gómez-Merino, F. C., Trejo-Téllez, L. I., & Tiessen, A. (2009). Factores de transcripción. Fundamentos y Metodologías Innovadoras para el Mejoramiento Genético de Maíz. A Tiessen (ed). Fundación Ciencia Activa, Bogotá, Colombia. pp, 127-163.