En este mundo tan complejo y diverso es difícil imaginar que todo aquello que conocemos con formas tan diferentes surgió a partir de una unidad en común. Aquellos apasionados de la ciencias físicas y la astronomía, sabrán que la teoría del Big Bang, según la NASA, propone que el universo comenzó en un solo punto, a partir de un grupo de diminutas partículas calientes mezcladas con luz y energía, las cuales en cierto momento comenzaron a expandirse y estirarse, hasta que durante su enfriamiento dieron lugar a nuevos grupos que, con el tiempo, se convertirían en las primeras estrellas y galaxias, formando así el universo que conocemos y el que aun desconocemos.
De una manera similar, pero desde un punto de vista biológico, hace más de 150 años, un renombrado naturalista llamado Charles Darwin, propuso una teoría que entonces parecía descabellada: “todos los seres vivos comparten la herencia genética de un único y remoto antepasado común”. Esta idea constituyó uno de los pilares sobre los que el genial científico edificó su teoría de la evolución, sugiriendo que, a partir de ese único organismo ancestral, la vida se diversificó después en la multitud de formas que hoy pueblan nuestro mundo, desde las bacterias invisibles al ojo humano, hasta las plantas y los grandes mamíferos que habitan el planeta. Con estos dos ejemplos en dos áreas diferentes de la ciencia es posible dilucidar que en ocasiones las cosas más complejas y variadas surgen de un solo elemento, el cual conforme avanza el tiempo va generando estructuras más elaboradas.
El desarrollo de los seres vivos no escapa de esta visión reduccionista, ya que como sucede con las plantas, a partir de una sola unidad elemental, que es la célula, se generan todos los tejidos que conforman nuestro cuerpo. Por increíble que parezca esto es verdad, una vez que el ovulo es fecundado por el espermatozoide comienza una serie de divisiones celulares, que darán lugar a células especializadas, como los hepatocitos, los cardiomiocitos, los eritrocitos, las células del sistema inmunológico, las neuronas, entre muchas otras. Todas estas células especializadas provienen de aquella célula fecundada.
¿Cómo es posible que células con funciones tan diferentes provengan de una sola célula? Sin duda es una pregunta fundamental, ya que todas las células provenientes del ovulo fecundado contienen exactamente la misma información genética; es decir, la mitad de los cromosomas vienen de la madre y la otra mitad del padre. Entonces, ¿qué es lo que hace que una neurona se comporte como neurona y un leucocito actúe como leucocito? La respuesta está en el control de la expresión génica, el control epigenético (cambios en la cromatina que no afectan la secuencia genética y que alteran la expresión de los genes) y la regulación postranscripcional, fenómenos que ocurren en las células embrionarias a lo largo de su desarrollo.
El término “Epigenética” fue acuñado en la década de los cincuenta del siglo pasado, para describir el mecanismo por el cual los organismos multicelulares desarrollan múltiples tejidos a partir de un único genoma. En la actualidad reconocemos que este proceso se logra mediante marcas moleculares en la cromatina, que generan modificaciones que afectan la actividad transcripcional de los genes y una vez establecidas son relativamente estables en las siguientes generaciones celulares. El uso actual del término, consiste en indicar cambios heredables en la estructura y organización del DNA que no involucran cambios en la secuencia de nucleótidos y que modulan la expresión génica. Estos cambios en la expresión génica implican, entonces, cambios heredables en el fenotipo.
La epigenética explica que, aunque todas las células de un mismo organismo presentan la misma secuencia genética entre ellas, no todas son capaces de activar los mismos tipos de genes. Es decir, aunque una neurona y una célula pancreática, de un individuo, contienen exactamente el mismo genoma, las neuronas solo tienen activados los genes que le permiten cumplir sus funciones como neurona y mantienen apagados o silenciados aquellos genes que se encuentran encendidos en una célula pancreática. Este apagado y encendido de genes es lo que permite que células con un mismo genoma puedan diferenciarse en células especializadas con una morfología y función totalmente diferente.
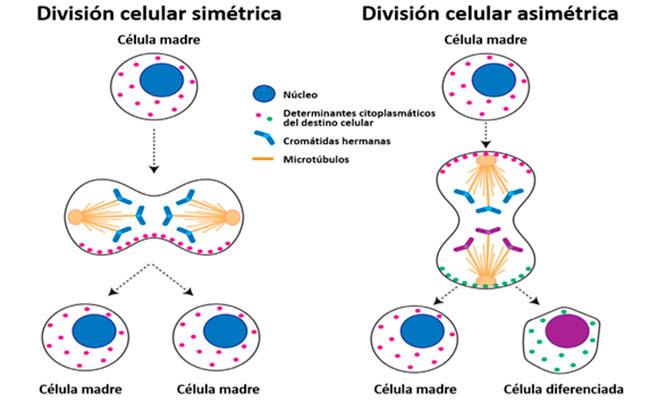
Una célula que ha decidido encender una familia de genes para realizar funciones específicas de una estirpe celular, no puede, al menos de manera fisiológica, apagar estos genes y decidir encender otros para convertirse en una célula diferente. Una vez que una célula se compromete con un linaje específico, su destino será ese tipo celular hasta el día de su muerte. No obstante, en la complejidad de nuestro organismo existen células que escapan en algún sentido a esta regla, pues son capaces de convertirse en diferentes tipos celulares dependiendo de las señales que reciben, debido a que aún no han comenzado con el proceso de silenciamiento genético de sus genes. Estas células han sido denominadas células madre o troncales; y tienen dos propiedades particulares, en primer lugar, pueden autorrenovarse, es decir, dar lugar a nuevas células madre, permitiendo así, mantener una reserva de estas células en el cuerpo. La segunda propiedad es que pueden dar lugar a células comprometidas con un linaje celular en particular. Esta doble característica se lleva a cabo por un proceso denominado división asimétrica.
Mientras que en la división simétrica, los componentes celulares del citoplasma y el genoma se distribuyen de forma similar en las células hijas, dando lugar a dos células exactamente iguales entre sí; en el proceso de división asimétrica, las células resultantes tienen un contenido celular distinto, y eso induce el proceso de diferenciación en una de ellas, mientras que la otra conserva las características de célula madre.
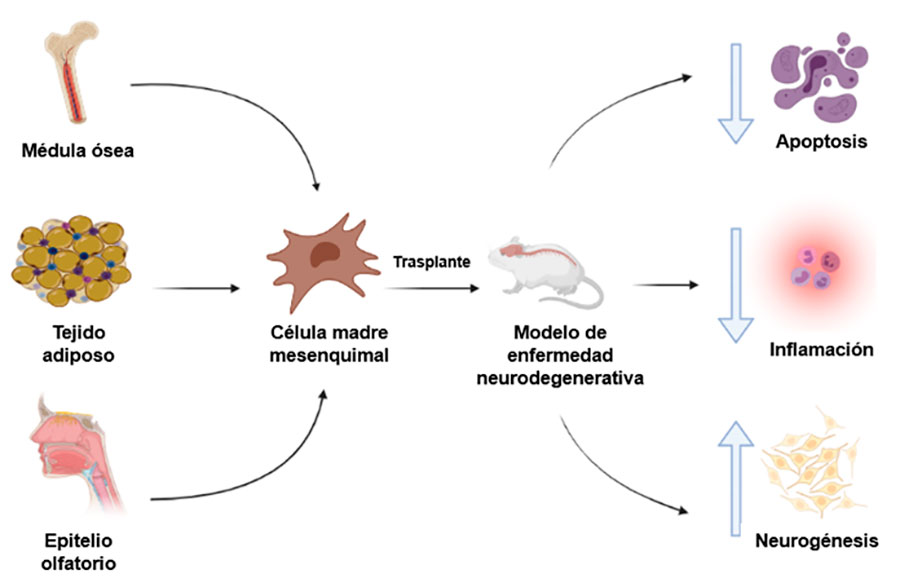
Aparte de las células madre embrionarias, existen otras células denominadas células madre adultas, las cuales residen en los órganos y tejidos de las personas y se usan para sustituir a las células especializadas en el proceso de mantenimiento o regeneración del órgano o tejido en cuestión, a estas células se les conoce como células madre mesenquimales (MSCs, por sus siglas en inglés) y presentan una amplia capacidad de diferenciación dando lugar a células de distintos linajes celulares.
La historia de las MSCs, comienza en 1966, cuando el grupo de trabajo del doctor Friedenstein encontró que al trasplantar células de la medula ósea en el músculo, para la hematopoyesis en el injerto y en su lugar aparece tejido reticular y óseo. En ese momento se desconocía la población celular específica, responsable de este efecto. Años después, este mismo grupo descubrió que una población con morfología fibroblástica podía crecer y generar colonias en cultivos de células, formando monocapas y que eran capaces de formar hueso espontáneamente. En 1987, demostraron que el trasplante de estas células, daba lugar a células de tejido óseo y cartilaginoso, denominandolas “células madre osteogénicas de médula ósea”. Caplan, en 1991, utilizó por primera vez el concepto de células madre mesenquimales para referirse a las células descritas por Friedenstein en el 87. Finalmente, Pitterget y colaboradores publicaron un trabajo en 1999 donde caracterizaron una población de células derivadas de medula ósea, altamente proliferativas en cultivo y con una morfología fibroblástica extendida, las cuales presentaron una alta capacidad de diferenciación hacia linajes adipocíticos, condrocitos y osteocitos.
A partir de entonces, se han encontrado MSCs en otros tejidos adultos, como el tejido adiposo, el espacio medular de los huesos largos, fragmentos de hueso trabecular, periostio, líquido sinovial, ligamento periodontal, amígdala palatina, glándula paratiroidea, trompa de Falopio, páncreas, hígado, dermis, músculo esquelético adulto, así como de tejidos embrionarios como el cordón umbilical, la pulpa dental temporal, el líquido amniótico, la placenta y recientemente del surco nasal, que expresan genes relacionados con las células neurales, por lo que fueron denominadas células madre ecto-mesenquimales.
Las MSCs pueden diferenciarse relativamente fácil a células mesodérmicas (adipocitos, condrocitos y osteocitos), ya que tienen el mismo origen embrionario. Sin embargo, también pueden dar lugar a otros tipos de tejidos altamente especializados, como cardiomiocitos, células endoteliales, hepatocitos, células beta pancreáticas, células del tejido nervioso, etc. Debido a su gran plasticidad, se ha propuesto que estas células pudieran funcionar como restauradores naturales de los tejidos y, por consiguiente, podrían reponer diversas poblaciones celulares tras su trasplante. Además, presentan una serie de propiedades tróficas que promueven la regeneración en el tejido circundante, como son: su acción secretora, su capacidad de migración y su acción inmunomoduladora.
Se ha descrito que las MSCs, sintetizan y secretan múltiples factores de crecimiento que potencian la regeneración y supervivencia de las células residentes del tejido trasplantado. Además, se ha demostrado que las MSCs son capaces de migrar de manera específica a los tejidos dañados por medio de la captación de señales enviadas por el tejido lesionado, lo que les permite llegar al sitio de acción independientemente de su vía de administración. La propiedad inmunomoduladora de las MSCs, les permite regular al sistema inmunológico y controlar la respuesta inmune. Las MSCs, presentan otra característica importante, no expresan moléculas de histocompatibilidad y por lo tanto no son rechazadas por el sistema inmune receptor. Además, las MSCs alogénicas trasplantadas (tomadas de diferentes individuos de la misma especie), pueden detectarse en los individuos después de mucho tiempo, lo que indica que han sobrevivido al sistema inmune del huésped. Esto se debe principalmente a la falta de expresión de moléculas coestimuladoras como B7-1, B7-2, CD40 o ligando de CD40; moléculas involucradas en la activación de los linfocitos T, generando que las células T no se activen y por lo tanto no se produzca un rechazo del trasplante. Además, las MSCs, producen moléculas que reducen la actividad del sistema inmune, facilitando así la aceptación del trasplante en el sujeto receptor, aun en ausencia de agentes inmunomoduladores.
Las MSCs pueden ser almacenadas, usando medios especiales de congelamiento para ultracongelación a -80oC, por periodos largos de tiempo, sin la pérdida de sus propiedades biológicas o de su potencial de diferenciación y son fáciles de obtener en una amplia variedad de tejidos adultos Por todas estas características las MSCs se están probando, a nivel experimental, en el tratamiento de varias enfermedades, incluido el sistema nervioso.
La terapia celular para el tratamiento de las enfermedades degenerativas debe cumplir con los siguientes criterios: 1) las células del donante deben estar fácilmente disponibles; 2) deben ser capaces de proliferar con una rápida expansión en el cultivo celular; 3) deben ser inmunológicamente inertes; 4) deben ser capaces de sobrevivir por un largo periodo e integrarse en el cerebro del huésped; y 5) deben ser susceptibles de mantener una transfección estable y expresión a largo plazo de genes exógenos, que faciliten la resolución de la enfermedad en cuestión. Por fortuna las células madre mesenquimales presentan todas estas características, convirtiéndose en excelentes candidatas para ser aplicadas en los protocolos de terapia celular, demostrando su utilidad en la recuperación funcional en diversos modelos de alteraciones del sistema nervioso como el accidente cerebrovascular isquémico, la lesión desmielinizante, la lesión de la medula espinal, la paraplejia, y las enfermedades de Parkinson y de Alzheimer. El mecanismo involucra la disminución de la inflamación y estrés oxidativo generado por el daño celular, una disminución de la apoptosis de las células nerviosas y un aumento considerable en la producción de nuevas neuronas en la zona de lesión.
En otro sentido, se ha observado que las células madre mesenquimales no solo podrían utilizarse como posibles candidatos para el tratamiento de diversas enfermedades del sistema nervioso tras su trasplante, sino que también podrían ser utilizadas como un modelo de estudio para estas patologías, ya que conservan sus propiedades genéticas y epigenéticas, lo que permitiría evaluar, directamente, fármacos candidatos para una aplicación clínica exitosa. El modelado de enfermedades utilizando células derivadas de pacientes tiene como objetivo obtener información sobre disfunciones celulares y moleculares que subyacen a la patología cerebral en lugar de simular funciones cerebrales enfermas. En este sentido los investigadores han utilizado comúnmente células no neuronales de fácil acceso, como fibroblastos o linfocitos, que se transforman en células madre pluripotentes inducidas para el estudio de estas enfermedades; sin embargo, estas células tienen la desventaja de no contener todos los cambios epigenéticos mediados por el nicho neurogénico, lo que puede dificultar la integridad de los resultados y por lo tanto no poder transpolar los resultados a la enfermedad. Para superar este obstáculo se ha propuesto a las células madre ecto-mesenquimales, como modelos eficientes para enfermedades cerebrales ya que son células que están en estrecho contacto con el nicho neurogénico, se derivan de la misma capa germinal que las neuronas, se pueden recolectar mediante métodos no invasivos, consiguiendo crecer en grandes cantidades para producir poblaciones de células homogéneas que podrían ser utilizadas en diferentes ensayos biológicos. Conjuntamente se ha demostrado que las células madre ecto-mesenquimales derivadas de pacientes mantienen las propiedades asociadas con la enfermedad del paciente en diversos trastornos cerebrales, representando una excelente opción para estudiar enfermedades neurológicas, funcionando como “una ventana al cerebro”. Además, estas células se pueden utilizar para la detección sistemática de alto rendimiento, proceso que consiste en realizar múltiples análisis de células individuales mediante el uso de microscopía automatizada y análisis de imágenes, lo que permite efectuar distintos análisis cuantitativos de componentes celulares, como distribuciones espacio-temporales de proteínas individuales, estructuras del citoesqueleto, vesículas y orgánulos, frente a diversos compuestos químicos, permitiendo así el descubrimiento de nuevos posibles tratamientos para las distintas enfermedades neurodegenerativas que aquejan a la población.