La Malaria es una enfermedad producida por el parásito protozoario Plasmodium. La forma más severa de la malaria es causada por el parásito P. falciparum, el cual es el responsable de aproximadamente 500,000 muertes en el mundo anualmente [1]. P. falciparum tiene un ciclo de vida complejo y para sobrevivir en cada uno de sus hospederos atraviesa por diferentes estadios de diferenciación e inicia complejos programas de regulación de la expresión genética en respuesta a estímulos como: estrés, transición entre hospederos y mecanismos de defensa del huésped [2].
Numerosos estudios indican que la estructura de la cromatina y los factores epigenéticos son los mecanismos principales que regulan los cambios en la expresión de genes asociados con etapas del ciclo de vida del parásito. En este sentido se ha demostrado que la acetilación, la desacetilación y la metilación en los extremos amino terminal de las histonas que constituyen a los nucleosomas de P. falciparum, regulan la expresión de genes implicados en la variación antigénica, el desarrollo de las etapas sexuales que se transmiten al vector y en la expresión de los genes de virulencia [2].
En contraste con estas modificaciones químicas que son reversibles, recientemente se ha demostrado que la proteólisis del extremo amino terminal de la histona H3 es un nuevo mecanismo epigenético que es irreversible en eucariotas. Este evento ocurre en diferentes organismos como: ratón, levadura, pollo y más recientemente en los mastocitos. Sin embargo, el resultado biológico del procesamiento del extremo amino de la histona H3, difiere entre diferentes organismos y tipos de células. Por ejemplo, en ratón el procesamiento de la histona H3 conduce a la diferenciación de las células troncales, a la inducción de genes de esporulación en levadura y determina el linaje en los mastocitos [3].
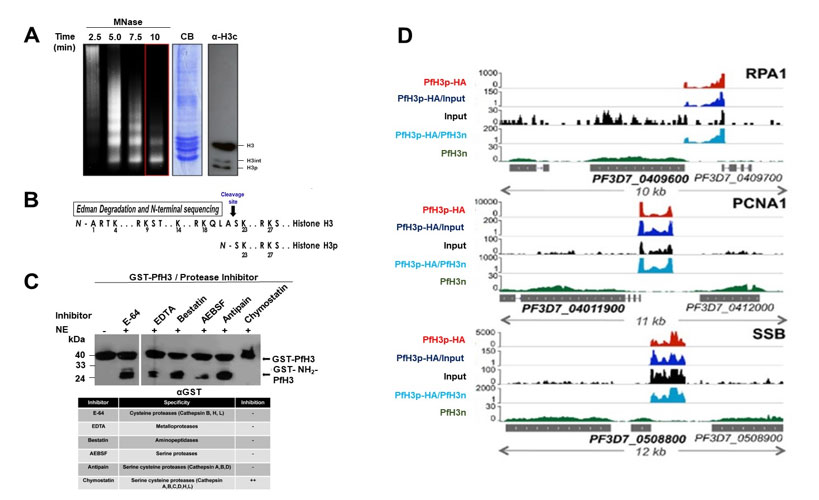
En este trabajo realizado en colaboración con el Dr. Artur Scherf en el Instituto Pasteur (publicado en la revista EMBO Reports), identificamos por primera vez en un protozoario patógeno el procesamiento del extremo amino terminal de la histona H3, el cual ocurre después del aminoácido Alanina en la posición 21, generando una histona H3 procesada (PfH3p), que carece de los primeros 21 aminoácidos y la cual forma parte de la cromatina (Figura 1A y B). Ensayos de actividad in vitro y empleando inhibidores de proteasas revelaron que este procesamiento es realizado por una catepsina C-like (Figura 1C). Posteriormente, el uso de parásitos que expresan una versión ectópica de la histona H3 procesada (PfH3-HA) reveló que se integra en los mononucleosoma y mediante ensayos de ChIP-seq (Chromatin Immunoprecipitation and next generation sequecing), demostramos que PfH3-HA se encuentra enriquecida en la regiones regulatorias de seis genes involucrados en la replicación y reparación del ADN (Figura 1 D). Así, este trabajo descubrió un nuevo mecanismo epigenético empleado por P. falciparum para regular la expresión de los genes relacionados con el metabolismo del ADN [4].
Considerando que la región amino terminal de la histona H3, comprendida entre los aminoácidos 1 a 21, es clave para la expresión de genes de virulencia en P. falciparum, la identificación de la endopeptidasa permitirá investigar el papel biológico del procesamiento de la histona H3 durante las diferentes etapas de desarrollo de este importante patógeno humano.
Referencias
- WHO 2015. Fact sheet: world malaria report 2015. http://www.who.int/malaria/publications/world-malaria-report-2015/report/en/
- Abel S1, Le Roch KG The role of epigenetics and chromatin structure in transcriptional regulation in malaria parasites. Brief Funct Genomics. 2019. doi: 10.1093/bfgp/elz005.
- Azad GK, Swagatika S, Kumawat M, Kumawat R, Tomar RS. Modifying Chromatin by Histone Tail Clipping. J Mol Biol. 2018. doi: 10.1016/j.jmb.2018.07.013
- Herrera-Solorio AM, Vembar SS, MacPherson CR, Lozano-Amado D, Meza GR, Xoconostle-Cazares B, Martins RM, Chen P, Vargas M, Scherf A, Hernández-Rivas R.Clipped histone H3 is integrated into nucleosomes of DNA replication genes in the human malaria parasite Plasmodium falciparum. EMBO Rep. 2019. doi: 10.15252/embr.201846331.
Herrera-Solorio AM1, Vembar SS2, Lozano-Amado D1, Scherf A2, Hernández-Rivas R1.
1Departamento de Biomedicina Molecular, CINVESTAV-IPN, 07360 Ciudad de México, México. 2Unité Biologie des Interactions Hôte-Parasite, Département de Parasites et Insectes Vecteurs, Institut Pasteur, Paris 75015, France.