La identificación de genes implicados en el desarrollo de algunos tipos de cáncer humanos da pauta para la investigación de nuevas estrategias farmacológicas contra estas patologías1. Un ejemplo claro de esto fue la tipificación de mutaciones activadoras del proto-oncogén KRAS, debido a que éstas ocurren en alrededor del 20% en los cánceres humanos; de manera importante se han identificado en las neoplasias con el peor pronóstico de supervivencia, como lo son el cáncer pancreático (90%), colorrectal (40%) y pulmonar (30%). Menos del 20% de los pacientes diagnosticados con cáncer pancreático sobreviven el primer año y el 5% sobreviven 5 años2.
En México, el cáncer pancreático se posiciona en la octava posición de muerte por neoplasia, presentando un riesgo alto en los estados del norte del país3; el cáncer colorrectal es la tercera causa de muerte3. Este mal pronóstico se debe a la baja respuesta que tiene la enfermedad a los tratamientos convencionales y su alta agresividad promovida por el desarrollo de quimiorresistencia a la mayoría de los tratamientos farmacológicos convencionales e incluso a la radioterapia, así como un diagnóstico tardío4.
Las mutaciones del gen KRAS son generalmente asociadas con la resistencia al tratamiento. Por ejemplo, los cánceres de pulmón con KRAS mutado son generalmente resistentes a los inhibidores de pequeñas moléculas dirigidas al receptor del factor de crecimiento epidérmico (EGFR), y en el cáncer colorrectal, las mutaciones de KRAS predicen la mala respuesta al tratamiento con anticuerpos anti-EGFR5. La proteína K-Ras es de gran importancia para el desarrollo, mantenimiento y progresión del adenocarcinoma ductal pancreático, ya que está involucrada en la regulación de la división celular por la vía de señalización RAS/MAPK, en la que la proteína transmite señales del exterior de la célula al núcleo y da instrucciones de división y/o diferenciación. La proteína K-Ras es una GTPasa, es decir, convierte a una GTP en GDP y así se inactiva y no transmite señales al núcleo; K-Ras se activa mediante su unión a GTP. En condiciones normales, las proteínas Ras se encuentran en equilibrio entre la forma activa e inactiva, pero las formas mutantes pierden la capacidad de hidrolizar al GTP y siempre permanecen en su forma activa. Por lo anterior, se buscan fármacos que logren interferir con los procesos de señalización de KRAS. Las proteínas de la subfamilia RAS y en específico la proteína KRAS, son miembros de una amplia clase de proteínas conocidas como proteínas CAAX6. Esto se debe a que la secuencia del extremo C-terminal presenta los aminoácidos CAAX (C: cisteína, A: aminoácido alifático, X: cualquier aminoácido) y dicha secuencia es modificada postraduccionalmente para conferir a las proteínas RAS afinidad por la membrana plasmática (para su posterior activación). Esta modificación es la incorporación de un grupo farnesilo en la cisteína del motivo CAAX7. La correcta localización y señalización de KRas4B es regulada por la proteína PDE6δ, la cual facilita su difusión en el citoplasma en donde consigue realizar señalizaciones que promueven el ciclo celular6. Dado que el transporte de KRas4B a la membrana plasmática es indispensable para la señalización celular, se han identificado compuestos que impiden la interacción del complejo heterodimérico KRas4B/PDE6δ7. El compuesto denominado Deltarasin, presenta una actividad inespecífica al no solamente afectar a las células cancerosas sino también a las células sanas8, debido a que la PDE6δ tiene un amplio repertorio de proteínas blanco además de la GTPasa KRas4B.
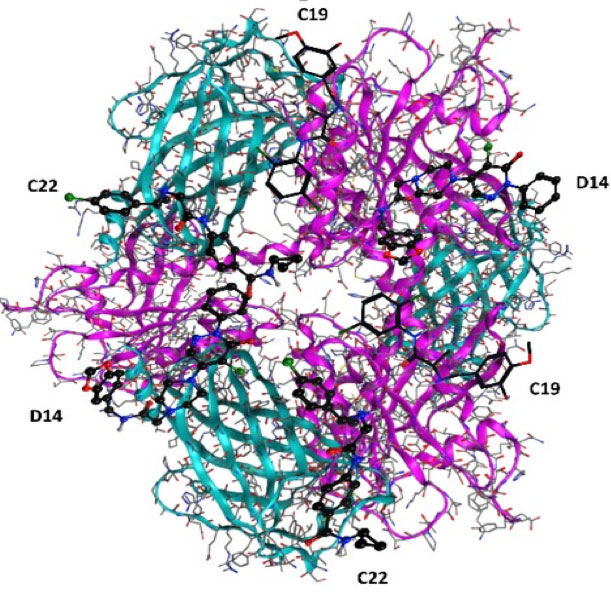
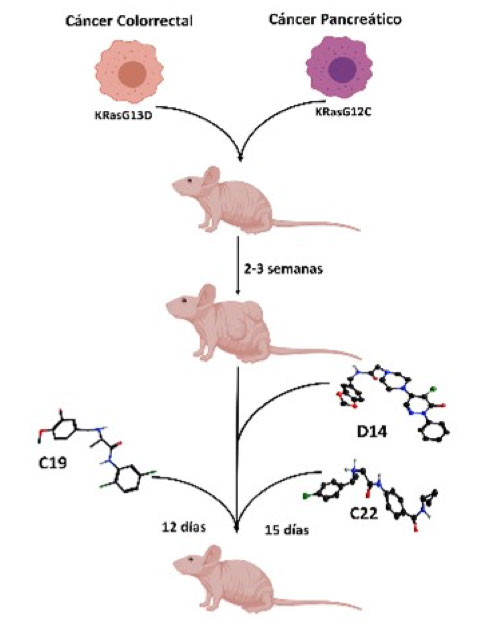
En nuestro grupo de trabajo nos enfocamos a estabilizar al complejo heterodimérico KRas4B/PDE6δ a través de softwares bioinformáticos, identificando pequeñas moléculas orgánicas con capacidad de interactuar con el complejo heterodimérico (Figura 1). Obteniendo los compuestos con mayor score de interacción se realizaron ensayos de viabilidad identificando a los compuestos que presentaran mayor efecto citotóxico sobre líneas celulares de cáncer pancreático y no sobre líneas celulares normales; estos compuestos fueron denominados como D14 y C228. Por otro lado, se evaluaron los compuestos en líneas celulares de cáncer colorrectal identificando al compuesto C19, el cual presentó alta citotoxicidad en líneas celulares onco-dependientes de KRas4B9. Estos compuestos mostraron una disminución en la activación de Ras dando como resultado una disminución en la vías de señalización de AKT y ERK, implicando una reducción en la proliferación celular, supervivencia, y aumentando la muerte celular in vitro. Estos resultados se vieron reflejados en ensayos in vivo en modelos de xenoinjerto subcutáneo de cáncer pancreático y colorrectal (Figura 2)8,9. En conclusión, podemos sugerir que los compuestos D14, C22 y C19 son nuevas drogas dirigidas contra el cáncer pancreático y colorrectal. Actualmente contamos con nuevos compuestos y análogos de éstos, los cuales muestran una mayor potencia farmacológica antineoplásica, específica, sobre las células cancerosas.
Referencias
- Sawyers CL, & van ‘t Veer LJ. Reliable and effective diagnostics are keys to accelerating personalized cancer medicine and transforming cancer care: a policy statement from the american association for cancer research. Clin Cancer Res. 2014; 20. doi: 10.1158/1078-0432.CCR-14-2295
- Cox AD, Fesik SW, Kimmelman AC, et al. Drugging the undruggable RAS: Mission possible? Nat Rev Drug Discov. 2014; 13. doi: 10.1038/nrd4389.
- Rizo-Ríos P, González-Rivera A, Sánchez-Cervantes F, et al. Trends in cancer mortality in Mexico: 1990–2012. Revista Médica del Hospital General de México. 2015; 78. doi.org/10.1016/j.hgmx.2015.03.010
- Ducreux M, Seufferlein T, Van Laethem JL, et al. Systemic treatment of pancreatic cancer revisited. Semin Oncol. 2019; 46. doi: 10.1053/j.seminoncol.2018.12.003
- Singh S, Trevino J, Bora-Singhal N, et al. EGFR/Src/Akt signaling modulates Sox2 expression and self-renewal of stem-like side-population cells in non-small cell lung cancer. Mol Cancer. 2012; 11. doi: 10.1186/1476-4598-11-73
- Ahearn IM, Haigis K, Bar-Sagi D, et al. Regulating the regulator: post-translational modification of RAS. Nat Rev Mol Cell Biol. 2011; 13. doi: 10.1038/nrm3255.
- Zimmermann G, Papke B, Ismail S, et al. Small molecule inhibition of the KRAS-PDEdelta interaction impairs oncogenic KRAS signalling. Nature. 2013; 497. doi: 10.1038/nature12205
- Casique-Aguirre D, Briseno-Diaz P, Garcia-Gutierrez P, et al. KRas4B-PDE6delta complex stabilization by small molecules obtained by virtual screening affects Ras signaling in pancreatic cancer. BMC Cancer. 2018; 18. doi: 10.1186/s12885-018-5142-7
- Cruz-Nova P, Schnoor M, Correa-Basurto J, et al. The small organic molecule C19 binds and strengthens the KRAS4b-PDEdelta complex and inhibits growth of colorectal cancer cells in vitro and in vivo. BMC Cancer. 2018; 18. doi: 10.1186/s12885-018-4968-3
Paola Briseño-Diaz1, Diana Casique-Aguirre1, Pedro Cruz-Nova1, Dayan A Carrion-Estrada1, Rocío Thompson-Bonilla2, Miguel Vargas1
1Departamento de Biomedicina Molecular, CINVESTAV-IPN, 07360 Ciudad de México, México.
2 Investigación Biomédica y Traslacional, Laboratorio de Medicina Genómica, Hospital 1° de Octubre, ISSSTE, México, México