Uno de los dogmas de la biología molecular establece que todas las instrucciones para el desarrollo de la identidad y funcionamiento de la célula se encuentran codificadas en su genoma; sin embargo, mucho antes de descifrar el genoma de diversos organismos, había evidencia de que la información sobre su secuencia no era suficiente para explicar cómo es que células con el mismo ADN pudieran tener una gran diversidad de identidades y funciones especializadas. Por ejemplo, en los humanos hay más de 200 tipos celulares en los diferentes órganos del cuerpo que, sin embargo, poseen la misma secuencia de ADN. Para comprender esto, tenemos que visualizar que el ADN no es una molécula lineal desnuda dentro del núcleo de las células eucariotas, sino que se encuentra en una conformación espacial dinámica conocida como cromatina. La cromatina es el resultado de la asociación del ADN con proteínas llamadas histonas, que al unirse al ADN generan regiones de ADN compacto y regiones de ADN relajado. Estos estados de la cromatina que mantienen al ADN compacto o relajado, permiten regular la activación de grupos específicos de genes, no solo para generar diferentes identidades celulares, sino también para permitir que las células respondan de manera adecuada a factores ambientales adversos, como altas o bajas temperaturas, deficiencia en nutrientes o trastornos causados por enfermedades. La regulación de la expresión genética que no se relaciona con cambios en la secuencia del ADN, como por ejemplo la remodelación de los estados de la cromatina, se conoce como regulación epigenética. Los procesos epigenéticos dan flexibilidad y versatilidad al genoma de un organismo que le permiten, desde definir los procesos de desarrollo hasta adaptarse a diferentes condiciones ambientales.
Las plantas, como organismos sésiles (que están confinados en un sitio determinado a lo largo de su desarrollo), requieren de un sistema robusto que les permita responder de manera rápida y efectiva a cambios ambientales que pueden ser desfavorecedores, y así garantizar la supervivencia de su progenie y el mantenimiento de su especie. Durante su desarrollo, las plantas están sujetas con frecuencia a diferentes tipos de estreses generados por cambios en la temperatura, disponibilidad del agua y nutrientes, la cantidad de irradiación solar, así como por la infección de microorganismos patógenos o el ataque de insectos herbívoros.
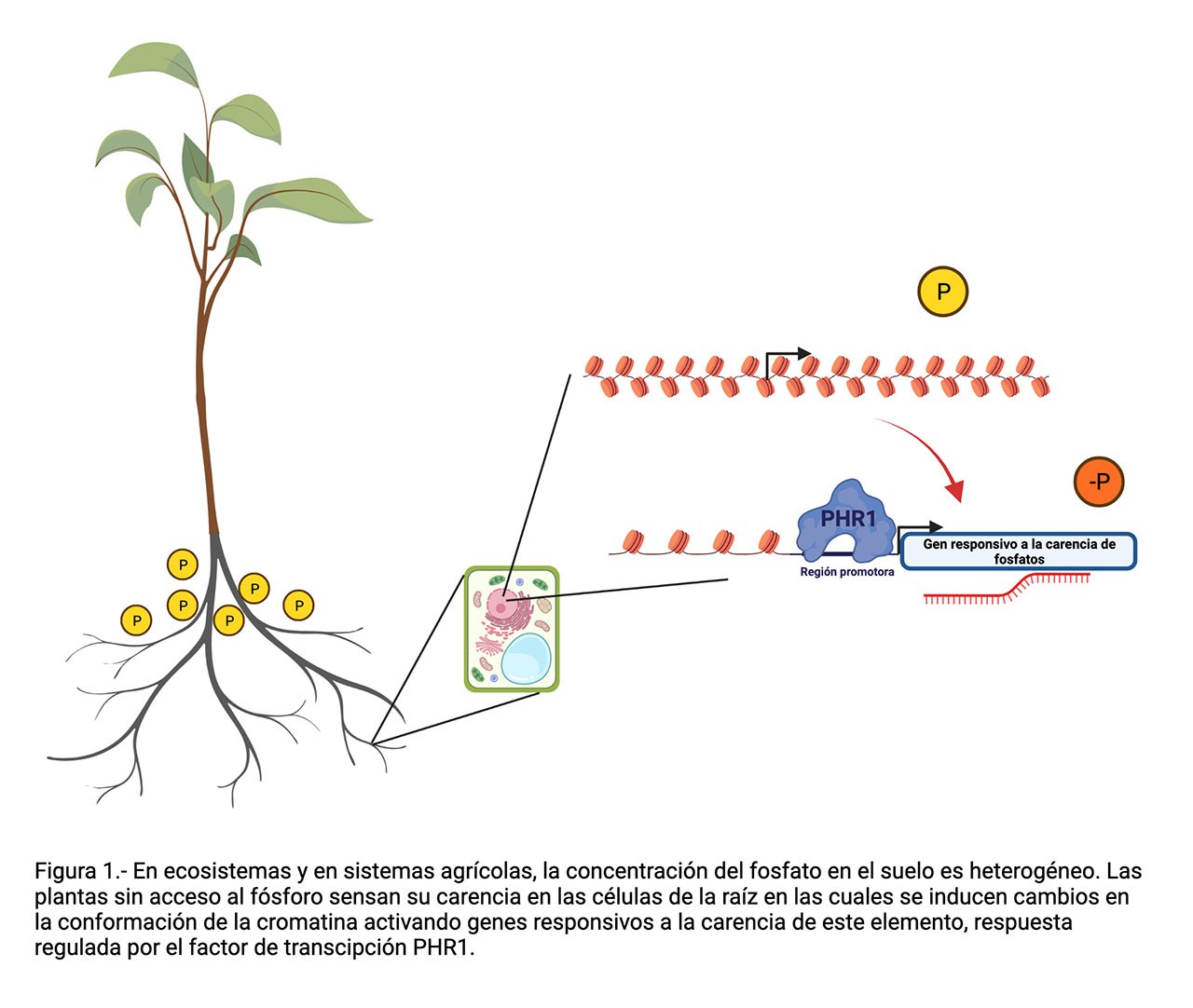
Debido a que el contenido de minerales en los diferentes tipos de suelos que existen en el planeta es muy variable, la disponibilidad de los compuestos inorgánicos que las plantas necesitan para su desarrollo (fósforo, nitrógeno, magnesio, potasio, etcétera) suele ser insuficiente para su crecimiento óptimo. Por esta causa, a lo largo de la evolución las plantas adquirieron mecanismos de regulación genéticos y epigenéticos que les permiten activar procesos para optimizar la extracción y aprovechamiento de nutrientes minerales del suelo.
El fósforo, en su forma química de ion fosfato, es uno de los nutrientes esenciales para el desarrollo correcto de los seres vivos, ya que forma parte de moléculas esenciales. Ejemplo de esto es la participación del fósforo formando “la columna vertebral” del ADN, es parte de los fosfolípidos que integran las membranas de la célula, y es indispensable en diferentes procesos metabólicos dependientes de energía, como lo es la molécula de ATP. La accesibilidad al fosfato en la tierra donde crecen las plantas es clave para que puedan crecer y desarrollarse. Debido a que la mayoría de los terrenos agrícolas tienen niveles de fosfato por debajo del requerido para sostener un crecimiento vigoroso de las plantas, la producción de alimentos agrícolas depende de la fertilización de los cultivos con fosfato. Desafortunadamente, la fertilización de los campos agrícolas es ineficiente porque el fosfato reacciona con componentes de la tierra quedando “atrapado” en una forma que ya no pueden absorber las plantas. Como consecuencia, típicamente se aplica más fertilizante, de hecho en cantidades superiores a las requeridas por las plantas, lo que después causa problemas ecológicos graves como la eutroficación, es decir, el aporte de un exceso de nutrientes derivado de actividades humanas generando un crecimiento descontrolado de algas con efectos adversos al ecosistema. Adicionalmente, diversos autores han sugerido que las reservas de roca fosfórica, principal fuente de fertilizantes fosfatados, podrían terminarse en los próximos 100 años si se continúan aplicando cantidades excesivas de fertilizante en el campo. La escasez de fósforo tendría como consecuencia el aumento en el costo de los productos agrícolas, y como consecuencia, se podría poner en riesgo la seguridad alimentaria de los seres humanos. Es entonces indispensable para entender cómo responden las plantas al estrés por carencia de fósforo y proponer nuevas estrategias que garanticen la producción agrícola.
Lo que se sabe hasta ahora es que la respuesta a la falta de fósforo en las plantas es regulada, principalmente, por un factor de transcripción (proteína que se une al ADN y regula la expresión genética) llamado PHR1 que actúa como regulador maestro de la respuesta a la carencia de fosfato. Es decir, PHR1 controla el encendido y apagado de genes que son requeridos para aumentar la capacidad de extracción y eficiencia de la asimilación del fosfato por parte de las plantas, cuando los niveles disponibles para absorción de este elemento son bajos. Cuando hay suficiente fósforo en la planta, PHR1 se encuentra en un estado inactivo, ya que se halla unido a otra proteína, un regulador negativo, llamado SPX1, que la mantiene inactiva. Por otro lado, en condiciones de deficiencia de fosfato, PHR1 se separa del inhibidor SPX1 y ahora puede activar la expresión de genes necesarios para que la planta se adapte y sobreviva a la falta del fosfato. Entre los genes activados se incluyen la algunos que codifican para proteínas transportadoras de alta afinidad a fosfato que incrementan la capacidad de la planta para extraer este nutriente del suelo, así como genes que controlan el patrón de crecimiento de la raíz de la planta y aumentan su capacidad de exploración dentro del suelo en búsqueda de fosfato adicional para su crecimiento.
En un trabajo que recién publicamos en la revista PNAS, realizado en colaboración con el grupo de investigación del Dr. Félix Recillas-Targa, del Instituto de Fisiología Celular de la UNAM, reportamos que cuando la planta se enfrenta a la escasez de fosfato, cambia el estado de la cromatina de los genes involucrados en la respuesta a la baja disponibilidad de fósforo. Durante el desarrollo de nuestra investigación, encontramos que la estructura de la cromatina se relaja, es decir, “se abre” en regiones que contienen muchos de los genes que requieren ser activados como respuesta a la carencia de fosfato, lo que facilita el aumento de su actividad o transcripción. En el mencionado trabajo, demostramos que en ausencia de PHR1, la mayoría de los genes que adquieren accesibilidad genómica como respuesta a la carencia de fósforo, no solo pierden su respuesta transcripcional sino también su accesibilidad genómica. Una posibilidad para explicar esta observación es que entre los genes activados por PHR1 se encuentren algunos involucrados en remodelar o relajar la cromatina, sin embargo, no encontramos ninguno de los que han sido ya identificados con esta función. Este resultado nos indujo a sugerir que PHR1 puede actuar como un factor de transcripción pionero, es decir, que se una al ADN en estado compactado o cerrado, y que recluta los complejos de remodelación de la cromatina para de esa manera permitir la entrada de la maquinaria basal de transcripción al cuerpo del gen y así activarlo.
Encontramos que en la zona del ADN donde se localizan otros genes implicados en la respuesta a bajo fósforo que no son activados directamente por PHR1, pero que también sufren cambios en el estado de su cromatina. Dado que entre los blancos directos de PHR1 existen muchos factores de transcripción, teorizamos que estos factores de transcripción son responsables de regular, en una segunda ola de respuesta, la accesibilidad de la cromatina de genes que no son blancos directos de PHR1, y así promover la respuesta genética a la carencia de fosfatos reportada por diversos grupos de investigación.
También determinamos que aún en condiciones de fósforo suficiente, donde se creía que PHR1 estaba totalmente inactivo, éste juega un papel importante como regulador de la transcripción basal de algunos genes, incluyendo diversos genes canónicos de la respuesta a la carencia de fosfatos, para mantener la concentración intracelular de fósforo, así como genes implicados en procesos epigenéticos como diferentes subunidades del complejo mediador (un complejo proteico que regula la transcripción de genes) y otros comprometidos con la organización de los cromosomas y de la cromatina. En trabajos anteriores señalamos que diferentes subunidades del complejo mediador son necesarias para la respuesta a la deficiencia de fosfato, lo que en conjunto con los datos generados en nuestro trabajo reciente, sugieren que PHR1 activa la expresión de genes implicados en el remodelado de la cromatina en condiciones de suficiencia de fosfato, mismos que en situación de baja disponibilidad de fosfato son reclutados por PHR1 para activar los genes efectores de la respuesta a la carencia de este elemento.
Algo que debe tomarse en cuenta es que en el genoma de la planta Arabidopsis (utilizada como modelo de estudio) se encuentran genes que codifican para proteínas muy similares a PHR1, incluyendo PHL1, PHL2, PHL3 y PHL4 que son proteínas con un papel similar a PHR1. Esto es debido a que, aun en plantas a las que se han eliminado dos de estas proteínas (PHR1 y PHL2), el sistema de respuesta a la carencia de fosfato no es abatido por completo, lo que indica que el sistema es robusto y posee varios reguladores de función similar para asegurar el abasto de este nutriente esencial.
Existen aun muchas preguntas por contestar, por ejemplo: ¿las proteínas similares a PHR1 responderán al estrés por carencia de fósforo de forma específica en determinado tejido?, ¿tendrán otra función?, ¿con qué proteínas interactúa directamente PHR1 para reclutar la maquinaria de remodelado de la cromatina como respuesta a la carencia de fosfato? ¿Es posible generar variedades epigenéticas con mayor eficiencia en la extracción y utilización del fosfato? y quizá la pregunta más importante, ¿cómo podemos crear nuevas estrategias de producción agrícola utilizando el nuevo conocimiento generado?
Sin duda los adelantos tecnológicos han producido nuevas formas de cuestionar la biología de las plantas, permitiéndonos conocer de manera mucho más profunda cómo es que estos organismos responden al estrés por carencia de fosfatos para así proponer nuevas estrategias y contribuir a garantizar la seguridad alimentaria de los seres humanos.