El sistema cardiovascular tiene dos componentes principales: el corazón y los vasos sanguíneos. El corazón puede considerarse como una bomba cuya función es eyectar la sangre a la circulación pulmonar para que sea oxigenada, y a la circulación sistémica para distribuir la sangre por todo el organismo. Los vasos sanguíneos funcionan como conductos ramificados y distensibles que distribuyen la sangre por todo el cuerpo. Cuando el funcionamiento del sistema cardiovascular se ve afectado pueden desencadenarse distintas patologías como la hipertensión, hipertrofia cardiaca (HC) e insuficiencia cardiaca congestiva (ICC). La hipertensión es una condición crónica en la que la presión arterial se encuentra por arriba de 140/90 mm Hg (sistólica/diastólica) y es el resultado de interacciones de factores vasoactivos (sustancias que producen un cambio para generar relajación o contracción de la pared vascular) con varios tipos de células. Por otra parte, la HC es considerada un mecanismo de compensación que se inicia como respuesta a un estímulo nocivo en el corazón, y que en sus primeras etapas sirve para mantener o incrementar el gasto cardiaco. Sin embargo, a largo plazo, la HC puede progresar a un estado de descompensación que se manifiesta con el desarrollo de ICC. Ésta es la incapacidad del corazón para satisfacer de manera adecuada las necesidades metabólicas del cuerpo.
En general, las alteraciones cardiovasculares tienen un alto índice de morbilidad y mortalidad, y se presentan generalmente en personas con enfermedades metabólicas como obesidad, diabetes o resistencia a la insulina. Ya que México ocupa uno de los primeros lugares en obesidad, es de suma importancia el estudio y desarrollo de moléculas con efectos protectores en el sistema cardiovascular, tal como el sulfuro de hidrógeno (H2S).
Sulfuro de hidrógeno (H2S)
La historia del sulfuro de hidrógeno (H2S) se remonta a los años 1700, cuando Bernandino Ramazzini (el padre de la medicina ocupacional), describió una enfermedad característica de los trabajadores del alcantarillado de París, que consistía en inflamación e irritación de los ojos y la garganta, y se asoció con el gas que se producía en las alcantarillas. Para 1770, el “gas de las alcantarillas” generó un problema de salud en Paris. Fue hasta 1806 cuando se confirmó la presencia de este gas en el sistema de alcantarillado. Desde entonces, al H2S también se le conoce como el “gas de las alcantarillas”.
La visión con la que los científicos veían al H2S dio un cambio radical en 1989, cuando el toxicólogo canadiense Goodwin y sus colaboradores se interesaron en determinar la cantidad de gas que llegaba a diferentes estructuras cerebrales, después de una administración intraperitoneal en roedores de un donador de H2S. De manera sorprendente, el grupo de trabajo dirigido por Goodwin encontró que los roedores que no habían recibido la administración del donador mostraban niveles considerables de H2S en el tejido cerebral. Esto permitía especular que el H2S se producía de manera endógena en el cerebro de los roedores. En 1996, Abe y Kimura demostraron por primera vez un efecto fisiológico mediado por el H2S. Los investigadores encontraron que el H2S era capaz de actuar como neuromodulador, es decir, regulaba la comunicación entre las neuronas. En 2001, se demostró que el H2S inducía efectos relajantes en los vasos sanguíneos. El H2S fue reconocido como un gasotransmisor (molécula gaseosa con funciones fisiológicas relevantes) en el 2002, luego de que Rui Wang lo validara contra los seis criterios clásicos de un gasotransmisor (Tabla 1).
A la fecha, sabemos que el H2S se sintetiza endógenamente por: (1) vías no enzimáticas en células propias de nuestro organismo y bacterias de la microbiota a través del metabolismo de la glucosa, polisulfuros y aminoácidos que contienen grupos sulfuro, y (2) vías enzimáticas que incluyen a la cistationin-γ-liasa (CSE), cistationin-β-sintetasa (CBS), y 3-mercaptopiruvato sulfurtransferasa (3-MST) (Figura 1). Para mantener un balance de los niveles endógenos, el H2S es metabolizado a través de 3 rutas que incluyen reacciones de oxidación en la mitocondria, la metilación (adición de un grupo metilo) por acción de la enzima tiol-S-metiltransferasa, y la unión a la hemoglobina.
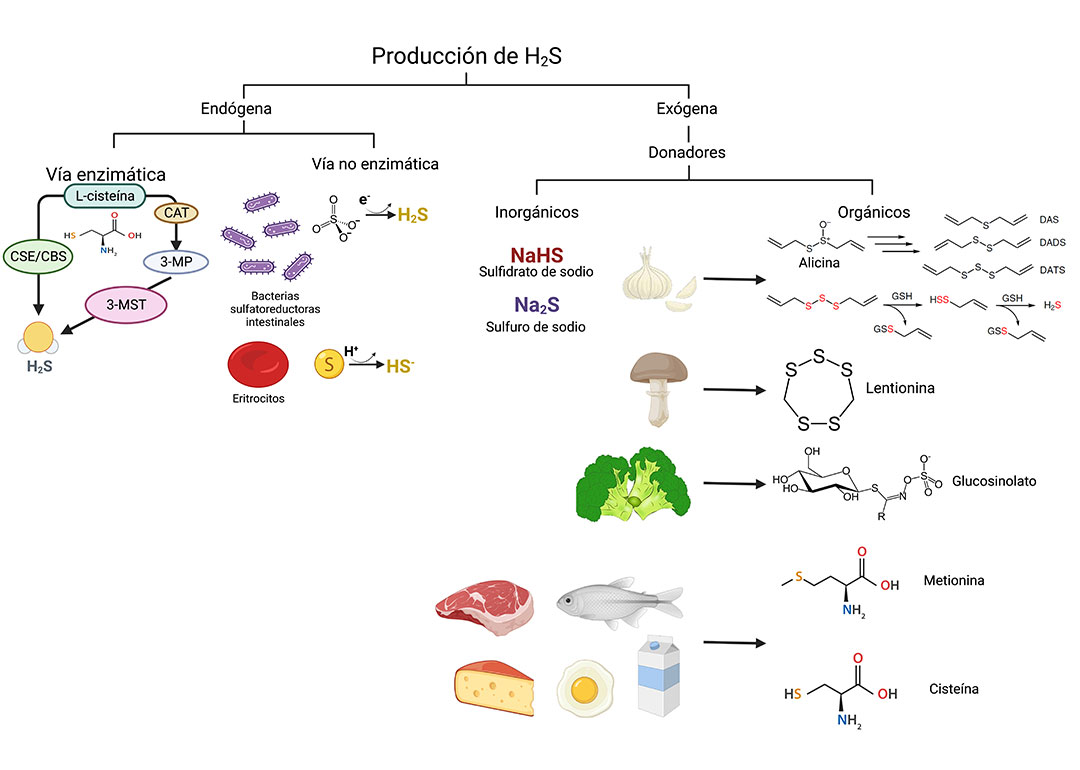
Los alimentos como donadores de H2S
Los denominados “donadores” de H2S son compuestos que se degradan en respuesta a un desencadenante específico para liberar H2S; la naturaleza de estos compuestos puede ser orgánica e inorgánica e incluye una amplia variedad de grupos funcionales y sistemas de administración. Existen una gran cantidad de estudios que han utilizado donadores inorgánicos a base de sales de sulfuro, como el NaHS o Na2S, como herramientas para modelar los efectos biológicos del H2S e investigar los mecanismos de acción. Esto se debe en gran parte a su alta solubilidad en agua, fácil disponibilidad y comodidad general. A diferencia de los donadores inorgánicos, se ha descubierto que algunos compuestos naturales presentes en varios vegetales y alimentos pueden producir H2S de manera lenta pero controlada y tienen el potencial de utilizarse como donadores exógenos (Figura 2).
Los productos naturales capaces de liberar H2S pueden actuar como donadores exógenos de H2S. Los compuestos comúnmente aislados de los productos naturales de azufre son los polisulfuros sustituidos con alilo (principalmente en forma de disulfuros, trisulfuros y tetrasulfuros), haciéndolos potenciales liberadores de persulfuros o H2S.
En alimentos del género Allium (ajos, cebollas, puerros, echalotes, entre otros), se han identificado y aislado diversos productos que contienen polisulfuros, principalmente trisulfuros y tetrasulfuros. Estos polisulfuros orgánicos proporcionan una fuente de azufre que puede convertirse en H2S tras su reducción. Particularmente, en el ajo se ha encontrado la presencia de alicina, una molécula que al descomponerse forma una variedad de combinaciones ricas en azufre, incluidos el sulfuro de dialilo (DAS), el disulfuro de dialilo (DADS) y el trisulfuro de dialilo (DATS), los cuales liberan H2S en presencia de glutatión reducido (GSH). Esto ha hecho que a estos alimentos se les atribuyan actividades vasoactivas importantes que contribuyen a tener impactos positivos en la amortiguación de los factores de riesgo de las enfermedades cardiovasculares.
Los polisulfuros cíclicos son otro grupo de compuestos organosulfurados que pueden ser donadores de H2S, los cuales se encuentran en vegetales como los espárragos. De este grupo de compuestos, se ha caracterizado la lentionina que se halla en abundancia en los hongos Shiitake. La actividad de estos polisulfuros cíclicos como donadores se ha atribuido a que pueden actuar como moléculas de almacenamiento funcionales para el azufre, y que las cadenas de polisulfuro pueden generar fuentes de azufre de valencia cero (S0) susceptibles a reducción por el GSH para producir H2S.
El consumo de alimentos ricos en azufre es muy importante, ya que se trata del tercer mineral más abundante en el organismo, por detrás del calcio y fósforo. El azufre elemental es obtenido a través de la dieta y se utiliza para la producción de H2S de forma endógena a través de vías no enzimáticas. Existen diversos grupos de alimentos que actúan como fuentes naturales de azufre, como los vegetales crucíferos que incluyen coliflor, col rizada, rúcula, brócoli, coles de Bruselas o el repollo y que son ricos en glucosinolato como fuente de azufre. Adicionalmente, el consumo de alimentos ricos en aminoácidos azufrados como la metionina y la cisteína contribuyen a la producción endógena de H2S por vía enzimática. Podemos encontrar estos aminoácidos en alta proporción en productos con abundante contenido proteico como la carne, el pescado, pollo, huevo, productos lácteos y mariscos. Otros alimentos que también contribuyen a la ingesta diaria de azufre son grosella, frambuesa, nueces, almendras, semillas de girasol y algunos frutos secos como dátiles, higos y pasas, pues contienen dióxido de azufre. Por ello, el consumo de alimentos con actividad potencial como donadores de H2S, es una alternativa que puede ayudar al tratamiento de afecciones que involucren alteraciones en las concentraciones de este gasotransmisor.
Efectos del H2S en la presión arterial
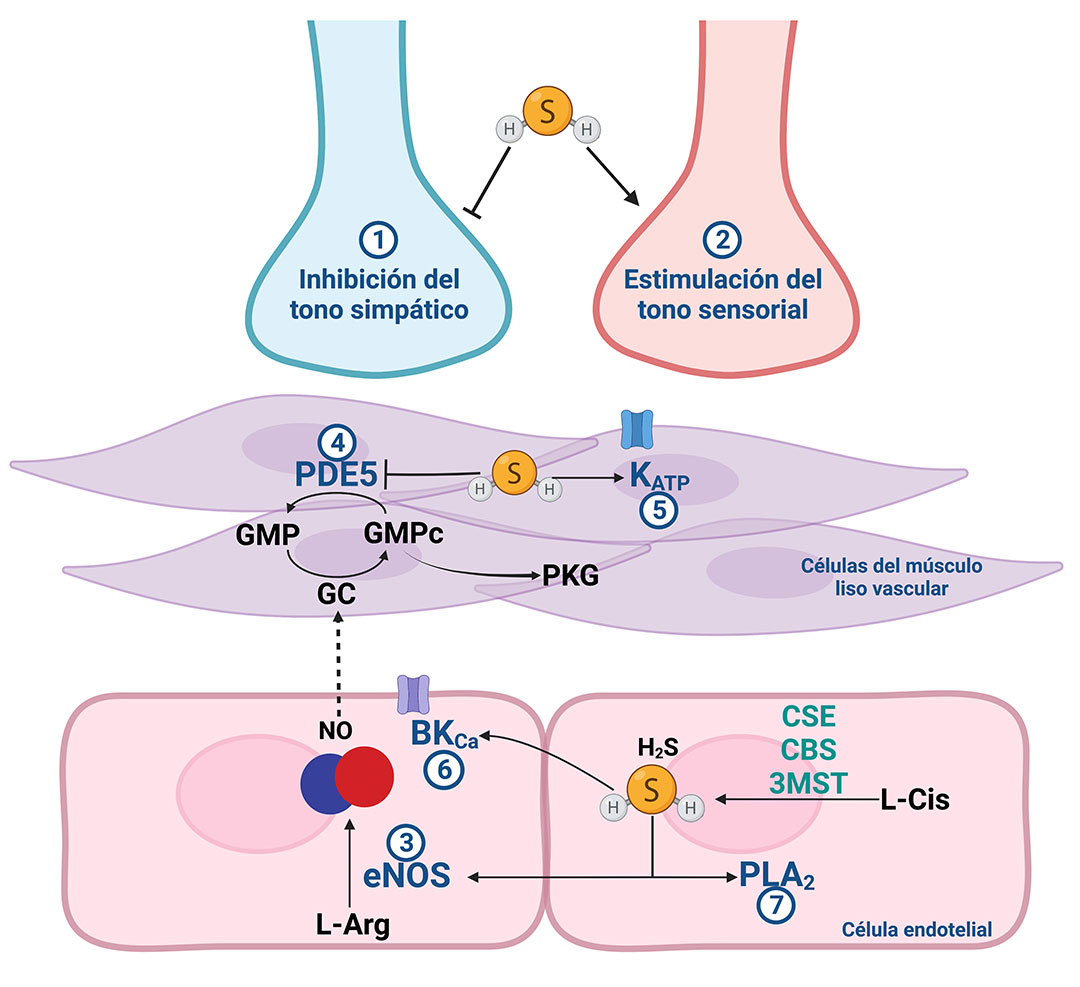
Los cambios en el diámetro de los vasos sanguíneos se presentan por activación del músculo liso. Estos cambios están mediados por las neuronas del sistema nervioso autónomo, señales bioquímicas y metabólicas, o sustancias vasoactivas liberadas por el endotelio vascular. El control de estos mecanismos es de vital importancia para el mantenimiento de la perfusión de los órganos y la presión arterial. Se ha demostrado que el H2S es capaz de regular el funcionamiento de los vasos sanguíneos pues genera una disminución en la presión sanguínea.
El H2S induce relajación del músculo liso vascular a través de la regulación del sistema nervioso y de mecanismos locales en los vasos sanguíneos (Figura 3). El efecto del H2S en el sistema nervioso autónomo continúa como tema de debate entre la comunidad científica, ya que algunas investigaciones apuntan a que el H2S puede inducir efectos tanto excitadores como inhibidores en las estructuras del cerebro (hipotálamo y tallo cerebral) que regulan el sistema nervioso autónomo. Los efectos excitadores del H2S en el hipotálamo y el tallo cerebral promueven un incremento en la presión arterial, mientras que los efectos inhibidores inducen el resultado opuesto. En la periferia (fuera del cerebro y la médula espinal) se ha probado que el H2S es capaz de inhibir la liberación de noradrenalina y de estimular la liberación del péptido relacionado con el gen de la calcitonina (CGRP, por sus siglas en inglés), teniendo como resultado una disminución en la presión arterial. Estudios realizados en modelos animales de obesidad y resistencia a la insulina confirman que el H2S previene las alteraciones cardiovasculares inducidas por dichas patologías a través de la inhibición del sistema nervioso simpático.
Por otra parte, el H2S modula la síntesis y señalización del óxido nítrico (NO), el cual es uno de los factores relajantes derivados de la capa endotelial de los vasos sanguíneos. Además, el H2S puede producir vasorelajación activando canales iónicos como el canal de potasio dependiente de ATP (KATP) en el músculo liso o el canal de potasio dependiente de calcio (BKCa) en el endotelio, así como modulando la vía del ácido araquidónico a través de la activación de la fosfolipasa A2 (PLA2, por sus siglas en inglés), una vía que está encargada de la regulación de los fosfolípidos de la membrana celular.
Efectos del H2S en el corazón
El corazón posee tres propiedades funcionales que permiten su correcto funcionamiento: inotropismo (contractilidad), cronotropismo (automatismo) y dromotropismo (conductibilidad). En años recientes, al H2S se le han atribuido efectos de cardioprotección y cronotropismo e inotropismo negativos por medio de la activación de canales KATP. Además, diversos estudios destacan el papel del H2S en el mantenimiento de la homeostasis cardiovascular en condiciones patológicas que incluyen la isquemia miocárdica, insuficiencia e hipertrofia cardiaca. Las concentraciones endógenas de H2S se encuentran disminuidas durante la HC. De hecho, en modelos animales se observa que la ICC que se desarrolla en respuesta a la hipertensión arterial es mayor en los ratones que carecen de la enzima CSE, y que la administración de un donador de H2S disminuye la HC y la fibrosis cardiaca. Adicionalmente, el H2S mejora la función cardiaca en modelos de ICC mediante la supresión de respuestas inflamatorias. Asimismo, disminuye el tamaño del infarto en el ventrículo izquierdo y la mortalidad asociada con la isquemia miocárdica en modelos animales.
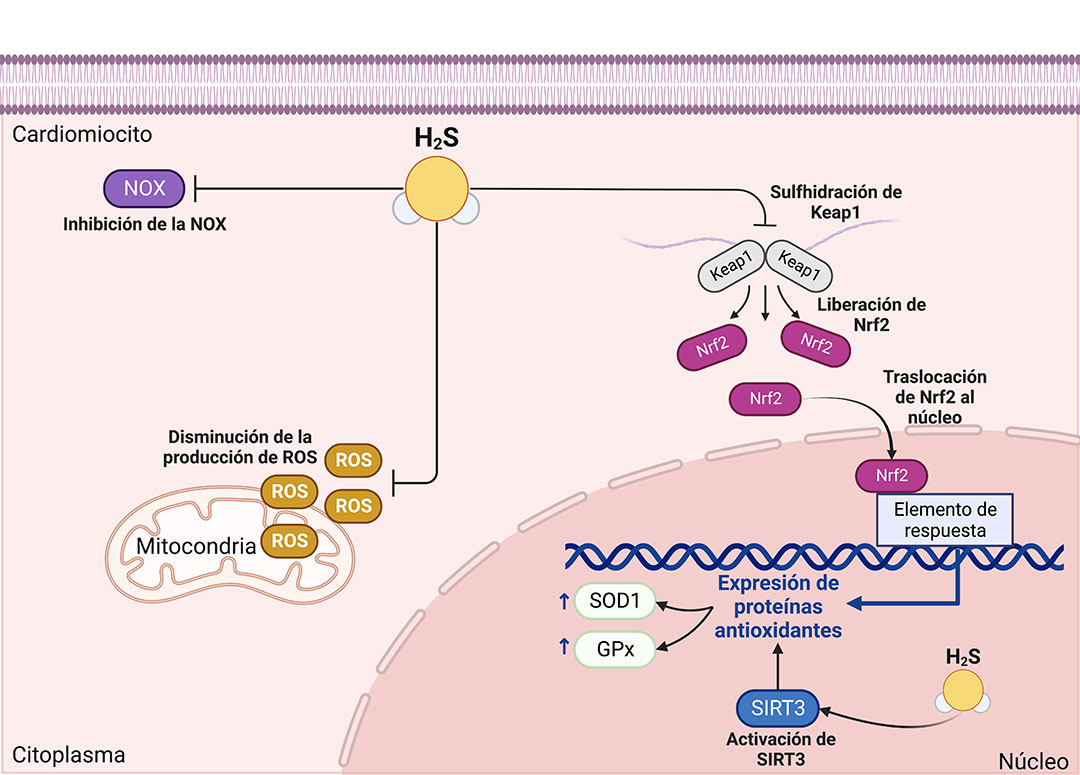
Por último, los efectos benéficos del H2S en la homeostasis cardiovascular están asociados con su efecto antioxidante. Al respecto, se sabe que este gasotransmisor participa en la regulación de diferentes vías de señalización asociadas con el incremento o disminución del estrés oxidante en el miocardio. Diferentes modelos experimentales que desarrollan enfermedades cardiovasculares demuestran que el H2S genera: (1) activación de las vías de señalización Nrf2/Keap1 y SIRT3, (2) reducción de los niveles plasmáticos de especies reactivas de oxígeno (ROS), (3) disminución en los niveles de angiotensina II (Ang II), lo que se asocia con una reducción en la actividad de la NADPH oxidasa (NOX), (4) incremento de los niveles séricos y la actividad de diferentes enzimas antioxidantes, y (5) reducción de los niveles del malondialdehído (un indicador de estrés oxidante en el organismo).
Conclusión
El H2S es un gas de senalización que nuestro cuerpo es capaz de sintetizar de manera endógena y que regula diversas funciones en el sistema cardiovascular. Sin embargo, existen algunas patologías asociadas con enfermedades metabólicas que ocasionan un déficit en la producción de H2S. Por lo tanto, es recomendable ingerir de manera regular alimentos que puedan ser donadores de H2S para ayudar a mantener el equilibrio de nuestro sistema cardiovascular y prevenir el desarrollo de diversas patologías.
Referencias
Abe, K. y Kimura, H. (1996). The possible role of hydrogen sulfide as an endogenous neuromodulator. Journal of Neuroscience, 16(3), 1066–1071.
Goodwin, L. R., Francom, D., Dieken, F. P., Taylor, J. D., Warenycia, M. W., Reiffenstein, R. J. y Dowling,G. (1989). Determination of sulfide in brain tissue by gas dialysis/ion chromatography: postmortem studies and two case reports. Journal of Analytical Toxicology, 13(2), 105–109.
Pluth, M., Bailey, T., Hammers, M., Hartle, M., Henthorn, H., & Steiger, A. (2015). Natural Products Containing Hydrogen Sulfide Releasing Moieties. Synlett, 26(19), 2633–2643.
Szabo, C. (2017). A timeline of hydrogen sulfide (H2S) research: From environmental toxin to biological mediator. Biochemical Pharmacology, 149(1), 5–19.
Wang, R. (2002). Two’s company, three’s a crowd: can H2S be the third endogenous gaseous transmitter? The FASEB Journal, 16(13), 1792–1798.
Zaorska, E., Tomasova, L., Koszelewski, D., Ostaszewski, R., & Ufnal, M. (2020). Hydrogen Sulfide in Pharmacotherapy, Beyond the Hydrogen Sulfide-Donors. Biomolecules, 10(2), 323.
Zhao, W., Zhang, J., Lu, Y. y Wang, R. (2001). The vasorelaxant effect of H(2)S as a novel endogenous gaseous K(ATP) channel opener. The EMBO Journal, 20(21), 6008–6016.