La albúmina de suero bovino (BSA) es una proteína que se suele usar en ensayos bioquímicos y como nutriente en medios de cultivo. Sus aplicaciones en el desarrollo de fármacos y en el procesamiento de alimentos son abundantes, debido a su alta estabilidad. Se encuentra de manera importante en el suero de los bovinos, contribuyendo en alrededor del 50% al total de las proteínas. En el caso de los seres humanos, existe una proteína análoga, la albúmina sérica humana (HSA), que es producida en el hígado y es la más abundante en el plasma sanguíneo. Funciona como reguladora del pH y acarreadora de importantes moléculas.
La BSA es una molécula muy pequeña (entre 5-10 nm), y se conforma por 583 aminoácidos. Es interesante, en general, que las fichas técnicas reportan que esta proteína se disuelve como monómero. Sin embargo, su estado de aglomeración (formación de oligómeros) es sorprendente, pues aun siendo sometida a alta sonicación, es imposible separarla.
La BSA es una proteína cargada negativamente; esto permite que sea afín al agua, transportando ácidos grasos, hormonas, vitaminas y sales, y distribuyendo estas sustancias a todas las células del organismo.
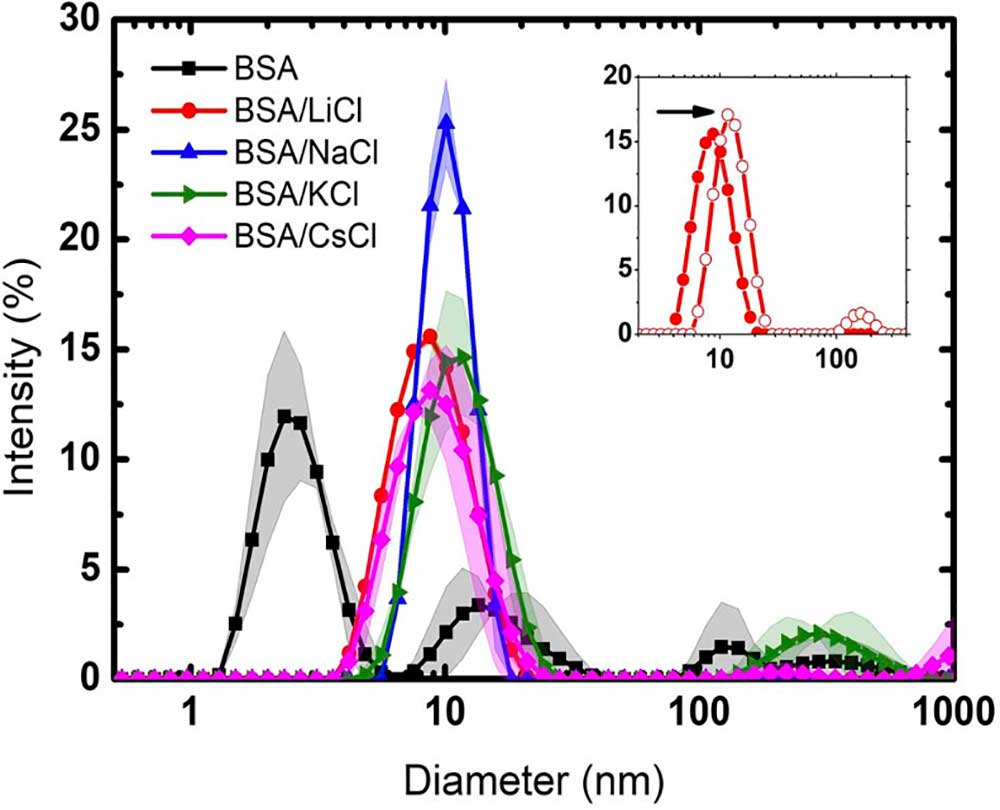
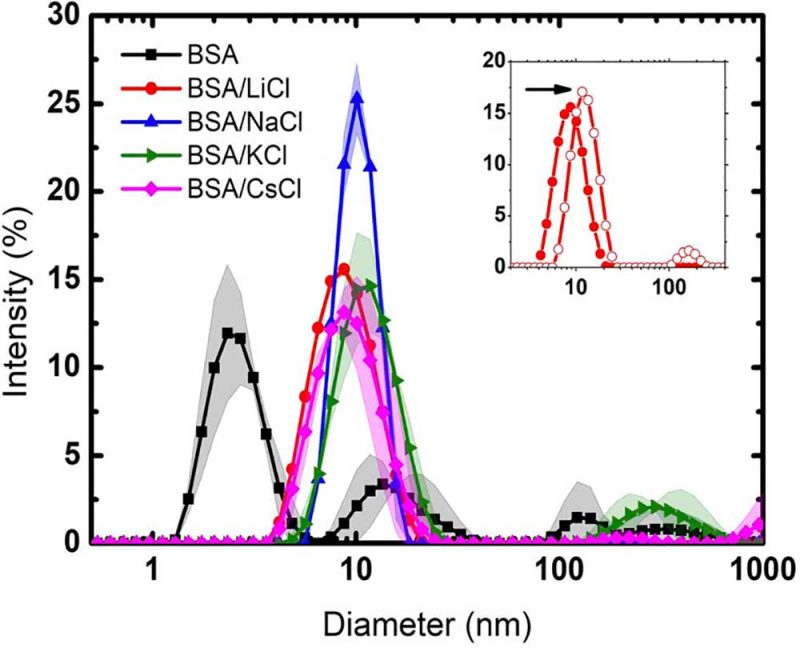
Como en toda proteína, las moléculas de agua circundantes no sólo se organizan para formar una capa de hidratación, sino que constituyen una parte integral de ésta, brindándole estructura, estabilidad y funcionalidad. Las moléculas de agua circundantes tienen propiedades únicas que no se encuentran en el agua cotidiana (agua en bulto). No obstante, tal capa de hidratación es perturbada por iones que siempre están presentes en el entorno de la proteína, y su efecto depende de la naturaleza y concentración de éstos. Con el fin de entender cómo ocurre tal proceso, en un trabajo reciente publicado en la revista RSC Advances (Yojana J.P. Carreón et al, RSC Adv., 2025, 15, 244, DOI: 10.1039/d4ra04503c), exploramos el efecto de cuatro haluros de metales alcalinos: LiCl, NaCl, KCl y CsCl, en una suspensión diluida de BSA. Los iones Li+ y Na+ son considerados kosmótropos, en tanto que K+ y Cs+ son caotrópicos. Los primeros, incrementan la estabilidad de la proteína y reducen su solubilidad. Los segundos, tienen un efecto contrario.
Para llevar a cabo el estudio, utilizamos varios métodos experimentales: dispersión dinámica de luz, calorimetría diferencial de barrido, termogravimetría, espectroscopia infrarroja por transformada de Fourier y análisis de imágenes. Descubrimos que el Li+ y Na+ en una concentración de 75 mM, previenen la aglomeración de la proteína. Además, el tamaño del ión afecta la interacción con la estructura secundaria de ésta. A través de la evaporación de suspensiones diluidas de BSA, logramos diferenciar entre agua en bulto y agua de hidratación (la primera capa de moléculas que rodea la superficie de la proteína).