El cáncer de mama (CaMa) es la causa más común de muerte por cáncer en mujeres en el mundo. Se estima que una de cada doce mujeres padecerá esta enfermedad a lo largo de su vida (WHO, 2023). En México, durante 2020 se reportaron 29,929 casos nuevos de CaMa y 7,931 muertes con una tasa de incidencia de 40.5 y de mortalidad de 10.6 por 100 mil habitantes. La aparición de este cáncer se ha asociado a factores hereditarios como son: las mutaciones en los genes BRCA1, BRCA2, y TP53 en el DNA, los factores reproductivos, el uso prolongado de anticonceptivos orales y terapias de sustitución hormonal y el estilo de vida de cada persona considerando consumo de alcohol, sobrepeso y obesidad (IARC, 2020).
El CaMa se manifiesta a partir del crecimiento descontrolado de los diferentes tipos de células del tejido mamario (células epiteliales, ductales o glandulares). Inicialmente se presenta la aparición de una masa tumoral definida, en el pecho, con bajo potencial de diseminación a otras partes del cuerpo (American Cancer Society, 2023). Sin embargo, algunos estímulos como un microambiente inflamatorio pueden favorecer su propagación (metástasis) mediante la inducción de características malignas en las células cancerosas que aumentan su capacidad de migración, invasión, resistencia a ciertos fármacos y la expresión de mecanismos relacionados con una mayor multiplicación celular y sobrevivencia (Lim et al., 2018; Yang & Lin, 2017).
Debido a esto, gran parte de los estudios sobre cáncer mamario se han centrado en caracterizar la malignidad de los tumores y su asociación con la inflamación, así como el empleo de fármacos específicos para eliminarlos. En cambio, poco se ha estudiado en relación con los mecanismos de transición a la malignidad inducida por el ambiente tumoral. ¿Cómo se lleva a cabo esta transición? ¿Cuáles son las moléculas que detonan los cambios estructurales y moleculares que conducen a la inducción y desarrollo de un cáncer invasivo? Son preguntas que aún no tienen respuesta.
Para responder estas interrogantes diseñamos un modelo in vitro utilizando una línea celular de cáncer mamario no invasivo (células llamadas MCF-7). Nuestros resultados mostraron que el estímulo de estas células con la citocina proinflamatoria IL-1β, reportada aumentada en pacientes con cáncer mamario, fue suficiente para inducir la transformación de las células MCF-7 en células malignas (a las que denominamos células 6D). Encontramos que la conversión a la malignidad se lleva a cabo a través de una vía de señalización (mecanismos intracelulares), no reportada previamente, a la que nombramos IL-1β/IL-1RI/β-catenina (Figura 1).
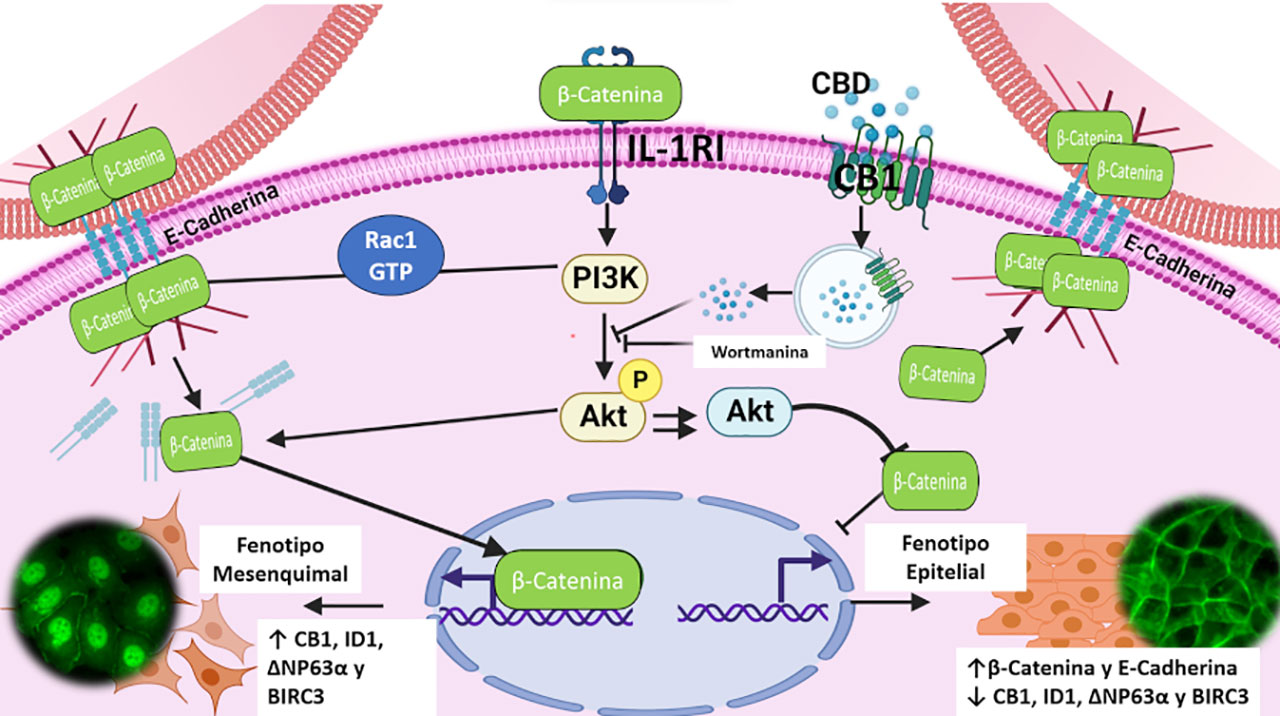
El primer paso de la activación de dicha vía inicia con la unión de la citocina IL-1β con su receptor (IL-1RI), lo cual provoca la activación de este último, el rearreglo del citoesqueleto de las células y la sobreexpresión de las proteínas llamadas PI3K, Rac y AKT, al mismo tiempo que ocurre la disociación de los complejos de unión adherente de las membranas de las células no invasivas, liberando a la proteína β-catenina al citoplasma. La pérdida de contacto entre las células permite que β-catenina se transloque al núcleo, donde funciona como un regulador de la transcripción selectiva de genes que codifican para las proteínas (ID1, CB1, ΔNP63α, BIRC3) reclutadas a la vía de señalización de la IL-1β (Figura 1) como efectoras para la expresión de cambios moleculares y estructurales tales como: aumento de motilidad, invasión, proliferación, sobrevivencia y resistencia a drogas.
Utilizando dos de las drogas más empleadas en el tratamiento de CaMa (cisplatino y doxorrubicina), encontramos que durante la transición a la malignidad inducida por IL-1β, se aumenta la expresión de las proteínas ΔNP63α y BIRC3, que son marcadores de la resistencia a estos dos fármacos (Pérez-Yepez et al., 2014; Mendoza-Rodríguez et al., 2017, 2019). Una vez establecidos estos mecanismos, surgió la necesidad de investigar y desarrollar una estrategia enfocada a bloquear o revertir la vía de señalización que se muestra en la Figura 1.
En la búsqueda de algún compuesto útil para bloquear la vía de señalización de IL-1β y reducir la sobrevivencia de las células malignas, se encontró que éstas sobreexpresan en su membrana celular el receptor para Cannabinoides 1 (CB1). Este receptor se ha reportado como parte de un sistema de señalización de moléculas conocidas como endocannabinoides, compuestos derivados del ácido araquidónico que normalmente están presentes en las células del cuerpo participando en el desarrollo neurológico y la inflamación.
La expresión de CB1 nos sugirió la posibilidad de usar el Cannabidiol (CBD) como una molécula que podría bloquear la señalización de IL-1β y la transición de células no invasivas a células malignas. Empíricamente, CBD se ha utilizado en enfermedades autoinmunes, desórdenes alimenticios, trastornos neurológicos, enfermedades cardiacas y cáncer, sin conocer los mecanismos mediante los cuales tiene un efecto antinflamatorio (Mouhamed et al., 2018; Nahler, 2022). Al ser un cannabinoide no psicotrópico, CBD se distribuye libremente con fines medicinales sin control de las dosis administradas.
En nuestro modelo in vitro, al administrar CBD a las células 6D observamos que fue capaz de bloquear y revertir los efectos inducidos por IL-1β, ejerciendo un efecto adyuvante durante el tratamiento de estas células con el fármaco anticancerígeno cisplatino (García-Morales et al., 2020). Los resultados obtenidos con las células 6D demostraron que la vía por la cual se adquieren algunas de las características asociadas a malignidad en células cancerosas, puede ser bloqueada por CBD, de tal forma que se podría diseñar un modelo in vivo en el cual se pudiera evaluar el uso de CBD como una molécula útil en el tratamiento del CaMa con mayor seguridad para su uso.
Para esto, usamos ratones inmunodeficientes (ratones desnudos nu/nu), a los cuales se les inocularon las células 6D en la parte dorsal y una vez que desarrollaron el tumor, los ratones fueron tratados con CBD. En forma paralela otro grupo de ratones se trataron con CBD por varios días previos a la inyección de las células 6D. En ambos casos se logró favorecer la reducción de los tumores y en algunos ratones se llegó hasta una notable reabsorción (Figura 2). Los estudios moleculares de los tumores indicaron que el efecto inhibidor de CBD se debe al bloqueo causado en la vía de señalización IL-1β/IL-1RI/β-catenina, específicamente al nivel de la activación de la proteína AKT, que es un punto crítico de la vía de señalización. Estos resultados confirmaron aquellos previamente determinados en el modelo in vitro. Además, en el modelo in vivo se pudo estudiar que existe una comunicación de esta vía con otras señales participantes en el proceso de muerte celular programada (apoptosis) y de la inhibición de factores asociados con la vascularización de los tumores que favorecen el desarrollo tumoral (García-Morales et al., 2023).
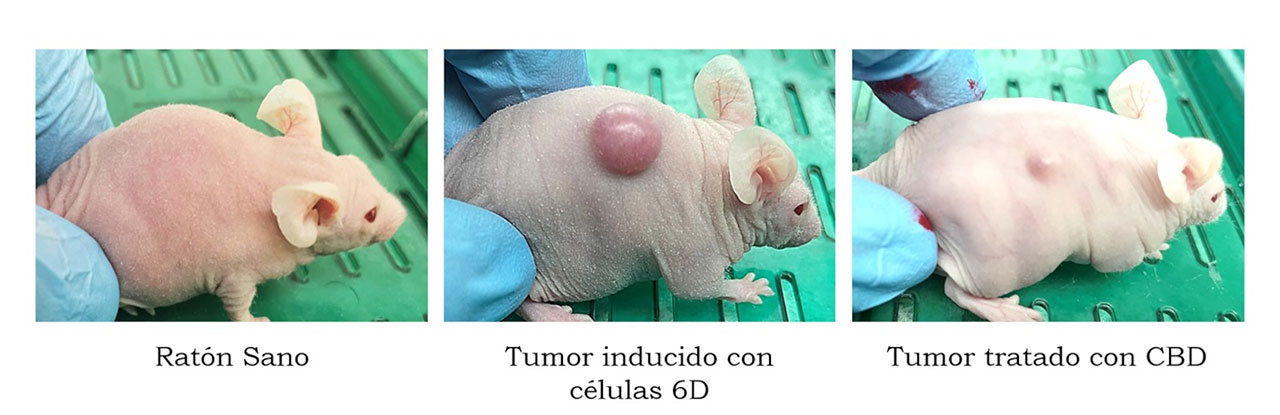
En resumen, a partir de nuestros modelos in vitro e in vivo, encontramos mecanismos por los cuales se induce la malignidad de las células de cáncer de mama, originalmente no invasoras, que les permiten formar tumores malignos; así mismo, se han investigado alternativas para bloquear o revertir dicho proceso. Los datos obtenidos con estos modelos, basados en la importancia de un microambiente inflamatorio como un inductor de transición a la malignidad, puede ser contrarrestado con una administración adecuada y supervisada de CBD, inhibiendo la expresión de rasgos malignos asociados a la transición generada por dicho ambiente.
Referencias:
WHO. (2023). Breast Cancer. https://www.who.int/news-room/fact-sheets/detail/breast-cancer
IARC. (2020). GLOBOCAN 2020: Estimated cancer incidence, mortality and prevalence in Mexico. https://gco.iarc.fr/today/data/factsheets/populations/484-mexico-fact-sheets.pdf
American Cancer Society. (2023). Cáncer de seno. https://www.cancer.org/es/cancer/tipos/cancer-de-seno/acerca/tipos-de-cancer-de-seno.html
Yang, L., & Lin, P. C. (2017). Mechanisms that drive inflammatory tumor microenvironment, tumor heterogeneity, and metastatic progression. Seminars in Cancer Biology, 47(August), 185–195. https://doi.org/10.1016/j.semcancer.2017.08.001
Lim, B., Woodward, W. A., Wang, X., Reuben, J. M., & Ueno, N. T. (2018). Inflammatory breast cancer biology: the tumour microenvironment is key. Nature Reviews Cancer, 18(8), 485–499. https://doi.org/10.1038/s41568-018-0010-y
Perez-Yepez, E. A., Ayala-Sumuano, J.-T., Lezama, R., & Meza, I. (2014). A novel β-catenin signaling pathway activated by IL-1β leads to the onset of epithelial-mesenchymal transition in breast cancer cells. Cancer Letters, 354(1), 164–171. https://doi.org/10.1016/j.canlet.2014.08.015
Mendoza-Rodríguez, M., Arévalo Romero, H., Fuentes-Pananá, E. M., Ayala-Sumuano, J.-T., & Meza, I. (2017). IL-1β induces up-regulation of BIRC3, a gene involved in chemoresistance to doxorubicin in breast cancer cells. Cancer Letters, 390, 39–44. https://doi.org/10.1016/j.canlet.2017.01.005
Mendoza-Rodríguez, M., Ayala-Sumuano, J., García-Morales, L., Zamudio-Meza, H., Pérez-Yepez, E., & Meza, I. (2019). IL-1β Inflammatory Cytokine-Induced TP63 Isoform ∆NP63α Signaling Cascade Contributes to Cisplatin Resistance in Human Breast Cancer Cells. International Journal of Molecular Sciences, 20(2), 270. https://doi.org/10.3390/ijms20020270
Mouhamed, Y., Vishnyakov, A., Qorri, B., Sambi, M., Frank, S. S., Nowierski, C., Lamba, A., Bhatti, U., & Szewczuk, M. R. (2018). Therapeutic potential of medicinal marijuana: an educational primer for health care professionals. Drug, Healthcare and Patient Safety, 10, 45–66. https://doi.org/10.2147/DHPS.S158592
Nahler, G. (2022). Cannabidiol and Other Phytocannabinoids as Cancer Therapeutics. In Pharmaceutical Medicine (Vol. 36, Issue 2). Springer International Publishing. https://doi.org/10.1007/s40290-022-00420-4
García-Morales, L., Castillo, A. M., Tapia Ramírez, J., Zamudio-Meza, H., Domínguez-Robles, M. D. C., & Meza, I. (2020). CBD Reverts the Mesenchymal Invasive Phenotype of Breast Cancer Cells Induced by the Inflammatory Cytokine IL-1β. International Journal of Molecular Sciences, 21(7), 2429. https://doi.org/10.3390/ijms21072429
García-Morales, L., Mendoza-Rodríguez, M. G., Tapia Ramírez, J., & Meza, I. (2023). CBD Inhibits In Vivo Development of Human Breast Cancer Tumors. International Journal of Molecular Sciences, 24(17), 13235. https://doi.org/10.3390/ijms241713235